MicroRNA-338-3p真核表达载体的构建及其对胃癌细胞SGC-7901增殖的影响
2014-06-27王文静赵正豪赵凌宇汪鲁敏胡丽丽宋土生
郭 波,王文静,赵正豪,赵凌宇,汪鲁敏,胡丽丽,宋土生,黄 辰,3
(西安交通大学医学院:1.遗传学与分子生物学系;2.第一附属医院肝胆外科; 3.心血管研究中心,陕西西安 710061)
微小RNA(microRNA, miRNA)是一类进化上高度保守的单链非编码RNA小分子,是LEE等[1]于1993年在秀丽小杆线虫的研究中发现的,其长度约为21~25 nt,广泛存在于真核生物中,大部分由基因的内含子部位剪切产生。目前的研究表明,miRNA分子通过两种[2-3]不同机制调节蛋白的表达,当miRNA和编码蛋白质的mRNA几乎完全配对时,miRNA诱导mRNA降解,这种miRNA介导的基因沉默机制在植物中比较普遍;当miRNA和编码蛋白质的mRNA不完全配对时,miRNA通过不完全的碱基配对结合mRNA的3’UTR,在转录水平上抑制基因翻译,从而调节细胞增殖[4]、周期[5]、侵袭转移[6]及凋亡[7],参与机体的发育、代谢以及肿瘤的发生、发展等生物学过程。近期的研究结果表明,miR-338-3p在肝癌中能通过抑制SMO的表达而阻止肝癌细胞的迁移,提示miR-338-3p在肿瘤的发生过程中可能扮演类似抑癌基因的作用[8]。因此,本实验拟采用真核表达质粒pcDNATM6.2-GW/EmGFP-miR,构建miR-338-3p的特异性过表达载体pcDNATM6.2-GW/EmGFP-miR-338-3p,并鉴定其在人胃癌SGC-7901细胞系中的表达活性与效率,探究miR-338-3p对SGC-7901细胞系增殖能力的影响,为后期深入研究miR-338-3p在胃癌发生发展中的作用机制及基于miR-338-3p的基因靶向治疗策略研究提供前期实验基础。
1 材料与方法
1.1质粒、菌株和试剂质粒pcDNATM6.2-GW/EmGFP-miR购自Invitrogen公司;Top10菌株为本实验室保存;氨苄青霉素(新泰生物公司);限制性内切酶EcoRⅠ、HindⅢ及T4DNA连接酶(TaKaRa公司);DNA凝胶回收试剂盒、无内毒素质粒提取试剂盒(Omega公司);RNA提取试剂Trizol(Invitrogen公司)。
1.2miR-338-3p寡聚核苷酸合成通过生物信息学方法在miRbase查找miRNA-338-3p成熟体序列并在两端构建HindⅢ和EcoRⅠ酶切位点。Top oligo5′-AATTCTCTCCAACAATATCCTGGTGCTGA-GTGATGACTCAGGCGACTCCAGCATCAGTG-ATTTTGTTGAAGAA-3′;Bottom oligo 5′-AGCTTTCTTCAACAAAATCACTGATGCTGGAGTCG-CCTGAGTCATCACTCAGCACCAGGATATTGT-TGGAGAG-3′,序列由上海生工生物工程有限公司合成。
1.3载体构建与鉴定真核表达载体pcDNATM6.2-GW/EmGFP-miR经EcoRⅠ和HindⅢ双酶切,琼脂糖凝胶电泳回收酶切后片段,回收产物与退火成双链的miR-338-3p DNA序列在T4DNA连接酶作用下于16 ℃连接过夜;将连接产物转化入Top10感受态大肠杆菌,利用Amp抗性对重组子进行筛选培养12 h,挑取阳性单克隆菌落,于LB(Amp+)液体培养基摇床培养14h后送上海生工生物公司进行DNA测序。
1.4细胞培养与转染人胃癌SGC-7901细胞系培养于含PS和胎牛血清FBS(Gibco公司)的DMEM(PAA公司)培养基中,并置于37 ℃的CO2孵育箱中,2~3 d换液,取对数生长期的细胞进行实验;设pcDNATM6.2空载体组为对照,实验组按X-tremeGENE_HP_DNA_Transfection_Reagent(Roche公司)转染试剂说明书瞬时转染pcDNATM6.2-GW/EmGFP-miR-338-3p表达载体的无内毒素质粒。
1.5Real-timePCR检测miR-338-3p在瞬转细胞系中的表达Trizol提取SGC-7901细胞总RNA;逆转录试剂盒PrimeScript®RT reagent kit和Real time PCR试剂盒SYBR®Premix ExTaqTMⅡ(Perfect Real Time)均购自TaKaRa公司;PCR反应引物序列:RT-primer:5′-GTCGTATCCAGTGCGTGTCG-TGGAGTCGGCAATTGCACTGGATACGACCA-ACAAA-3′;Forward primer:5′-ATCCAGTGCGTGTCGTG-3′;Reverse primer:5′-TGCTTCCAGCATCAGTGAT-3′;逆转录反应体系及条件:500 ng RNA,2 μL 5×PrimeScript®Buffer,0.5 μL PrimeScript®RT Enzyme Mix I,4.5 μL Rnase free water和1 μL stem loop RT primers,42 ℃ 15 min,85 ℃ 5 s;Real-time PCR反应体系及条件:逆转录产物1 μL,10 μL 2×SYBR Premix ExTaqⅡ,7 μL Rnase free water,1 μL Forward primer和1 μL Reverse primer,95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.6MTT实验调整细胞密度接种于96孔板,每组设置3个复孔,置于细胞培养箱中培养,24 h后转染质粒,利用MTT在活细胞线粒体的琥珀酸脱氢酶作用下,由淡黄色被还原成蓝紫色或蓝黑色的MTT-甲肷,分别在第24、48、72 h取出细胞加入MTT[3-(4,5-二甲基噻唑-2)-2,5二苯基四氮唑嗅盐]液,37 ℃孵育4 h后加入DMSO,利用酶标仪测定490 nm处各孔吸光度(A)值,以反映细胞数目并绘制细胞生长曲线。
2 结 果
2.1pcDNATM-GW/EmGEP-miR-338-3p表达载体的构建人工合成的miR-338-3p DNA单链退火为双链,琼脂糖凝胶电泳鉴定,可见70 bp大小目的条带(图1A);LB液体培养基扩增pcDNATM6.2-GW/EmGFP-miR真核表达载体菌株,提取质粒后用EcoRⅠ和HindⅢ双酶切,琼脂糖凝胶电泳鉴定并回收大片段,可见5 000 bp左右大小目的条带(图1B)。
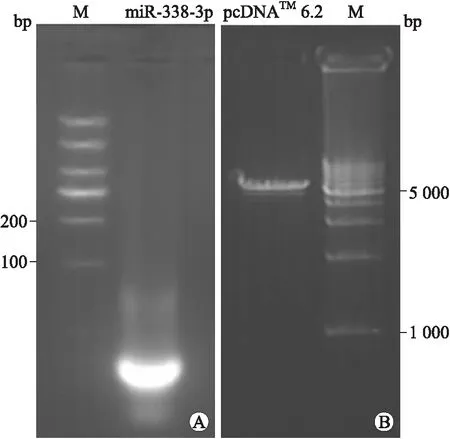
图1miR-338-3pDNAoligo退火及pcDNATM6.2的双酶切
Fig.1 The product of miR-338-3p DNA oligo and pcDNA 6.2 by enzyme digestion
A:miR-338-3p人工合成DNA oligo退火产物电泳图;B:pcDNATM6.2-GW/EmGFP-miR经EcoRⅠ和HindⅢ双酶切后电泳图。M:Marker。
2.2pcDNATM-GW/EmGEP-miR-338-3p表达载体的鉴定将LB(Amp+)抗体筛选的阳性单克隆扩增培养后测序,与miR-338-3p DNA oligo序列进行Blast比对可见完全匹配(图2A);构建成功的pcDNATM6.2-GW/EmGFP-miR-338-3p的表达图谱(图2B)。
2.3SGC-7901细胞瞬时转染及实时荧光定量PCR将构建成功的pcDNATM6.2-GW/EmGFP-miR-338-3p表达载体瞬时转染人胃癌细胞系SGC-7901,Real-time PCR检测转染后miR-338-3p的表达量,结果显示(图3),与对照组相比,实验组中miR-338-3p的表达水平显著增加(P<0.05)。
2.4过表达miR-338-3p抑制SGC-7901胃癌细胞的增殖转染pcDNATM6.2-GW/EmGFP-miR-338-3p表达载体后检测miR-338-3p对细胞增殖能力的影响,MTT结果显示(图4),48 h后实验组中SGC-7901细胞的增殖有明显降低(P<0.05),提示miR-338-3p可抑制胃癌细胞SGC-7901的增殖。
3 讨 论
MiRNA可通过与mRNA匹配在转录后水平抑制基因翻译,导致其靶基因的蛋白表达水平下调,进而调节细胞多种生命活动[9]。一方面,miRNA在肿瘤的发生发展中具有原癌基因的作用,细胞的增殖研究发现miR-106b在前列腺癌、胃癌、食管癌、直肠癌等多种肿瘤中表达上调,提示其可能为一种原癌基因[10]。PETROCCA等[11]发现miR-106b可负调节E2F1基因的表达,研究发现高水平的E2F1可促进细胞凋亡,被miR-106b负调节的E2F1可反式激活多种基因促进细胞G1/S转换;另一方面,miRNA又可以抑制恶性肿瘤的发生,MOTT等[4]发现在33%的人胆管癌保本和胆管癌细胞系KMCH中miR-29b表达下调,通过在KMCH细胞中过表达miR-29b可促进其Mcl-1蛋白的表达。Mcl-1基因是一种凋亡相关癌基因,其可通过抑制bax基因的表达促进细胞凋亡。提示miR-29b可作为胆管癌治疗的靶分子。
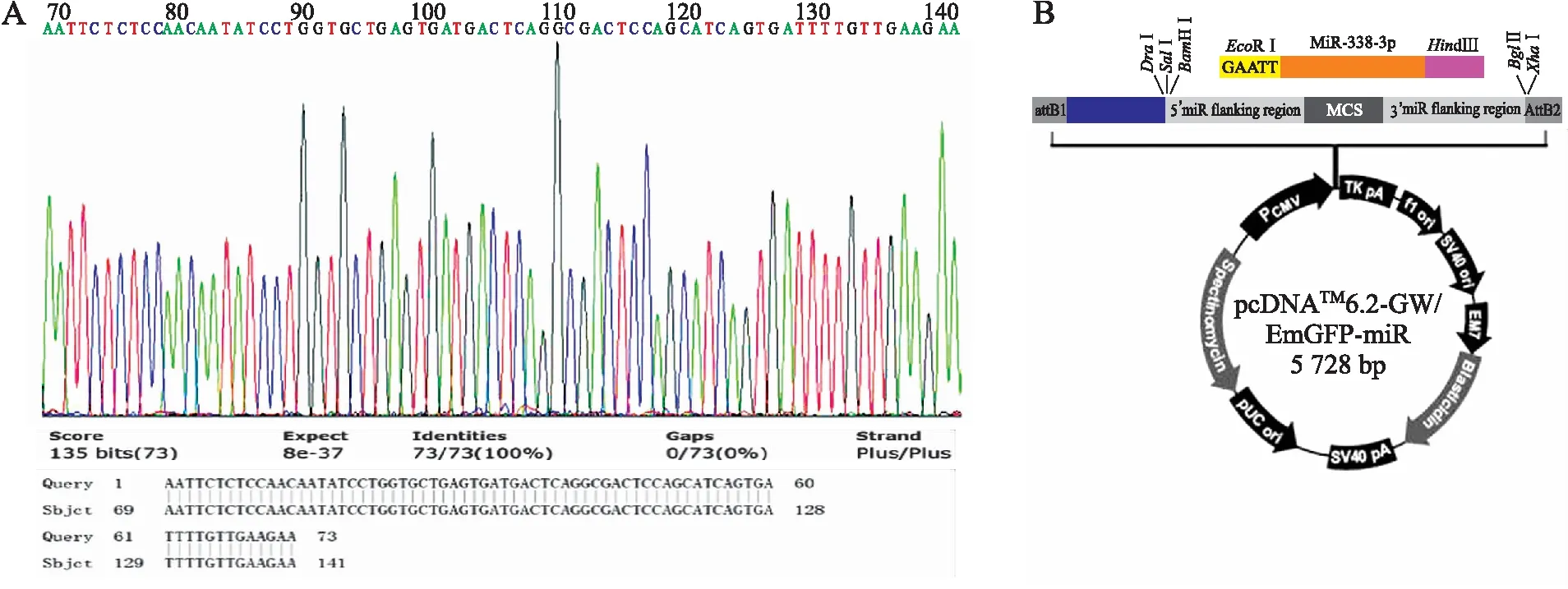
图2pcDNATM6.2-GW/EmGEP-miR-338-3p表达载体的测序鉴定结果
Fig.2 The identification of pcDNATM6.2-GW/EmGEP-miR-338-3p expression vector by sequencing
A:pcDNATM6.2-GW/EmGFP-miR-338-3p表达载体与目的miR-338-3p序列blast比对结果及测序结果;B:将miR-338-3p的DNA序列插入到编辑区域成功构建的pcDNATM6.2-GW/EmGEP-miR-338-3p表达载体的图谱。
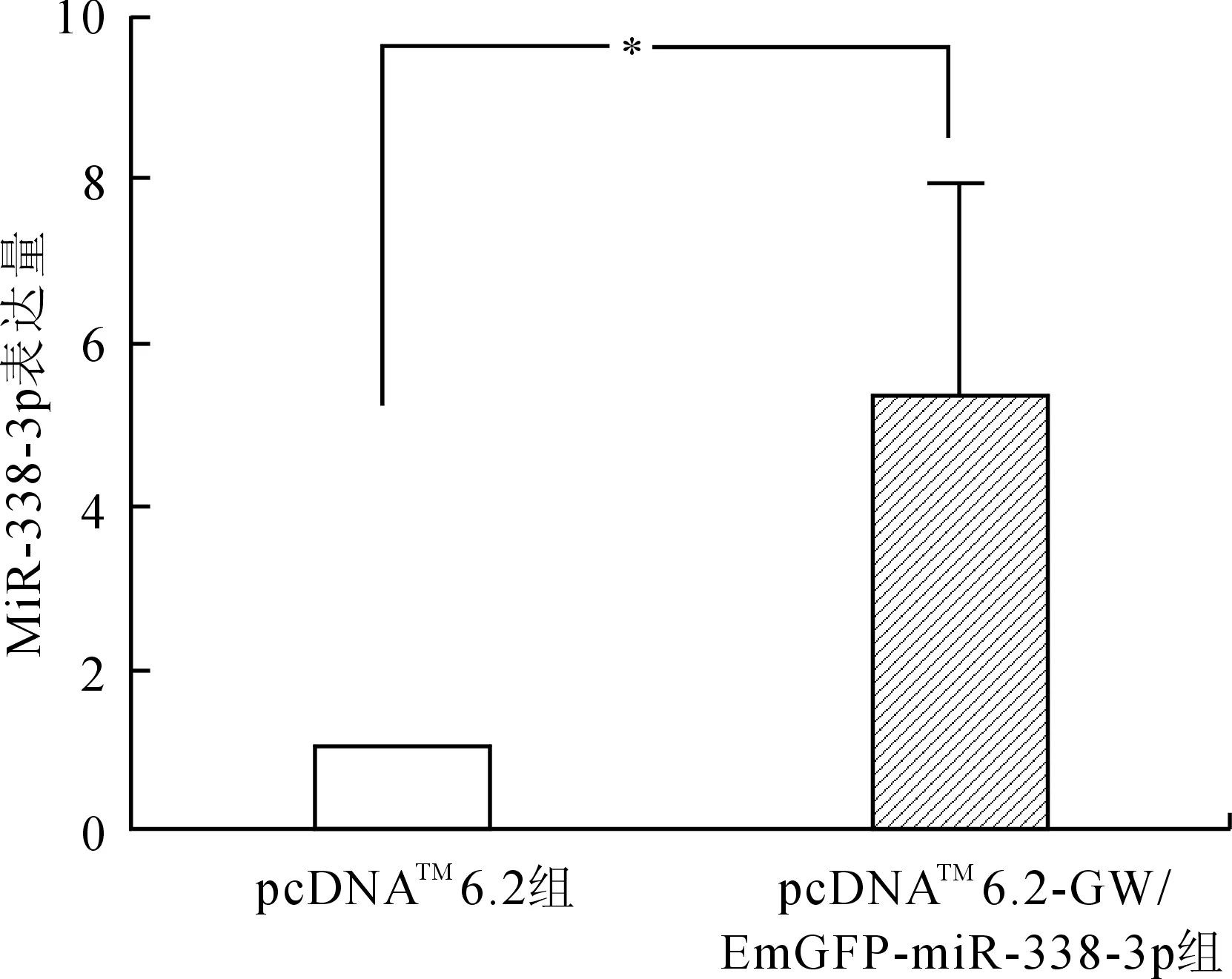
图3pcDNATM6.2-GW/EmGFP-miR-338-3p转染SGC-7901细胞表达水平
Fig.3 The expression level in SGC-7901 cells after transfected with pcDNATM6.2-GW/EmGFP-miR-338-3p
*P<0.05。
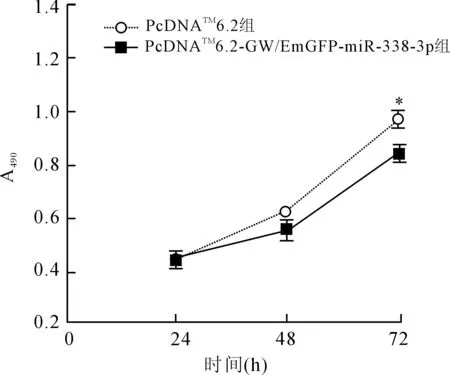
图4MTT法检测miR-338-3p对SGC-7901细胞增殖的影响
Fig.4 The effect of miR-338-3p on the proliferation of SGC-7901 cells detected by MTT
*P<0.05。
MiRNA-338位于第17号染色体上,在不同物种间高度保守,由凋亡相关酪氨酸激酶(AATK)第七个内含子编码剪切为成熟的miRNA序列miR-338-3p和miR-338-5p,继而在细胞生长过程中发挥重要作用[12]。近来的研究显示,miR-338-3p在包括胃癌等[13]多种恶性肿瘤中均存在异常表达,如在肝癌、恶性黑色素瘤[14]等肿瘤中的表达量受到抑制,而在口腔癌中却呈现高表达趋势[15],HUANG等[8]的报道证明miR-338-3p可通过抑制SMO而阻止肝癌细胞的迁移。同时,ZHANG等[16]的研究应用鸢尾黄酮抑制肺成纤维细胞生长,可以诱导miR-338-3p的表达上调,继而抑制了miR-338-3p靶基因LPA1的表达。这些研究均提示,miR-338-3p在恶性肿瘤的发生过程中可能起到了重要的调控作用。
MiRNA在机体细胞内主要通过Ⅲ型启动子来完成转录表达[17],人为手段通过外源性miRNA干预细胞内的miRNA表达水平是目前研究miRNA生物学功能的主要手段,包括腺病毒和慢病毒表达载体以及人工化学合成miRNA的模拟物(mimics)在内的多种方法均能够在细胞内特异性的过表达某种特定的miRNA,而其中miRNA质粒真核表达载体的构建因其具有价格低廉、方法简便,能够模拟内源性miRNA前体的剪切过程等优点仍得到了广泛的应用。pcDNATM6.2-GW/EmGFP-miR是一种真核表达的特异性表达质粒,可通过转录提高细胞内特异性miRNA的表达水平,同时表达绿色荧光蛋白有利于鉴定转染效率。
在本研究中,我们以pcDNATM6.2-GW/EmGFP-miR真核表达载体为基础,经EcoRⅠ和HindⅢ双酶切和纯化后与人工合成miR-338-3p的寡聚核苷酸进行连接,转化至E.coliTop10后,经过DNA测序、BLAST检测及验证,结果表明我们成功构建了miR-338-3p特异性表达载体;将构建成功的无内毒素质粒转染入SGC-7901细胞中,24 h通过Real time PCR发现转染了pcDNATM6.2-GW/EmGFP-miR-338-3p特异性表达载体后的SGC-7901实验组中miR-338-3p的表达量显著高于对照组;重要的是通过MTT实验,我们发现高表达miR-338-3p的实验组中SGC-7901细胞的增殖能力受到显著抑制,提示miR-338-3p可以抑制肿瘤细胞的增殖,发挥类似抑癌基因的功能,利用真核表达载体外源性表达miR-338-3p能够成为有效抑制胃癌细胞生长的重要手段,并为后期深入研究其在胃癌发生发展中的作用机制奠定了基础。
参考文献:
[1] LEE RC, FEINBAUM RL, AMBROS V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5):843-854.
[2] MISHRA PJ, BERTINO JR. MicroRNA polymorphisms: the future of pharmacogenomics, molecular epidemiology and individualized medicine[J]. Future Med, 2009, 10(3):399-416.
[3] SCHWARZ DS, HUTVAGNER G, DU T, et al. Asymmetry in the assembly of the RNAi enzyme complex[J]. Cell, 2003, 115(2):199-208.
[4] NG E, TSANG W, NG S, et al. MicroRNA-143 targets DNA methyltransferases 3A in colorectal cancer[J]. Brit J Cancer, 2009, 101(4):699-706.
[5] HE L, HE X, LIM LP, et al. A microRNA component of the p53 tumour suppressor network[J]. Nature, 2007, 447(7148):1130-1134.
[6] MENG F, HENSON R, WEHBE-JANEK H, et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J]. Gastroenterology, 2007, 133(2):647-658.
[7] JOHNSON DG, DEGREGORI J. Putting the oncogenic and tumor suppressive activities of E2F into context[J]. Curr Mol Med, 2006, 6(7):731-738.
[8] HUANG XH, CHEN JS, WANG Q, et al. miR-338-3p suppresses invasion of liver cancer cell by targeting smoothened[J]. J Pathol, 2011, 225(3):463-472.
[9] BARTEL DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2):215-233.
[10] VISONE R, CROCE CM. MiRNAs and cancer[J]. Am J Pathol, 2009, 174(4):1131-1138.
[11] PETROCCA F, VECCHIONE A, CROCE CM. Emerging role of miR-106b-25/miR-17-92 clusters in the control of transforming growth factor β signaling[J]. Cancer Res, 2008, 68(20):8191-8194.
[12] KOS A, LOOHUIS NFO, WIECZOREK ML, et al. A potential regulatory role for intronic microRNA-338-3p for its host gene encoding apoptosis-associated tyrosine kinase[J]. Plos One, 2012, 7(2):e31022.
[13] LI X, ZHANG Y, ZHANG Y, et al. Survival prediction of gastric cancer by a seven-microRNA signature[J]. Gut, 2010, 59(5):579-585.
[14] CARAMUTA S, EGYHAZI S, RODOLFO M, et al. MicroRNA expression profiles associated with mutational status and survival in malignant melanoma[J]. J Invest Dermatol, 2010, 130(8):2062-2070.
[15] SCAPOLI L, PALMIERI A, LO ML, et al. MicroRNA expression profiling of oral carcinoma identifies new markers of tumor progression[J]. Int J Immunopath Ph, 2010, 23(4):1229.
[16] ZHANG H, LIU X, CHEN S, et al. Tectorigenin inhibits theinvitroproliferation and enhances miR-338 expression of pulmonary fibroblasts in rats with idiopathic pulmonary fibrosis[J]. J Ethnopharmacol, 2010, 131(1):165-173.
[17] LI SC, TANG P, LIN WC. Intronic microRNA: discovery and biological implications[J]. Dna Cell Biol, 2007, 26(4):195-207.
