连续降温对大菱鲆成鱼代谢机能的影响
2014-06-26纪利芹蒋克勇韩龙江袁坤山邱楚雯王宝杰温海深
纪利芹,蒋克勇,韩龙江,袁坤山,邱楚雯, 王宝杰,刘 梅,王 雷,温海深
(1.中国海洋大学 水产学院,山东 青岛 266003;2.中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室,山东 青岛 266071;3.青岛科技大学 化学与分子工程学院,山东 青岛 266061)
鱼类是变温动物,水温的变化必然会改变其新陈代谢,进而影响其生长、发育,并使之产生相应的生理变化甚至病理反应,水温也是影响鱼类养殖生产中的关键因素之一[1-3]。
大菱鲆(Scophthalmus maximus),属于鲽形目(Pleuronectiformes),鲆科(Bothidae),原主要产自于大西洋东侧沿岸,是较名贵的冷水性经济鱼类。自1992年被引进中国后,因其生长较快、耐低温、繁殖较快兼有胶质丰富、风味独特、市场价格高等优良特性,现已成为中国北方地区为数不多的养殖较为广泛的重要经济鱼类之一。目前,大菱鲆的养殖区域分布在以山东半岛、辽东半岛以及天津为主的北方沿海地区[4-7],随着大菱鲆养殖规模的扩大,市场影响力的提高,南方及内地市场越来越得到养殖户和商家的关注,所以如何保证其在长途运输过程中的品质成为急需解决的技术难题。
目前,生态冰温保活运输技术已成为鱼类保活运输研究的新方向,即利用鱼的生态冰温,采用控温方式,使其处于半休眠或完全休眠状态,从而降低新陈代谢,减少机械损伤,有效延长存活时间,达到长距离、大批量保活运输的目的。而且该方法无需用水,节能环保,并且水产品品质能够得到更好的保持,应用前景广阔[8-9]。
血液是动物体内循环系统中的重要组织,具有运输营养和代谢废物、机体免疫等功能[10]。由Selye[11]的应激理论可知,在低温胁迫下,鱼体内生理变化一定会在血液指标中体现,因此血液指标能灵敏地反应鱼体的生理、病理变化,可作为动物的营养水平、健康状况及外界环境变化的生物指标[10,12-16]。鱼类以糖原、脂肪和蛋白质作为主要贮能物质,外界环境变化时,鱼体最先分解糖原提供能量,且主要以分解肝糖原为主。氧气不足时肌肉通过糖酵解途径产生乳酸,因此肝糖原和肌肉中乳酸值的变化能从侧面反映体内的能量变化。作者初步研究了连续降温对大菱鲆成鱼肝脏、肌肉及血清代谢等指标的影响,试图了解大菱鲆的冷应激耐受性,并为大菱鲆的无水保活技术提供理论依据。
1 材料与方法
1.1 实验材料
实验用大菱鲆购自山东青岛市南山水产品批发市场,个体初始体质量为(400±46)g,暂养于实验室控温循环水过滤系统,暂养期间控制水温为(18.0±1)℃,溶氧为6 mg/L以上,pH约为7~8,盐度为31,暂养2 d后,选取规格一致的成鱼30尾进行实验。
1.2 实验设计
通过设计的降温循环水装置实现逐渐变温,大菱鲆的采样温度点分别为: 18℃、13℃、8℃、5℃、3℃和1℃,水温降温速率设置为: ≤5℃/h (10℃以上)、≤2℃/h (10~1℃)。实验开始前取样测定一次指标作为起始对照;降温开始后,待温度降到设定的温度点处立刻进行取样,每个温度点处取样6尾。
1.3 样品采集
开始降温后在 13℃、8℃、5℃、3℃和 1℃处立刻进行随机取样,每个温度点处取6尾平行。取出后立刻放入质量浓度为 200 mg/L的MS-222溶液中做快速深度麻醉,配置MS-222溶液所用水的温度与取样时的温度一致,尾静脉采血,用 1mL注射器于鱼尾柄动脉采血5 mL以上,血液不加抗凝剂,在4℃冰箱静置5 h后,用离心机4℃、12 000 r/min、离心20 min制备血清,血清移入–80℃保存。采血后解剖,取出肝脏、肌肉等组织用液氮速冻后置于–80℃冰箱保存备用。
1.4 血清生化指标的分析
制备好的血清采用全自动生化分析仪测定部分生化指标(迈瑞 BS-180),测定项目包括: 总蛋白、白蛋白、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆红素、尿素、总胆固醇、甘油三酯和血糖。
1.5 肝糖原、肌肉乳酸含量的测定
肝糖原、肌肉乳酸含量的测定分别使用南京建成生物工程研究所的肝糖原试剂盒(A043)和乳酸试剂盒(A019-2),其中肝脏与肌肉样品按照试剂盒说明书进行制备、处理。
1.6 数据处理
数据采用 Spss17.0统计软件包中的单因素方差分析(ANOVA)和 Duncan氏多重范围比较进行分析,P<0.05表示有显著差异,所有结果均以平均值±标准差表示。
2 结果与分析
2.1 连续降温对鱼体血清蛋白浓度的影响
由图1可知,在连续降温过程中,血清中总蛋白和白蛋白的浓度变化趋势整体一致: 均随温度降低而升高,总蛋白在 8℃时浓度达到最高(52.33±9.61)g/L,温度降到 1℃时,浓度下降到初始水平附近。13℃实验组总蛋白浓度显著低于3℃实验组浓度(P<0.05),其余各组之间无显著差异(P>0.05)。
血清白蛋白在3℃时浓度达到最高值为(30.67±5.32)g/L,1℃时浓度也下降到初始浓度附近,与总蛋白在1℃时浓度变化相似,且1℃时的白蛋白浓度显著低于 3℃时的浓度(P<0.05),其余各组之间没有显著差异(P>0.05)。
2.2 连续降温对鱼体血糖和肝糖原的影响
由图2A可知,大菱鲆血糖浓度随温度的降低呈现先降低后升高再降低的趋势,在 13℃时降到最低水平(0.85±0.22)mmol/L,在 3℃时含量达到最高(1.85±0.14)mmol/L,当温度降到 1℃时血糖含量又降到初始水平,且8℃、5℃、3℃实验组浓度显著高于其余实验组(P<0.05)。
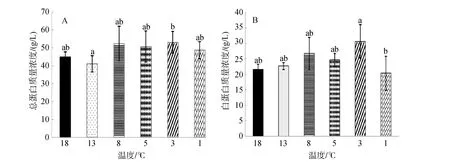
图1 连续降温对大菱鲆血液总蛋白及白蛋白质量浓度的影响Fig.1 Effects of continuous cooling on mass concentrations of serum total protein and serum albumin in Scophthalmus maximus
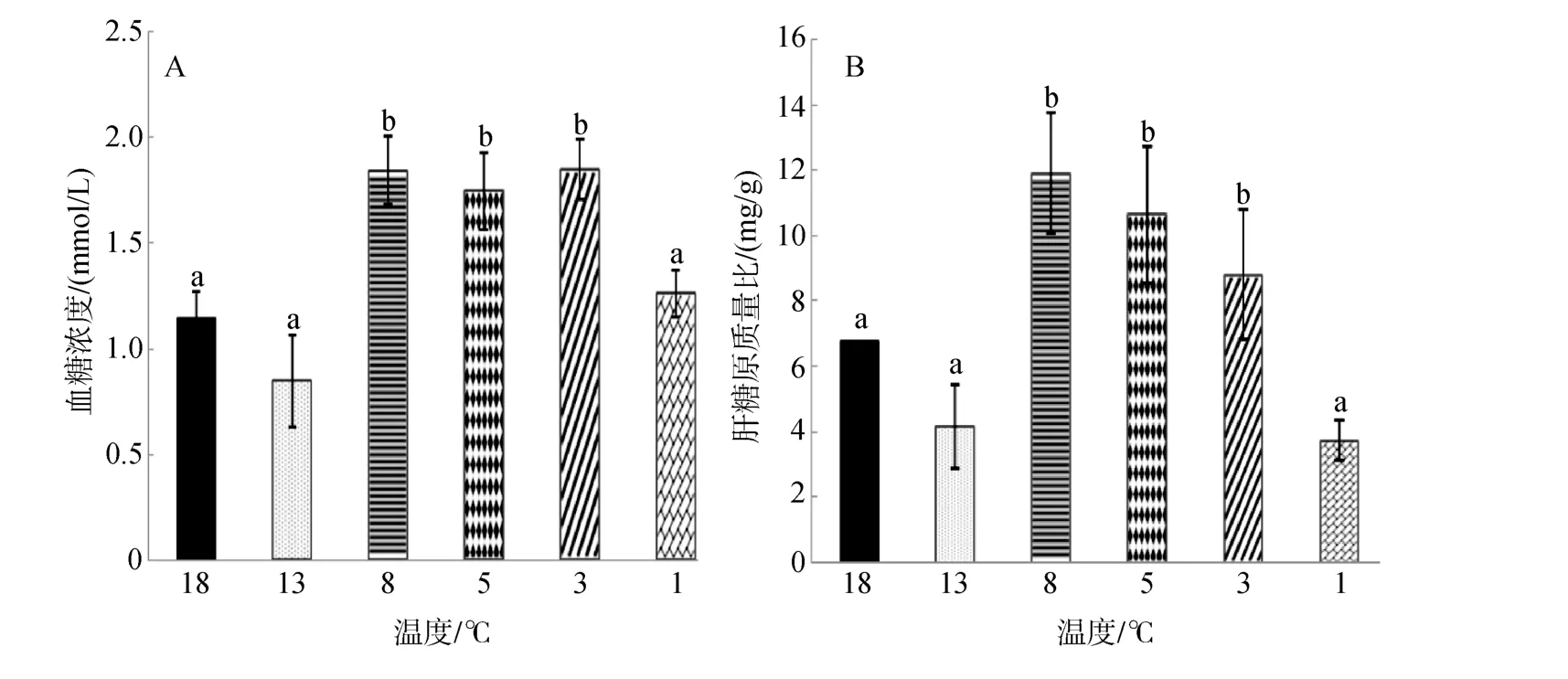
图2 连续降温对大菱鲆血液血糖浓度和肝糖原质量分数的影响Fig.2 Effects of continuous cooling on concentrations of serum glucose and contents of liver glycogen in Scophthalmus maximus
由图2B可知,肝糖原含量与血糖浓度变化趋势一致,随温度降低呈现先降低后升高再降低的趋势,在 8℃时浓度最高为(11.92±1.84)mg/g,最后当温度降到1℃时回到初始水平,且 8℃、5℃、3℃实验组浓度显著高于其余实验组(P<0.05)。
2.3 连续降温对鱼体脂类的影响
由图3A可知,大菱鲆总胆固醇浓度随温度降低整体呈现升高趋势,8℃时浓度低于初始水平,其余各组浓度均高于初始水平,3℃时浓度最高为(8.02±1.05)mmol/L,显著高于初始水平(P<0.05),其余各实验组之间无显著性差异(P>0.05)。
由图3B可知,甘油三酯浓度随温度降低呈现先升高后降低趋势,各实验组的浓度均高于初始水平,且各实验组之间无显著差异(P>0.05)。
由图4A可知,高密度脂蛋白胆固醇的浓度开始时随温度下降而升高,当温度降到 5℃时,浓度达到最高(5.74±0.42)mmol/L,温度再降低时,高密度脂蛋白浓度随之降低,但都高于18℃时的初始浓度。5℃实验组的高密度脂蛋白浓度和 18℃实验组之间存在显著差异(P<0.05),其余各组之间没有显著差异(P>0.05)。
由图4B可知,低密度脂蛋白胆固醇的浓度随温度降低整体呈现先升高后降低再升高的趋势,当温度降到 5℃时,浓度达到最低值(4.50±1.62)mmol/L,继续降低至 3℃时,浓度达到最高值(6.72±2.42)mmol/L,各实验组之间无显著性差异(P>0.05)。
2.4 连续降温对大菱鲆代谢产物的影响
由图5A可知,随温度降低尿素浓度先降低后升高再降低,在8℃时浓度达最高值(3.34±0.03)mmol/L,在1℃时降到最低值(0.58±0.03)mmol/L,且1℃时的浓度值显著低于 8℃时(P<0.05),其余各组之间没有显著差异(P>0.05)。

图3 连续降温对大菱鲆血清总胆固醇浓度和甘油三酯浓度的影响Fig.3 Effects of continuous cooling on concentrations of serum total cholesterol and serum triglyceride in Scophthalmus maximus
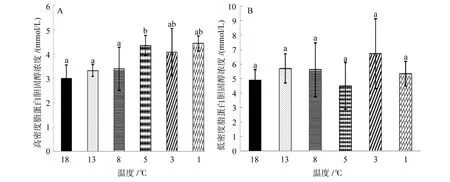
图4 连续降温对大菱鲆血清高密度脂蛋白胆固醇浓度和低密度脂蛋白胆固醇浓度的影响Fig.4 Effects of continuous cooling on concentrations of serum high density lipoprotein cholesterol and low density lipoprotein cholesterol in Scophthalmus maximus
由图 5B可知,乳酸含量随温度降低呈现升高趋势,降到 5℃时达到最高值为(0.615±0.11)mmol/g,18℃时浓度达到最低值为(0.523±0.087)mmol/g,18℃组与 5℃组之间存在显著差异(P<0.05),其余各实验组之间没有显著性差异。
3 讨论
3.1 连续降温对大菱鲆血清蛋白质含量的影响
血清中的总蛋白主要包括白蛋白和球蛋白,白蛋白主要由肝脏合成,有维持血浆渗透压、参与机体免疫、运输、营养等功能,球蛋白由淋巴细胞转化成的浆细胞分泌形成,在机体的特异性免疫中发挥重要作用[17-19]。本实验中,温度降到 8℃以下时,总蛋白和白蛋白随温度降低均有逐渐升高的趋势,可能是随着温度降低,大菱鲆受到冷刺激处于应激状态,肝脏开始合成应激蛋白,而到1℃时白蛋白浓度又降低,可能是此时的温度已超过了大菱鲆的耐受范围,肝脏开始受损,各种代谢酶的活性受到抑制。这与常玉梅等[17-20]的观点一致。
3.2 连续降温对鱼体血糖和肝糖原的影响
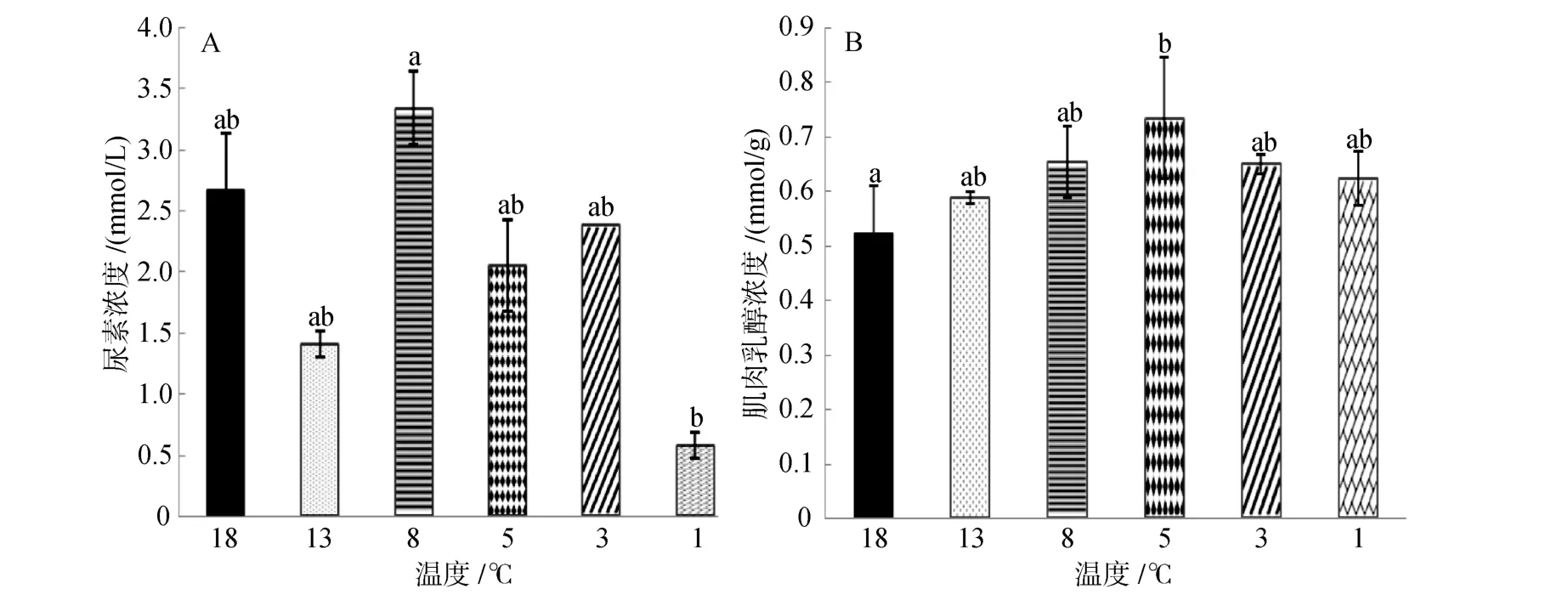
图5 连续降温对大菱鲆血清尿素浓度和肌肉乳酸浓度的影响Fig.5 Effects of continuous cooling on concentrations of serum urea and lactic acid of muscle in Scophthalmus maximus
血糖是机体的主要供能物质,正常情况下,其在血液中的含量在一定范围内保持相对稳定。一些研究发现,应激状态下,鱼体的血糖含量明显升高,产生高血糖症[21-25],当环境温度下降早期,生物体内的适应性变化以血糖代谢增加为主,即体内的糖元转化为葡萄糖量增加,产生热量以增强御寒功能,机体在代谢产热过程中,血糖大量消耗,机体和脏器组织的抗寒能力下降[17,26]。随着低温胁迫的加强或胁迫时间的延长,机体将大量的葡萄糖分解成三磷酸腺苷(ATP)提供能量,又使葡萄糖浓度下降。本实验中葡萄糖的变化规律与此规律相符,在 8~3℃实验组的血清葡萄糖浓度显著高于其余实验组,说明在3℃之前大菱鲆处于应激状态,温度降低血糖含量升高以增强鱼体的抗胁迫能力,当温度继续降低到 3℃以下,大菱鲆机体葡萄糖代谢酶活性降低,使葡萄糖产生量减少且大部分血糖被分解生成 ATP,消耗量增加,使血糖总量减少,而 1℃实验组与对照组无显著差异。
肝糖原含量的变化与血清葡萄糖含量变化趋势一致,原因可能是: 血清葡萄糖浓度的升高意味着需要更多的糖原分解提供葡萄糖,而鱼体内血清葡萄糖一般是由肝糖原分解提供[21,27],所以为满足血清葡萄糖含量的增加,肝脏也增加了肝糖原的合成量。
3.3 连续降温对鱼体脂类的影响
血液高密度脂蛋白胆固醇和低密度脂蛋白胆固醇分别是高、低密度脂蛋白中结合的胆固醇,能相应反映高、低密度脂蛋白的多少。血液中总胆固醇的含量应该是高、低密度脂蛋白综合作用的结果,高密度脂蛋白的合成和分泌在肝脏和肠内进行,本实验中,随温度降到 5℃时,高密度脂蛋白含量显著升高而使更多的血液胆固醇被转运至肝脏,从而使3℃时的血浆胆固醇含量降低,但是低密度脂蛋白含量升高则会将更多的胆固醇和甘油三酯转运到血液中,二者综合作用使得血清总胆固醇含量升高[26,28]。
低密度脂蛋白能将甘油三酯运送至血液,所以低密度脂蛋白的含量会对血清中甘油三酯的含量产生影响,这一关系表现为甘油三酯与低密度脂蛋白随温度降低变化趋势一致。
甘油三酯是植物和动物细胞贮脂的主要形式,温度急剧下降会减弱鱼体细胞膜的脂流动性和弹性而使膜损坏或通透性增加,因此细胞膜的脂组成和结构会影响细胞的抗寒性[12,17]。鱼类的脂肪酸代谢对体温降低的适应很敏感,通过积累磷脂中长链不饱和脂肪酸的含量,使膜在低温胁迫时仍保持稳定性和流动性[29-33],从而提高自身的抗寒能力。本研究通过连续降温实验发现,与常温的对照组相比,降温组的甘油三酯的含量都有增加但无显著性差异,这说明连续降温对鱼体细胞膜没有实质性的损害。
3.4 连续降温对代谢产物的影响
尿素是蛋白质和氨基酸在代谢过程中脱去氨基,由氨基代谢生成[17,34],此过程在肝脏中进行。本实验中,除 8℃组外,其余各组与对照组相比含量都有所降低,可能与温度降低导致体内蛋白质的代谢速率降低,尿素产量减少有关。大菱鲆的温度耐受范围大约在 20~8℃,8℃是尿素浓度变化的一个转折点,一定程度上说明8℃是大菱鲆适温范围的下限。
氧气不足情况下,肌肉通过糖酵解途径产生乳酸并且迅速提供能量。血液流速缓慢、氧气摄入量不足以及剧烈的运动都会导致体内乳酸含量升高[21,35]。刘伟东[36]研究发现,大菱鲆在低温保活过程中随时间的延长,呼吸频率迅速降低,鳃的煽动幅度也随保活时间逐渐减弱,呼吸频率降低使氧气的吸入量减少,部分组织器官出现无氧代谢使乳酸生成量增多,并且低温时,鱼体内的新陈代谢逐渐降为较低水平,乳酸的代谢受阻,乳酸生成量的增多和排出量的减少都将导致肌肉中乳酸含量的增多[37],这与本实验研究结果一致。
4 小结
综合分析实验中大菱鲆机体代谢指标变化趋势发现: 当温度在 18~8℃范围时,为抵御温度降低,大菱鲆体内相应代谢开始发生改变以抵消低温对鱼体产生的不利影响,此时,由于温度范围在大菱鲆的耐受范围之内,大菱鲆通过调节自身的代谢能够维持内环境的相对稳定,因而在此温度范围内并未出现应激反应;当温度降到8~3℃时,此温度范围已超过大菱鲆的正常生活温度,内环境的稳定受到一定的影响,体内开始出现应激反应,某些指标浓度相对于初始降温有显著性差异;当温度继续低到 1℃时,各指标浓度基本处于较低状态,说明在此低温度区间内,大菱鲆体内各种代谢反应的酶活力降到极低程度,体内的应激反应和各种代谢反应基本处于停滞状态,说明 3~1℃温度区间与大菱鲆的生态冰温点比较接近,在此温度区间大菱鲆代谢程度极低,接近于半休眠或休眠状态,可以在此温度区间附近进一步进行无水保活的探索,在保证大菱鲆无水运输可行性的基础上优化经济成本。
肌肉中乳酸含量过高会影响鱼体口感,这是冰温运输中产生的负面影响,在以后的研究和实践过程中应引起注意。
低温无水保活运输还有很多有待深入研究的工作: 筛选机体内较灵敏的代谢指标来反映低温运输过程中鱼体内的代谢状况,探索大菱鲆的降温生理极限及其在无水低温运输过程中的耐受时间,同时无水低温运输过程中产生的负面影响也是不可忽视,值得深入探索的。
[1]刘波,王美垚,谢骏,等.低温应激对吉富罗非鱼血清生化指标及肝脏 HSP70基因表达的影响[J].生态学报,2011,31(17): 4866-4873.
[2]王辉,强俊,王海贞,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼能量代谢的联合效应[J].中国水产科学,2012,19(1): 51-61.
[3]强俊,徐跑,何杰,等.温度与盐度对吉富品系尼罗罗非鱼仔鱼生长与存活的联合影响[J].中国水产科学,2011,18(6): 1300-1308.
[4]雷霁霖,马爱军,陈超,等.大菱鲆(Scophthalmus maximus)养殖现状与可持续发展[R].中国工程科学,2005,7(5): 30-34.
[5]米娜莎,王栋.大菱鲆产业现状及发展趋势分析[J].海洋科学,2011,35(6): 96-99.
[6]雷霁霖,马爱军.大菱鲆(Scophthalmus maximus L.)胚胎及仔稚幼鱼胚胎发育的研究[J].海洋与湖沼,2003,34(l): 9-19.
[7]雷霁霖.大菱鲆养殖技术(修订版)[M].上海: 上海科学技术出版社,2005.
[8]殷邦忠,滕瑜.不同保活方法对菲律宾蛤仔保活效果的研究[J].海洋水产研究,1996,17(l): 76-81.
[9]刘淇,殷邦忠.牙鲆无水保活技术[J].中国水产科学,1996,2: 101-104.
[10]林浩然.鱼类生理学(2版)[M].北京: 高等教育出版社,2002: 57-67.
[11]Selye H.Stress and the general adaptation syndrome [J].British Medical Journal,1950,17(1): 1383-1392.
[12]冀德伟,李明云,王天柱,等.不同低温胁迫时间对大黄鱼血清生化指标的影响[J].水产科学,2009,28(1): 1-4.
[13]周玉,郭文场,杨振国,等.鱼类血液指标研究进展[J].上海水产大学学报,2001,10(2): 163-165.
[14]史增奎.重金属离子对鱼类血液指标影响的研究[J].渔业经济研究,2006,6: 45-48.
[15]SunY,Zhang B,Guo X W,et al.Effects of temperature on energybudget of Sparus macrocephalus[J].Actaecologica Sinica,2001,21(2): 186-190.
[16]Procarione L S,Barry T P,Malison J A.Effects of high reaing densities and loading rates on the growth and stress responses of juvenile rainbow trout[J].Aquaculture,1999,61: 91-96.
[17]常玉梅,曹鼎臣,孙效文,等.低温胁迫对鲤血清生化指标的影响[J].水产学杂志,2006,19(2): 71-75.
[18]林浩然.鱼类生理学[M].广州: 广东高等教育出版社,1999.
[19]王镜岩,朱圣庚,徐长法.生物化学(3版)[M].北京:高等教育出版社,2002.
[20]吴垠,张峰,桂远明,等.几种养殖鱼类越冬生理生化指标的变化Ⅲ—血清蛋白组分[J].大连水产学院学报,1995,10(4): 19-26.
[21]彭士明,施兆鸿,李杰,等.运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报,2011,35(6): 831-837.
[22]Ubokawa K,Watanabe T,Yoshioka M,et al.Effects of acute stress on plasma cortisol,sex steroid hormone and glucose levels in male and female sockeye salmon during the breeding season[J]. Aquaculture,1999,172: 335-349.
[23]Iversen M,Finstad B,Mckinley R S,et al.Stress responses in Atlantic salmon(Salmon salar L.)smolts during commercial well boat transports and effects on survival after transfer to sea[J].Aquaculture,2005,243:373-382.
[24]Urbinati E C, Deabreu J S,Dasilvacamargo A C,et al.Loading and transport stress of juvenile matrinxa(Brycon cephalus,Characidate)at various densities [J].Aquaculture,2004,229: 389-400.
[25]Wedemeyer G A.Physiological response of juvenile coho salmon(Oncorhynchus kisutch)and rainbow trout(Salmo gairdneri)to handling and crowding stress in intensive fish culture[J].Fisheries Board of Canada,1976,33 : 2699-2702.
[26]洪磊,张秀梅.环 境胁迫对许氏平 鲉和花鲈血糖、血沉降的影响[J].中国水产科学,2005,7(4): 414-418.
[27]Axelrod J,Reisine T D.Stress hormones: their interaction and regulation[J].Science,1984,224: 452-459.
[28]孙学亮,邢克智,陈成勋,等.急性温度胁迫对半滑舌鳎血液指标的影响[J].水产科学,2010,29(7):387-392.
[29]张羽航,鲍时翔,王延平,等.脂肪酸脱饱和的应用进展[J].生物工程进展,2001,21(2): 41-49.
[30]Dey I,Buda C,Wiik T,et al.Molecular and structural composition of phospolipids membrances in livers of marine and freshwater fish in relation to temperature[J].National Acad Sciences,1993,90(16): 7498-7502.
[31]Hazel J R.Effects of temperature on the structure and metabolism of cell membranes in fish[J].Am Physiological Soc ,1984,246(4pt2): 460-470.
[32]Buda C,Dey I,Balogh N,et al.Structural order of membranes and composition of phospholipids in fish brain cells during thermal acclimation[J].Proc Natl Acad Sci USA,1994,9(17): 8234-8238.
[33]支兵杰,刘伟,王立波,等.水温对怀头鲇血液学指标的影响[J].水产学杂志,2008,21(2): 64-70.
[34]冯广朋,庄平,章龙珍,等.温度对中华鲟幼鱼血液生化指标的影响[J].生态学杂志,2010,29(10):1973-1978.
[35]Iversen M,Finstad B,Mckinley R S,et al.Stress responses in Atlantic salmon(Salmo salar L.)smolts during commercial well boat transportions and effects on survival after transfer to sea[J].Aquaculture,2005,243: 373-382.
[36]刘伟东,薛长湖,殷邦忠,等.低温下大菱鲆有水和无水保活过程中生理生化变化的研究[J].渔业科学进展,2009,30(5): 69-74.
[37]刘淇,殷邦忠,姚健,等.牙鲆在低温无水保活过程中的生化变化[J].水产学报,1999,23(3): 296-299.
