刺参肠道微生物组成分析及产酶、溶血性试验
2014-06-26张喜昌费世洲常亚青刘小林王高学
张喜昌,费世洲,常亚青,刘小林,王高学
(1.大连海宝渔业有限公司,辽宁 旅顺 116045;2.西北农林科技大学 动物科技学院,陕西 杨凌 712100;3.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
海参是一种名贵海产动物,属于棘皮动物门(Echinodermata),是海参纲(Holothurioidea)动物的泛称。我国范围内的海参有20种可以食用。品质优良的食用海参不仅肉质软嫩,营养丰富,滋味腴美,风味高雅,而且具有生精益肾,固元助本的药用功效,是久负盛名的名馔佳肴。据《本草纲目拾遗》记载: 海参,味甘咸,补肾,益精髓,其性温补,足敌人参,故名海参。现代研究表明,海参具有提高记忆力、延缓衰老、固本培元等功效。
海参中的具有极高营养价值的品种——刺参(Apostichopus japonicus)一直以来就是八大海珍之一。刺参的蛋白质含量在55 % 以上,并且脂肪含量极低,只有 1.85 %,氨基酸种类全面,含量均衡,并且含有维生素B1,B2,B6,维生素A,维生素D,维生素E ,以及丰富的矿物元素,如Mn,Fe,Zn,Co,Se 等[1-2]。
随着市场需求的激增,近年来刺参已成为我国最重要的海水养殖品种。但是,在养殖集约化程度不断提高的过程中,水产养殖环境日益恶化和刺参种质资源逐步退化等原因,使刺参养殖的各个阶段病害频发,严重制约了该产业的健康持续发展[3]。传统的病害防治手段主要是使用抗生素及化学药物。由于缺乏明确的药物使用准则,抗生素和化药滥用、乱用的现象非常普遍,这些问题进一步导致了影响更为严重的耐药性及药物残留等问题,最终给水产品安全带来严重的危机[4]。
寻找安全有效的防治刺参病害的方法,成为目前刺参养殖业亟待解决的问题。益生菌是一类通过改善宿主肠道菌群生态平衡而发挥有益作用,从而提高宿主健康水平和健康状态的活菌制剂。益生菌作为一种高效、安全的病害防治手段受到越来越多的关注[5]。目前在国内水产养殖中应用的益生菌主要有光合细菌、拮抗菌、营养和产消化酶菌群(乳酸菌、酵母菌等)以及改善水质菌群(硝化细菌、反硝化菌等)。我国水产动物益生菌大多来自于畜禽益生菌的简单移植,基于水产动物本身的益生菌研究尚未大规模展开。陆源益生菌在水产养殖生物体内难以定植,并且存在以下问题: ①破坏水域环境中的微生态平衡;②利用效率低导致过度使用;③作为海水鱼的主养模式——网箱养殖无法施加。所以,从水产养殖动物体内或其生存的天然环境中直接分离筛选高效、可定植益生菌的研究已经得到越来越多的认可。
益生菌在调节并维持机体肠道微生态平衡、帮助营养物质的消化吸收等方面发挥着重要作用,Gate[6]认为,健康动物中正常的优势菌或次优势菌可以作为益生菌的来源。本研究以人工养殖的刺参和野生刺参为研究对象,采用纯培养的方法分析刺参肠道微生物组成,并对刺参肠道细菌进行了产酶试验分析,这对于刺参专用益生菌的研发具有十分重要的意义。益生菌必须满足其施用对象的安全性要求,而溶血性检测是体外检验细菌安全性的一条有效途经,同时大规模的溶血性试验,有助于我们正确认识动物肠道菌群与机体致病间的联系。本文在分析刺参肠道微生物组成及产酶试验的基础上,对初步筛选出的一批细菌(99株)进行了溶血性检测,一方面为刺参益生菌的研发提供了参考,另一方面也为机体致病机理的研究提供一些数据资料。试验确定了 6株细菌作为刺参肠道潜在益生菌,为进行刺参肠道益生菌的体内筛选奠定了基础。
1 材料与方法
1.1 材料
采集健康的野生刺参和养殖刺参各30头,其中野生刺参在 2011年10月由潜水员采自辽宁省旅顺海域,平均体重40.6 g ± 0.5 g,平均体长 10.1 cm ±1.0 cm;养殖刺参由辽宁省大连海宝渔业有限公司提供,平均体重32.1 g ± 0.5 g,平均体长7.6 cm ± 1.0 cm。
1.2 肠道菌的培养、分离和纯化
试验设置 4个处理组,分别为养殖刺参之肠壁组、内容物组和野生刺参之肠壁组、内容物组。肠道菌的培养、分离和纯化,参照Sawabe等[7]方法,先用75 % 酒精冲洗实验刺参体表,在无菌条件下,用剪刀剪开刺参体腔,取出刺参消化道,用 0.9 % 生理盐水冲洗肠道外壁,挤出肠道内容物。将采集的养殖和野生刺参的肠道内容物和肠壁分别置于无菌试管中,称重后,分别置于研钵内,用 5 mL无菌生理盐水充分研磨为均匀样品。用无菌生理盐水对样品进行倍比稀释至 10–6,各稀释度样品均用旋窝振荡器震荡均匀。选取合适浓度梯度,分别取100 μL涂布2216E平板,每个浓度下设置 3个重复,28℃条件下培养5 d。培养后选菌落生长分布均匀的平板进行菌落计数。选择细菌菌落数在30~300的平板,随机挑取40个单菌落并编号,在2216培养基上多次划线分离纯化,直到得到纯种菌株为止。将得到的纯种菌株保存于–80℃备用。
1.3 细菌鉴定
采用细菌基因组提取试剂盒(Bioteke)提取单克隆菌株的DNA作为模板,分别扩增16S rDNA基因片段,将PCR产物经1 % 的琼脂糖凝胶电泳检测后,送往上海生工生物公司进行双向测序,测序结果拼接后于NCBI网站进行Blast分析,并下载数株同代表菌株相似度高的菌株的16S rDNA序列,与代表菌株一同根据Clustal W方法进行匹配排列,用MEGA 5.0软件中的 Kimura 2-Parameter Distance模型以neighbourjoining分析法构建得到系统发育树,并进行 1000次Bootstraps检验,最终得到分离菌株的菌属信息。
1.4 产酶试验
将分离纯化自刺参肠道的 224株细菌,分别点种于蛋白酶选择培养基、淀粉酶选择培养基和脂肪酶选择培养基上,28℃培养48 h。判定方法参照赵斌等[8]和冯雪等[9]。
三种培养基的制备:
蛋白酶选择培养基: 酪蛋白 10 g,酵母膏 1 g,琼脂16 g,人工海水1 000 mL;调pH至7.4;121.5 ℃下高温灭菌20 min。
淀粉酶选择培养基: 可溶性淀粉10 g,蛋白胨5 g,酵母膏1 g,琼脂16 g,人工海水1 000 mL;调pH至7.4;121.5 ℃下高温灭菌20 min。
脂肪酶选择培养基: 蛋白胨10 g,吐温–80 10 mL,CaCl2•7H2O 0.1 g,琼脂 9 g,人工海水 1 000 mL;调pH至7.4;121.5 ℃下高温灭菌20 min。
1.5 溶血性试验
将无菌的山羊血平板复温至25 ℃后,挑选已活化的99株细菌接种于山羊血平板培养基上,于25 ℃恒温培养箱中培养,48 h后观察细菌的溶血能力。若菌落周围出现溶血环,表明该细菌具溶血能力,是潜在的病原菌。若菌落周围未出现溶血环,表明该细菌无溶血能力。
2 结果
2.1 刺参肠道细菌数量
从 4个处理组的刺参肠道细菌培养平板中选取菌落分布均匀、生长良好、数目在30~300的平板,进行菌落计数,由公式(各组每克样品细菌数量=(5×10×稀释倍数×单菌落数平均值)/样品重量)计算出各组刺参肠道细菌数量(表1)。由表 1可知,实验各组刺参肠道细菌数量在(2.83~6.39)×107cfu/g,其中养殖和野生刺参肠道内容物中细菌数量均比肠壁中细菌数量高出一倍左右。野生组刺参无论是细菌数量还是检出的细菌种类都较养殖组刺参高。
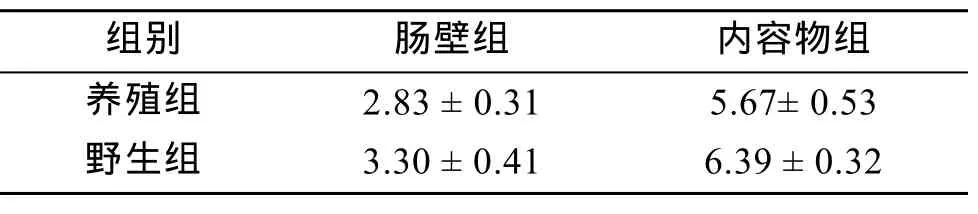
表1 各组肠道细菌含量统计(×107cfu/g )Tab.1 Content analysis of gut bacteria in different groups (×107cfu/g )
2.2 刺参肠道细菌组成
统计养殖刺参之肠壁组、内容物组以及野生刺参之肠壁组、内容物组的肠道菌培养平板上的菌落数量,其均值分别为 103、90、151、107。按 20%比例分别对各组培养平板上的菌落随机取样,进行分子生物学鉴定。依据鉴定结果,统计每组的菌落中各属细菌的菌落数量,得出每组的细菌组成比例,结果见表2。对各属代表菌株构建系统进化树,见图1~图6。由表2可知,弧菌属与假单胞菌属为养殖和野生刺参共同的优势菌。希瓦氏菌是野生刺参的次优势菌,但在养殖刺参的肠壁中没有检测到该菌,只在其肠道内容物中检出。
2.3 产酶试验和溶血性试验
经统计分析可知,224株细菌中,同时具有蛋白酶、淀粉酶、脂肪酶活力的菌株24株;同时产蛋白酶、淀粉酶的菌株45株,同时产淀粉酶、脂肪酶的菌株44株,同时产蛋白酶、脂肪酶的菌株39株;只产蛋白酶的菌株6株,只产脂肪酶的菌株1株,只产淀粉酶的菌株1株。224株细菌中的160株细菌具有产酶能力,所占比例为71.43 %,其中具产蛋白酶、淀粉酶、脂肪酶能力菌株分别为114株、114株、108株,所占比例分别为50.89 %、50.89 %、48.21 %。
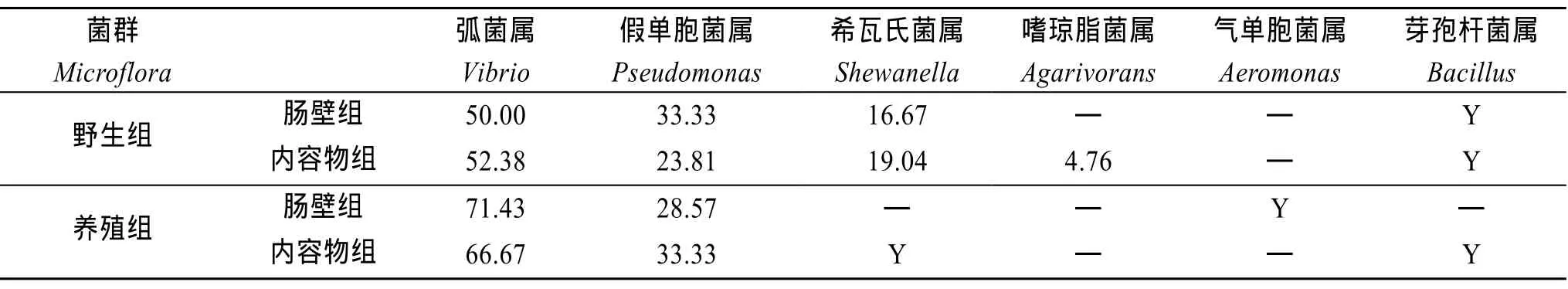
表2 刺参肠道菌群组成比例(%)Tab.2 Proportion of gut bacteria of Apostichopus japonicas (%)
图1 刺参肠道弧菌代表菌株系统进化树Fig.1 Phylogenetic tree of representative strain for Vibrio among gut bacteria of Apostichopus japonicus
图2 刺参肠道假单胞菌代表菌株系统进化树Fig.2 Phylogenetic tree of representative strain for Pseudomonas among gut bacteria of Apostichopus japonicus

图3 刺参肠道希瓦氏菌代表菌株系统进化树Fig.3 Phylogenetic tree of representative strain for Shewanella among gut bacteria of Apostichopus japonicus
图4 刺参肠道嗜琼脂菌代表菌株系统进化树Fig.4 Phylogenetic tree of representative strain for Agarivorans among gut bacteria of Apostichopus japonicus

图5 刺参肠道气单胞菌代表菌株系统进化树Fig.5 Phylogenetic tree of representative strain for Aeromonas among gut bacteria of Apostichopus japonicus

图6 刺参肠道芽孢杆菌代表菌株系统进化树Fig.6 Phylogenetic tree of representative strain for Bacillus among gut bacteria of Apostichopus japonicus
溶血性试验结果显示,挑选出的99株细菌中有23株具有溶血性,所占比例为23.23 %, 99株细菌中的39株具有产蛋白酶能力,在这39株细菌中共8株具有溶血性,所占比例为20.51 %。
2.4 刺参肠道潜在益生菌菌株的确定
综合分析试验数据,确定了 6株细菌作为刺参肠道潜在益生菌,其都来自于野生组刺参之肠壁组,均同时具有蛋白酶、淀粉酶和脂肪酶活力,除HS5(Bacillus)菌株外都为本组优势菌。其菌株信息如表3所示。
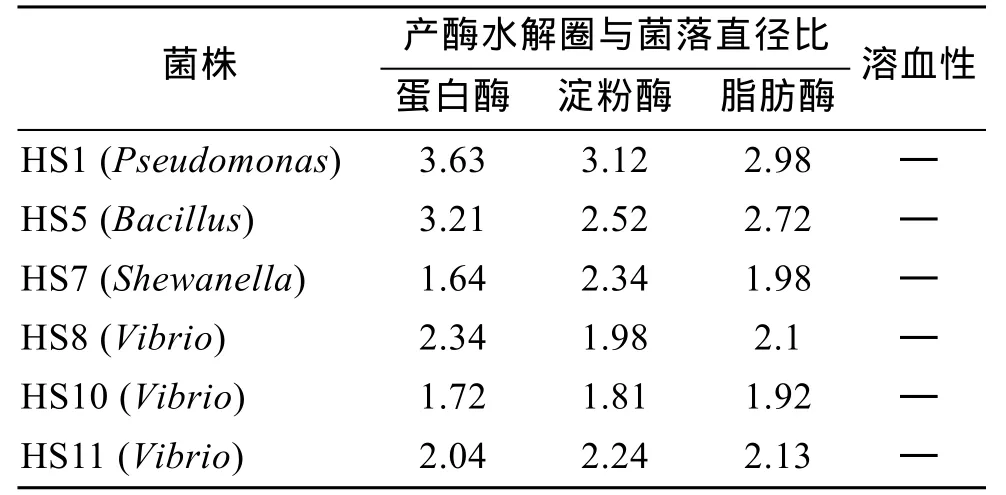
表3 刺参肠道潜在益生菌菌株信息Tab.3 Information of intestinal potential probiotic strains of Apostichopus japonicus
3 讨论
刺参是我国北方海域最重要的养殖品种之一,寻找安全高效的手段解决刺参养殖中面临的病害问题,既是突破刺参养殖行业发展瓶颈的关键,也具有非常重大的经济意义和社会效益,益生菌作为替代抗生素及化学药物防治病害的重要手段,受到了越来越多的重视[3-5]。但目前从刺参肠道及其生活环境中筛选刺参专用高效益生菌的报道极少,而筛选刺参专用益生菌,有必要对刺参肠道微生态作全面的基础研究。
关于益生菌筛选的方法论有许多,从健康动物肠道中筛选可定植的优势菌或次优势菌是筛选益生菌的重要途经[6];在本研究中, 以健康养殖刺参和野生刺参为研究对象,发现试验各组刺参肠道细菌数量在 2.83×107~ 6.39×107cfu/g,试验结果与李彬等[10]、孙奕等[11]的结果相当。无论是在细菌数量还是在细菌种类上,野生组刺参都比养殖组刺参高,这与牛宇峰等[12]研究结果相似,而这一现象可能与刺参的习性有关——刺参在自然水域中以底质表层泥沙中的硅藻、海藻碎片、腐殖质、细菌等为食,相比于人工投饵的养殖环境,其摄取细菌的来源比较广泛。本试验中发现无论养殖刺参还是野生刺参,其肠道内容物和肠壁第一优势菌都为弧菌属,所占比例在50 % 以上,次优势菌为假单胞菌,而孙奕等[11]仅报道野生刺参肠道内容物中优势菌群为弧菌属和假单胞菌属。此次研究发现野生刺参第三优势菌为希瓦氏菌,并非牛宇峰等[12]研究结果中的芽孢杆菌。希瓦氏菌为海水中丰度较高的细菌,在很多水生动物肠道内及藻类表面均有发现[13-15],而有研究表明,水域环境对鱼类肠道微生物菌群结构具有显著的影响[16],所以,水域环境的差异可能是造成刺参肠道菌群组成差异的根本原因。
动物肠道中栖居着大量的微生物。从昆虫到人类的各类动物都缺乏完整的酶系统,均需依靠肠道微生物提供多种酶,才能完成其对食物的消化、营养吸收以及生理代谢等功能,最终达到促生长和增重的作用,因此,从健康动物肠道中筛选具有良好产酶能力的菌株作为益生菌来源的研究也是一个热点[17-19]。例如,冯雪等[9]探讨了草鱼和银鲫肠道菌群的产酶能力,发现草鱼和银鲫肠道内广泛分布着具有产酶能力的细菌,认为这些细菌分泌的胞外酶和宿主分泌的胞外酶一起参与了食物消化与营养吸收过程。因此对刺参肠道菌群产酶能力的研究有助于我们对刺参营养需求以及肠道益生菌筛选的分析。然而迄今为止,尚未见到关于刺参肠道产消化酶菌群的研究报道。由于蛋白质、淀粉与脂肪为饲料三大营养元素,而植物饲料中往往还具有大量的纤维素,所以一些研究学者将蛋白酶、淀粉酶、脂肪酶以及纤维素酶作为分析肠道益生菌的主要依据[19]。于是我们研究分析了刺参肠道菌群关于这四种酶的产酶能力,结果发现刺参肠道中分布着大量产酶菌,并且产蛋白酶、淀粉酶、脂肪酶菌株比例大致相同。由此推测,刺参对于三大营养成分的需求量应该一致,这就为我们设计刺参饲料配方以及选用饲料酶制剂类相关产品提供了重要的参考依据。在本次研究中没有检测到具有产纤维素酶能力的菌株,而冯雪等[9]在草鱼肠道内检出,我们分析,这可能与刺参来源食物中所含纤维素含量较低有关。许多研究表明,不同的物种其肠道内产消化酶细菌的差异,往往与其生理特征及摄食习性有关[17-19]。
研究刺参专用益生菌是为了防治刺参养殖过程中出现的严重病害问题,而刺参肠道菌群溶血性与刺参疾病具有深刻的联系[20-22]。杨嘉龙等[20]从患溃疡病的养殖刺参的病灶处分离了 1株养殖刺参溃疡病病原菌,经鉴定为杀鲑气单胞菌杀日本鲑亚种,并研究其溶血素活性,认为该活性与此菌的致病性有关。研究表明,致病性气单胞菌和弧菌分泌的胞外蛋白酶和溶血毒素是其主要的致病因子,事实上胞外蛋白酶并不直接致病,但它可将溶血毒素原降解成活性毒素,从而致病[21-22]。因此,具有产溶血素性能作为剔除致病菌和保留益生菌的重要筛选方法,能够显著加速益生菌筛选的进程。在本次研究中,我们分析了99株细菌的溶血性,发现病原菌在菌群中所占比例等于具溶血性菌株在菌群中所占比例,如果将同时具有较强产胞外蛋白酶和溶血毒素能力的菌株视作机体病原菌,由此就可推测具溶血性细菌为机体潜在病原菌。将这些菌株视为刺参的潜在致病菌株予以剔除,可以缩小筛选工作量,为下一步进行的潜在益生菌体内筛选工作提供参考。
[1]Chen Jiaxin.Overview of sea cucumber farming and sea ranching practices in China[EB].Beche-de-mer Information Bulletin,2003,(18): 18-23.
[2]Zhang C Y,Wang Y G,Rong X J,et al.Natural resources,cultule and problems of sea cucumber worldwide[J].Marine Fisheries Research,2004,(25): 89-97.
[3]常亚青.海参海胆生物学研究与养殖[M].北京: 海洋出版社,2004.
[4]Nomoto K.Prevention of infections by probiotics [J].Journal of Bioscience and Bioengineering,2005,100:583-592.
[5]Gatesoupe F J.The use of probiotics in aquaculture[J].Aquaculture,1999,180: 147-165.
[6]Gatesoupe F J,Lesel R.An environmental approach to intestinal microflora in fish [J].Cahiera Agricultures,1998,7(1): 29-35.
[7]Sawabe T,Oda Y,Shiomi Y,et al.Alginate degradation by bacteria isolated from the gut of sea urchins and abalones[J].Microbial Ecology,1995,30: 193-202.
[8]赵斌,何绍江.微生物学实验[M].北京: 科学出版社,2002.
[9]冯雪,吴志新,祝东梅,等.草鱼和银鲫肠道产消化酶细菌的研究[J].淡水渔业,2008,(03): 51-57.
[10]李彬,荣小军,廖梅杰,等.刺参肠道与养殖池塘环境中异养细菌和弧菌数量周年变化[J].海洋科学,2012,4: 63-67.
[11]孙奕,陈騳.刺参体内外微生物组成及其生理特性的研究[J].海洋与湖沼,1989,4: 300-307.
[12]牛宇峰,田相利,杜宗军,等.投饵与不投饵池塘刺参肠道异养菌区系比较[J].安徽农业科学,2009,27:13113-13117.
[13]Dang H Y,Lovell C R.Bacterial primary colonization and early succession on surfaces in marine waters as determined by amplified rRNA gene restriction analysis and sequence analysis of 16S rRNA genes [J].Applied and Environmental Microbiology,2000,66: 467-475.
[14]Kim D,Baik K S,Kim M S,et al.Shewanella haliotis sp.nov.,isolated from the gut microflora of abalone,Haliotis discus hannai[J].International Journal of Systematic and Evolutionary Microbiology,2007,57:2926-2931.
[15]Chan P S,Baik K S,Kim M S,et al.Shewanella marina sp.nov.,isolated from seawater[J].International Journal of Systematic and Evolutionary Microbiology ,2009,59: 1888-1894.
[16]Spanggaard B,Huber I,Nielsen J,et al.The microflora of rainbow trout intestine: a comparis on of traditional and molecular identification[J].Aquaculture,2000,182:1-15.
[17]康白.微生态学原理[M].大连: 大连出版社,1996.
[18]尾崎久雄 著,李爱杰,沈宗武 译.鱼类消化生理[M].上海: 上海科学技术出版社,1985.
[19]周志刚,石鹏君,姚斌,等.海水鱼消化道菌群结构研究进展[J].海洋水产研究,2007,5: 123-131.
[20]杨嘉龙,周丽,邢婧,等.养殖刺参溃疡病杀鲑气单胞菌的分离、致病性及胞外产物特性分析[J].中国水产科学,2007,6: 981-989.
[21]Ascencio F,Wadström T.Effect of Aeromonas proteases on the binding of Aeromonas hydrophila strains to connective tissue proteins[J].Microbies,1999,66: 27-37.
[22]Howard S P,Buckley J T.Activation of the hole-forming toxin aerolysin by extracellular processing[J].Bacteriol 1985,163,1: 336-340.
