预处理苎麻秆和红麻秆糖化发酵生产燃料乙醇
2014-06-24郭芬芬孙婉李雪芝赵建曲音波
郭芬芬,孙婉,李雪芝,赵建,曲音波
山东大学微生物技术国家重点实验室,山东 济南 250100
预处理苎麻秆和红麻秆糖化发酵生产燃料乙醇
郭芬芬,孙婉,李雪芝,赵建,曲音波
山东大学微生物技术国家重点实验室,山东 济南 250100
苎麻和红麻是我国传统纤维作物,皮部纤维在造纸、纺织等工业具有广泛用途,但剥皮后剩余的茎秆部分并没有被有效利用。由于其中含有较多纤维素,可望被生物转化生产燃料乙醇。比较了几种不同化学预处理方法对苎麻秆和红麻秆纤维素酶解性能的改善效果,进而选择碱法预处理后原料,进行半同步糖化发酵产乙醇实验。结果表明,苎麻秆和红麻秆经4% NaOH和0.02%蒽醌-2-磺酸钠盐 (AQSS),在170 ℃下处理1 h,继而在固形物底物浓度18%时发酵168 h,发酵液中乙醇浓度达到51 g/L。采用少量多次补料至20%的底物浓度,乙醇浓度都能达到63 g/L,纤维素转化率分别为77%和79%。红麻秆经5.2% NaHSO3和0.2% H2SO4,在170 ℃下处理1 h,补料至20%的底物浓度时,乙醇浓度可达到65 g/L,纤维素转化率为72%。
苎麻秆,红麻秆,预处理,酶解,半同步糖化发酵,乙醇
随着世界经济的快速发展和人口的增加,石油、煤炭等多种不可再生资源已经濒临枯竭,同时,大量排放的二氧化碳也导致严重的温室效应[1-6]。因此,出于经济发展、国家安全以及环境保护等各方面的需要,对可持续和清洁能源的要求更为迫切。生物乙醇这一新型能源在这一背景下应运而生。第一代生物乙醇是以谷物淀粉或者是蔗糖为原料来生产乙醇,但存在“与粮争地,与人争粮”等问题。第二代生物乙醇是以木质纤维素为原料生产乙醇,不仅解决了“与粮争地,与人争粮”的问题,还可以增加农业废弃物利用率,具有很多优点。苎麻Boehmeria nivea L.是我国传统纤维作物,有“中国草”之称。我国苎麻常年种植面积20万hm2左右[7]。红麻Hibiscus cannabinus L.是属于锦葵科木槿属的一种速生高产生物质植物,已成为我国栽培面积最大、总产量最高的麻类纤维作物之一,其纤维单产居世界首位[8],而占生物学产量60%左右的麻茎秆除少部分用于压制纤维板或制浆造纸外,大部分被当作柴烧或废弃,生物利用率很低,造成资源的极大浪费。由于麻秆中富含纤维素,因此可望用于转化生产燃料乙醇。但目前尚未有利用苎麻秆生产生物乙醇的报道。
利用木质纤维素生产乙醇主要包括原料的预处理、酶解、发酵和蒸馏4个步骤,利用纤维素酶将纤维素降解成可发酵糖是重要一步,但由于天然木质纤维素结构致密,直接进行酶解,纤维素的转化率很低,普遍认为对木质纤维素原料进行预处理是提高酶解的必要手段[1-4]。目前,预处理方法主要有物理法、化学法、物理化学法和生物法等。其中,稀H2SO4、烧碱法、亚硫酸盐法等化学法预处理是较为常用的方法。碱法预处理可以去除原料中的木质素组分,在破坏原料结构的同时,也部分消除木素对酶解的不利影响,并对纤维素有化学膨胀作用[9]。亚硫酸盐法预处理已被证明对多种原料均有效[10-14],根据预处理液pH值的不同,分为碱性亚硫酸盐法、中性亚硫酸法和酸性亚硫酸盐法等3种。碱性亚硫酸盐法可以部分地脱除木素,而酸性亚硫酸盐法则可以溶出原料的半纤维素和部分木素。阮奇城等[8]采用H2O、H2SO4、NaOH溶液 (121 ℃,60 min) 或白腐真菌P. sajor-caju固态培养的方法,对红麻秸秆进行预处理,对比酶解后物料的纤维素转化率,发现用NaOH预处理后样品的纤维酶解效率最高。在25 ℃下,对粒径为1 mm的红麻粉末在不同的离子液中进行超声处理120 min,纤维素转化率可达60%–95%[15]。对2 mm粒径的红麻粉用每克50 mL的1% H2O2在pH 11.5下处理24 h,在10%的底物浓度下,发酵144 h后,乙醇转化率为76%[16]。在50 ℃下,微波辅助的碱处理能有效地使红麻中的结晶纤维素转化为无定形纤维素,可在酶解中得到显著高的糖得率[17]。但总体而言,对麻秆这类纤维素原料进行预处理和糖化发酵生产乙醇的研究还比较少,对其生产可行性还需要作进一步评价,特别是利用亚硫酸盐法对麻秆类原料进行预处理的研究还未见报道。
本文以苎麻秆和红麻秆为原料,比较了几种不同的预处理方法对酶解的影响,进而对预处理后原料进行了不同底物浓度下的半同步糖化发酵生产乙醇实验。对苎麻、红麻等原料茎秆预处理和酶解糖化发酵性能进行了初步评价,希望为这类原料应用于燃料乙醇生产工业提供参考。
1 材料与方法
1.1 材料
苎麻秆购自湖南省,红麻秆采自新疆。在实验室将秆破碎至长度约为1–5 cm,混匀,置于塑料袋中,密封备用。经分析,苎麻秆的主要化学组成为:纤维素44.0%,木聚糖11.9%,木素18.1%;红麻秆主要化学成分为:纤维素38.2%,木聚糖17.4%,木素21.0%。
实验用纤维素酶为商品酶,其滤纸酶活为160 IU/g,β-葡萄糖苷酶活为75 IU/g。乙醇发酵中使用的是安琪高活性干酵母 (Saccharomyces cerevisiae; Angel, China)。
1.2 方法
1.2.1 预处理
预处理在ZQS-3型电加热式旋转蒸煮锅(陕西科技大学轻工机械厂) 中进行。称取一定绝干量的原料,放入1.5 L的钢罐中,将配制好的一定浓度的溶液,按固液比1∶5 (W/V) 放入钢罐中,密封好后放入蒸煮锅中,设定好温度,到达目的温度后保温1 h,处理完毕后冷却放料。固体残渣经过过滤后,用自来水冲洗至中性,放入密封袋中置于4 ℃冰箱中备用。收集部分预处理液做成分分析,固体部分用来做成分分析、纤维素酶酶解和乙醇发酵。对照样品为没有经过预处理的原料。
1.2.2 纤维素酶水解
酶解实验在100 mL三角瓶,恒温摇床中进行,使用50 mmol/L的HAc-NaAc缓冲液 (pH 4.8) 调节pH值。
酶解条件:底物浓度2%,酶加量25 FPU/g底物,0.1% 叠氮化钠,45 ℃,150 r/min,72 h。定时取样,离心后取上清液,使用SBA-40C生物传感分析仪检测葡萄糖的含量,并依据式 (1)计算纤维素的转化率。

1.2.3 半同步糖化发酵
半同步糖化发酵产乙醇实验在50 mL三角瓶,恒温摇床中进行,使用pH 4.8的柠檬酸-柠檬酸钠缓冲液调节pH值,用橡胶塞保持密闭和厌氧状态。
糖化发酵条件:25 FPU/g底物,预糖化8 h后接入酵母,5 mg酵母/g底物 (加入前,酵母首先经过活化处理,0.15 g酵母,加0.25 g葡萄糖,10 mL无菌水,30 ℃,活化2 h),35 ℃发酵。定时取样,离心后取上清液测定乙醇、葡萄糖的含量和溶液的pH值。葡萄糖和乙醇的含量使用SBA-40C生物传感分析仪检测,并依据式 (2) 计算纤维素转化率。分批补料发酵工艺[6]:初始底物浓度为10%,加20%底物浓度时的酵母用量,在24、48、72、96、120 h分别加入一定量的料和相应的纤维素酶酶粉。

1.3 分析和测定方法
物料中的含水量和乙醇抽出物参照NREL (National Renewable Energy Laboratory)[18]的分析流程。酸溶木素和酸不溶木素等含量测定按照国家标准GB/T2677.8-1994和GB/T747-1989规定方法[19]进行,并按照式 (3) 计算木素脱出率。葡萄糖和木糖的检测采用HPLC法,色谱柱为HPX-87P (Bio-Rad,Hercules,CA,USA),示差折光检测器,柱温78 ℃,流动相为三蒸水,流速为0.5 mL/min。

2 结果与分析
2.1 不同预处理方法对苎麻秆化学组成和酶解性能的影响
2.1.1 NaOH预处理

图1 不同NaOH预处理对酶解段苎麻秆纤维素转化率的影响Fig. 1 Effect of NaOH on the enzymatic digestibility of pretreated ramie stalk.

表1 不同NaOH预处理对苎麻秆化学组成和纤维素转化率的影响Table 1 Effects of NaOH pretreatment on the chemical components and cellulose conversion of ramie stalk
影响预处理的主要因素有:预处理温度、预处理时间、溶剂的浓度和固液比等。在固液比1∶5,预处理时间1 h的条件下,主要研究了温度、NaOH浓度及助剂添加等因素对苎麻茎秆化学组成和酶解性能的影响 (表1和图1)。由化学组成可以看出,NaOH预处理后,与未处理样品相比,苎麻秆的纤维素含量增加。提高预处理温度和NaOH浓度有利于增加物料中纤维素含量,纤维素转化率显著提高,但固形物得率下降。实验结果还发现,在170 ℃,3.6% NaOH下,添加蒽醌-2-磺酸钠盐 (AQSS) 可以明显增加木素脱除率和物料中纤维素含量,证实AQSS具有促进脱木素[20]和保护纤维素的作用。此外,添加AQSS的预处理物料纤维素转化率也明显提高。在AQSS为0.02% 时,将NaOH浓度从3.6%提高到4%,可以明显提高预处理后物料中纤维素含量 (从64.9%增加到72.4%)、木素脱除率 (从56.4% 提高到80.6%),改善纤维素的转化效率 (从87.6% 增加到91.9%)。脱除的木素可以回收用来做肥料或土壤改良剂等[21]。虽然有文献报道认为H2O2等氧化剂在脱木素过程中也会起到重要作用[16,22-24],但从本文的实验结果来看,与不添加H2O2相比,添加H2O2后,苎麻木素含量未见明显减少,纤维素转化率也未增加,可能是在实验条件下添加H2O2的预处理方法不适用于苎麻秆。
众所周知,木素的存在不利于纤维素的酶解,它既可以作为物理屏障限制纤维素酶接近纤维素,又可以非反应性地结合纤维素酶[5,8]。在本文中,添加AQSS助剂的NaOH预处理可以使苎麻秆中大部分木素和部分半纤维素被脱除,切断了木素和碳水化合物的联结键并且破坏了原料的致密结构。木素和半纤维素溶出致使原料内部孔隙率增加,增加了原料的内表面积;木素的溶出也使得对纤维素酶的负面影响减少,这些结构变化使得苎麻碳水化合物更容易与纤维素酶发生作用,因而提高了水解效率。
2.1.2 亚硫酸盐法预处理
对不同pH和不同盐基的亚硫酸盐法预处理苎麻秆效果进行了比较研究。不同pH水平下,在亚硫酸盐预处理液中,反应性的离子有所不同,酸性pH值下主要是HSO3-或SO2和HSO3-;中性pH值下,主要是SO32-和HSO3-;而碱性pH值下,则主要是SO32-。由表2可以看出,在用NaOH调节至中性pH (pH 6.75) 条件下,NaHSO3预处理后的物料中葡聚糖、木素和木聚糖的损失几乎一致,说明这种方式下的中性NaHSO3处理对苎麻这3种组分没有较强的选择性;同样在中性pH条件下,采用(NH4)2SO3和尿素组合的预处理方式,木素仅脱除了10%,酶解段纤维素转化率也明显较低(图2)。由于尿素可以与木素反应形成亲水性的木素羧酸盐,且形成的亚氨基与木素反应可使得木素易于断裂和润涨,因而有望增加木素的脱除,与此同时采用亚铵法处理,废液可以直接加工生产缓释放有机氮肥,但是本文初步结果表明,在选择的实验条件下,采用(NH4)2SO3预处理苎麻秆原料的效果不太明显。但在酸性(pH 2.28) 条件下亚硫酸盐法预处理后,苎麻中的木聚糖脱除率达60%,这是由半纤维素在酸性条件下易发生水解反应导致的,木素脱除率增高的主要原因是因为木素和亚硫酸氢根离子发生磺化反应生成亲水性的木素磺酸盐,导致木素的溶出。在碱性条件下,采用Na2SO3预处理,与中性亚硫酸盐法相比,木素脱除率有所增加,且随着预处理液碱性的增强 (加入少量NaOH),木素脱除率进一步加大,且添加少量NaOH后,葡聚糖的损失减少,纤维素转化率也有所提高。
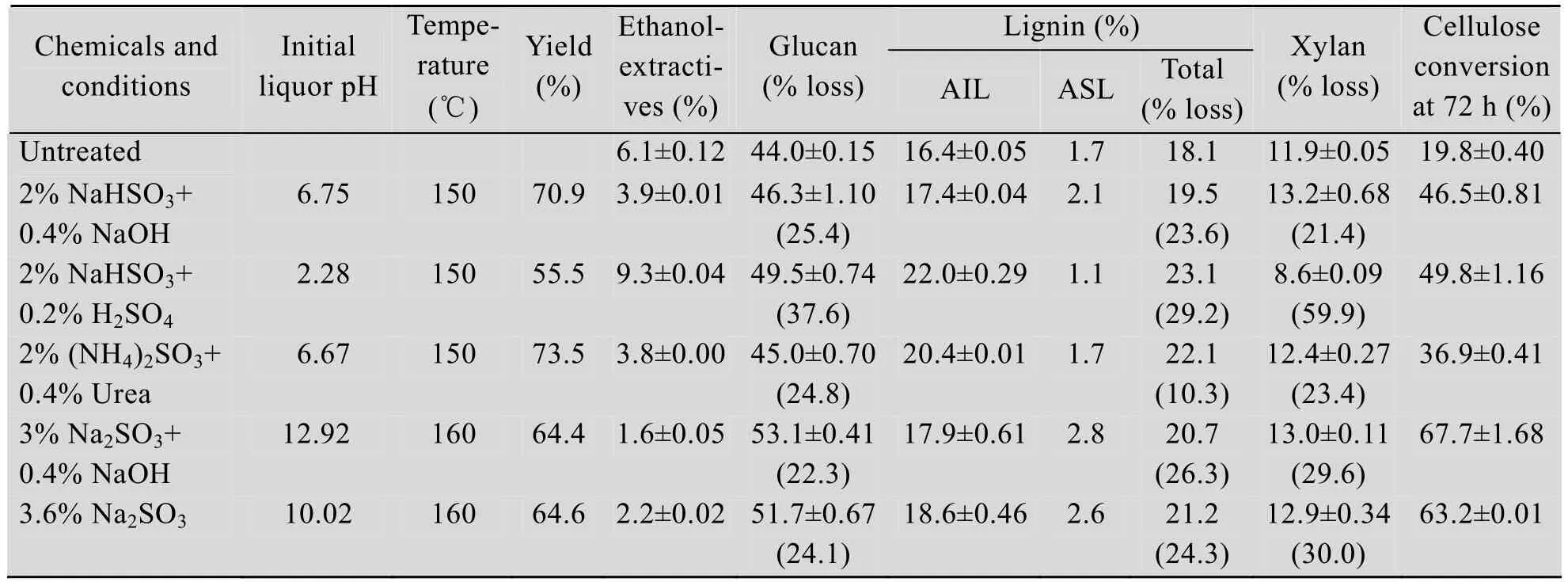
表2 不同亚硫酸盐预处理对苎麻秆化学组成和纤维素转化率的影响Table 2 Effects of sulfite pretreatment on the chemical components and cellulose coversion of ramie stalk

图2 不同亚硫酸盐预处理对酶解段苎麻秆纤维素转化率的影响Fig. 2 Effect of sulfite on the enzymatic digestibility of pretreated ramie stalk.
相比较而言,在本文选择的实验条件下,采用亚硫酸盐法预处理后,苎麻秆原料酶解段纤维素转化率明显低于相同药品用量和相同处理条件下采用NaOH预处理的纤维素转化率。因此,后续酶解糖化发酵产乙醇研究中,选用了NaOH预处理后的苎麻秆作为原料。
2.2 预处理后苎麻秆的半同步糖化发酵
利用微生物发酵木质纤维素原料生产酒精的工艺大致可以分为纤维素直接发酵、间接发酵和同步糖化发酵三类[25]。同步糖化发酵的优点是酶解的产物葡萄糖可以马上被酵母发酵生成乙醇,解除了葡萄糖对纤维素酶的反馈抑制,从而有利于纤维素酶水解反应顺利地进行,有效地提高了糖化和发酵的效率,但不足之处是糖化和发酵最适温度的不同。半同步糖化发酵包括了预糖化和同步糖化发酵两个阶段,结合了间接发酵和同步糖化发酵的优点,并可以在一定的程度上弥补最适温度不同造成的反应不充分。预糖化使底物粘稠度降低,也使酵母在加入后有一个二次生长的机会。有研究表明,在半同步糖化发酵工艺下的乙醇生产量和转化率明显高于同步糖化发酵[26]。此外,一般来说,乙醇蒸馏时要求醪液中乙醇浓度不低于50 g/L[8],否则乙醇蒸馏时能量消耗过大。苎麻秆预处理后固形物的半同步糖化发酵结果见表3。由表3可知,经过3.6% NaOH+0.02% AQSS在160 ℃下处理1 h后,预处理料发酵乙醇未取得理想的乙醇浓度。但在170 ℃下,采用4% NaOH+0.02% AQSS预处理苎麻秆,当发酵时底物浓度在14%以上时,半同步糖化发酵乙醇浓度都能达到45 g/L以上,纤维素的转化率都在69%以上。在发酵液中,要得到高的乙醇浓度就预示着必须提高底物浓度,但提高底物浓度会增加发酵体系的粘稠度,不利于酶解和乙醇发酵的进行,纤维素转化率会由于传质速率下降而大幅降低[6]。实验发现,当底物浓度从14%增加到18%时,乙醇浓度虽然从45 g/L增加到51 g/L,但纤维素的转化率从78%下降到69%。为了解决这一矛盾,所以考虑将分批补料[6]与半同步糖化发酵结合起来,实现酒精浓度和转化率的增长。实验发现,在10%的初始底物浓度下,经过少量多次补料至20%的底物浓度时,发酵168 h,乙醇浓度可达63 g/L,纤维素转化率为77%。

表3 预处理苎麻秆半同步糖化发酵结果Table 3 The maximum ethanol yield and cellulose conversion during Q-SSF of pretreated ramie stalk

表4 不同预处理对红麻秆化学组成和纤维素转化率的影响Table 4 Effects of different pretreatment on the chemical components and cellulose conversion of kenaf stalk
2.3 红麻秆的预处理与半同步糖化发酵
红麻的生物产量是树木的3−4倍[27],也有望作为燃料乙醇的原料来源。对NaOH和亚硫酸盐预处理的红麻秆糖化发酵产乙醇性能进行了初步研究。由表4可以看出,酸性NaHSO3和碱性Na2SO3预处理能导致较多的木素和木聚糖组分被脱除。在实验条件下,酸性NaHSO3处理对物料中木素和木聚糖的脱除效果要优于碱性Na2SO3处理,但物料得率降低。而NaOH预处理则能导致更多的木素被脱除。例如,在AQSS添加量为0.02% 时,采用3.6% NaOH和4% NaOH对红麻原料预处理后,木素脱除率分别达到95% 和97%。NaOH和亚硫酸盐预处理后的红麻秆,酶解72 h时的纤维素转化率都达到80%以上 (图3)。
在14%的底物浓度下,对NaOH和亚硫酸盐预处理后物料进行半同步糖化发酵,表5显示5.2% NaHSO3+0.2% H2SO4条件下的预处理,发酵液乙醇浓度可以达到51 g/L,纤维素转化率为83%。4% NaOH处理条件后物料的糖化发酵效果优于3.6% NaOH处理后的物料。利用4% NaOH+0.02% AQSS预处理后物料,经过少量多次补料至底物浓度到20%,发酵液乙醇浓度能达63 g/L,纤维素转化率为79%。虽然酸性NaHSO3预处理后,采用多次补料,发酵液乙醇浓度也可达到60 g/L及以上,但乙醇得率和纤维素转化率却低于相同底物浓度下NaOH预处理物料的发酵结果。本组的实验结果也说明了NaOH预处理方法同样适用于红麻秆原料。

图3 不同的预处理条件对红麻秆纤维素酶解转化率的影响Fig. 3 Effect of different conditions of pretreatment on the enzymatic digestibility of pretreated kenaf stalk.

表5 预处理红麻秆的半同步糖化发酵结果Table 5 The maximum ethanol yield and cellulose conversion during Q-SSF of pretreated kenaf stalk
3 结论
苎麻秆和红麻秆可用来作为燃料乙醇生产的原料。采用碱性预处理苎麻秆和红麻秆,经过分批补料半同步糖化发酵工艺,在补料至底物浓度为20%时,乙醇浓度达到63 g/L,转化率分别为77%和79%。酸性NaHSO3预处理的红麻秆,在补料至20%的底物浓度时,乙醇浓度可达65 g/L,纤维素转化率为72%。经过进一步优化工艺,可望进一步提高乙醇产量。
REFERENCES
[1] Alvira P, Tomas-Pejo E, Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review. Bioresour Technol, 2010, 101(13): 4851–4861.
[2] Kumar P, Barrett DM, Delwiche MJ, et al. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production. Ind Eng Chem Res, 2009, 48(8): 3713–3729.
[3] Zheng Y, Pan ZL, Zhang RH. Overview of biomass pretreatment for cellulosic ethanol production. Int J Agric Biol Eng, 2009, 2(3): 51–68.
[4] Fang X, Shen Y, Zhao J, et al. Status and prospect of lignocellulosic bioethanol production in China. Bioresour Technol, 2010, 101(13): 4814–4819.
[5] Yao L, Yue J, Zhao J, et al. Application of acidic wastewater from monosodium glutamate process in pretreatment and cellulase production for bioconversion of corn stover-feasibility evaluation. Bioresour Technol, 2010, 101(22): 8755–8761.
[6] Liu K, Lin XH, Yue J, et al. High concentration ethanol production from corncob residues by fed-batch strategy. Bioresour Technol, 2010, 101(13): 4952–4958.
[7] Guo FF, Zou MY, Li XZ, et al. An effective degumming enzyme from Bacillus sp. Y1 and synergistic action of hydrogen peroxide and protease on enzymatic degumming of ramie fibers. Biomed Res Int, 2013, 2013: 212315.
[8] Ruan QC, Qi JM, Hu KH, et al. Bioconversion of fuel ethanol from kenaf stalk. J Fujian Agric Forest Univ, 2012, 41(1): 78–82 (in Chinese).阮奇城, 祁建民, 胡开辉, 等. 红麻秸秆发酵转化燃料乙醇. 福建农林大学学报, 2012, 41(1): 78–82.
[9] Zhao XB, Peng F, Cheng KK, et al. Enhancement of the enzymatic digestibility of sugarcane bagasse by alkali-peracetic acid pretreatment. Enzyme Microb Tech, 2009, 44(1): 17–23.
[10] Zhu JY, Pan XJ, Wang GS, et al. Sulf i te pretreatment (SPORL) for robust enzymatic saccharif i cation of spruce and red pine. Bioresour Technol, 2009, 100(8): 2411–2418.
[11] Zhu JY, Gleisner R, Scott CT, et al. High titer ethanol production from simultaneous enzymatic saccharif i cation and fermentation of aspen at high solids: a comparison between SPORL and dilute acid pretreatments. Bioresour Technol, 2011, 102(19): 8921–8929.
[12] Wang ZJ, Zhu JY, Zalesny Jr RS, et al. Ethanol production from poplar wood through enzymatic saccharif i cation and fermentation by dilute acid and SPORL pretreatments. Fuel, 2012, 95: 606–614.
[13] Tian S, Zhu W, Gleisner R, et al. Comparisons of SPORL and dilute acid pretreatments for sugar and ethanol productions from aspen. Biotechnol Prog, 2011, 27(2): 419–427.
[14] Zhang DS, Yang Q, Zhu JY, et al. Sulfite (SPORL) pretreatment of switchgrass for enzymatic saccharification. Bioresour Technol, 2013, 129: 127–134.
[15] Ninomiya K, Kamide K, Takahashi K, et al. Enhanced enzymatic saccharification of kenaf powder after ultrasonic pretreatment in ionic liquids at room temperature. Bioresour Technol, 2012, 103(1): 259–265.
[16] Gould JM, Freer SN. High-efficiency ethanol production from lignocellulosic residues pretreatedwith alkaline H2O2. Biotechnol Bioeng, 1984, 26(6): 628–631.
[17] Ooi BG, Rambo AL, Hurtado MA. Overcoming the recalcitrance for the conversion of kenaf pulp to glucose via microwave-assisted pre-treatment processes. Int J Mol Sci, 2011, 12: 1451–1463.
[18] Ehrman T. Standard method for the determination of extractives in biomass, chemical analysis and testing task laboratory analytical procedures. NREL Ethanol Project, 1994.
[19] Shi SL, He FW. Analysis and Measurement of Pulp and Paper. Beijing: Chin Light Ind Press, 2008 (in Chinese).石淑兰, 何福望. 制浆造纸分析与检测. 北京:中国轻工业出版社, 2008.
[20] Cao SL, Zhan HY, Fu SY, et al. Study on application of anthraquinone sodium sul fonate to oxygen delignification of bamboo pulp. China Pulp Pap, 2006, 25(8): 5–8 (in Chinese).曹石林, 詹怀宇, 付时雨, 等. 蒽醌磺酸钠用于竹浆氧脱木素的研究. 中国造纸, 2006, 25(8): 5–8.
[21] Le XY, Lu QM, He TY, et al. Application of lignin from black liquor of paper making in fertilizer. Stud Renew Resour, 2000, (3): 38–41 (in Chinese).乐学义, 卢其明, 何庭玉, 等. 造纸黑液木素在肥料中的应用. 再生资源研究, 2000, (3): 38–41.
[22] Cara C, Ruiz E, Ballesteros I, et al. Enhanced enzymatic hydrolysis of olive tree wood by steam explosion and alkaline peroxide delignification. Process Biochem, 2006, 41(2): 423–429.
[23] Selig MJ, Vinzant TB, Himmel ME, et al. The effect of lignin removal by alkaline peroxide pretreatment on the susceptibility of corn stover to purified cellulolytic and xylanolytic enzymes. Appl Biochem Biotechnol, 2009, 155: 397–406.
[24] Yamashita Y, Shono M, Sasaki C, et al. Alkaline peroxide pretreatment for efficient enzymatic saccharification of bamboo. Carbohyd Polym, 2010, 79(4): 914–920.
[25] Yao L. The research on pretreatment of corn stover with acidic wasterwater and cellulase adsorption to lignin [D]. Jinan: Shandong University, 2011 (in Chinese).姚兰. 玉米秸秆的酸性废水预处理及木质素对纤维素酶吸附的研究[D]. 济南: 山东大学, 2011.
[26] Wang JL. Study on the process of arundo donax for the production of cellulase and ethanol [D]. Jinan: Shandong University, 2011 (in Chinese).王俊丽. 芦竹原料生产纤维素酶与发酵产乙醇的工艺研究[D]. 济南: 山东大学, 2011.
[27] Ruan QC, Qi JM, Hu KH, et al. Efficient pretreatment of kenaf stalk for fuel ethanol. Chin Agric Sci Bull, 2011, 27(15): 112–116 (in Chinese).阮奇城, 祁建民, 胡开辉, 等. 红麻秸秆高效预处理方法的选择. 中国农学通报, 2011, 27(15): 112–116.
(本文责编 陈宏宇)
Pretreatment of ramie and kenaf stalk for bioethanol production
Fenfen Guo, Wan Sun, Xuezhi Li, Jian Zhao, and Yinbo Qu
State Key Laboratory of Microbial Technology, Shandong University, Jinan 250100, Shandong, China
Ramie and kenaf were traditional fiber crops in China, but their stalk after decorticating has not been used effectively. The stalk contains a lot of cellulose, and can therefore be used for the production of bioethanol. We studied the effects of different chemical pretreatment on enzymatic digestibility of ramie stalk and kenaf stalk. Ramie and kenaf stalks pretreated with alkali were chosen to produce ethanol using quasi-simultaneous saccharification and fermentation (Q-SSF) process. Theresults show that for the stalks pretreated with 4% NaOH and 0.02% anthraquinone-2-sulfonic acid sodium salt (AQSS) as catalyzer at 170 ℃ for 1 h, the ethanol concentration could reach 51 g/L after fermentation for 168 h at 18% of solid substrate concentration. By fed-batch to 20% of solid substrate concentration, the ethanol concentration could reach 63 g/L, 77% and 79% of the cellulose conversion could get for ramie stalk and kenaf stalk, respectively. For kenaf stalk pretreated with 5.2% NaHSO3and 0.2% H2SO4at 170 ℃ for 1 h, the ethanol concentration and cellulose conversion could reach to 65 g/L and 72%, respectively.
ramie stalk, kenaf stalk, pretreatment, enzymatic hydrolysis, quasi-simultaneous saccharification and fermentation, ethanol
Junuary 16, 2014; Accepted: March 14, 2014
Jian Zhao. Tel: +86-531-88364690; Fax: +86-531-88565610; E-mail: zhaojian@sdu.edu.cn
郭芬芬, 孙婉, 李雪芝, 等. 预处理苎麻秆和红麻秆糖化发酵生产燃料乙醇. 生物工程学报, 2014, 30(5): 774−783
Guo FF, Sun W, Li XZ, et al. Pretreatment of ramie and kenaf stalk for bioethanol production. Chin J Biotech, 2014, 30(5): 774−783.
Supported by: National Basic Research Program of China (973 Program) (No. 2011CB707401), National Natural Science Foundation of China (Nos. 21276143, 21376141).
国家重点基础研究发展计划 (973计划) (No. 2011CB707401),国家自然科学基金 (Nos. 21276143, 21376141) 资助。
时间:2014-04-09 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140037.html
