过程工程在木质纤维素发酵抑制物解除中的应用
2014-06-24王岚夏梦雷陈洪章
王岚,夏梦雷,陈洪章
中国科学院过程工程研究所 生物质炼制工程北京市重点实验室,北京 100190
炼制技术
过程工程在木质纤维素发酵抑制物解除中的应用
王岚,夏梦雷,陈洪章
中国科学院过程工程研究所 生物质炼制工程北京市重点实验室,北京 100190
发酵抑制物对宿主细胞产生毒害作用,是木质纤维素生物炼制的主要瓶颈之一。减少抑制物含量、解除抑制作用是提高发酵效率的重要环节。本文讨论了木质纤维素发酵抑制物的来源、组成、特点以及相应的解除方法,提出了“源头降低抑制物—纤维素木质素分级转化”炼制模式和“发酵促进剂设计技术”,为木质纤维素发酵抑制物的解除及木质纤维素开发利用提供了全新的技术路线。
木质纤维素,发酵抑制物,源头解除抑制物,分级转化,发酵促进剂
木质纤维素是地球上最为丰富的可再生资源。全球每年由光合作用而产生的木质纤维素总量约为1 000亿t,内含的能量相当于600亿至800亿t石油,即全世界每年石油总产量的20−27倍。但目前木质纤维素的利用率不到3%。我国木质纤维素的年产量就超过10亿t[1],但仅有少部分被用于饲料、造纸等行业,并且普遍存在着原料利用率低、环境污染严重等问题。此外,每年约2亿t木质纤维素被就地焚烧,造成了巨大的资源浪费和严重的环境污染[2]。
随着石油危机和环境问题的日益突出,开发秸秆等木质纤维素原料生产能源化工产品对于促进我国可持续发展、减少温室效应具有非常重大的意义。由于木质纤维素结构的复杂性,预处理过程中会产生大量的抑制物,严重制约着木质纤维素的生物质转化。因此,实现秸秆基产品的工业化生产,必须首先建立适当的原料预处理、发酵液脱毒等技术体系。基于此,本文对发酵液脱毒技术进行了综述,并重点介绍了本实验室所提出的“源头降低抑制物—纤维素木质素分级转化”炼制模式和“发酵促进剂设计技术”,期待对新型脱毒工艺的开发与应用有一定的启发,助力于木质纤维素生物质转化产业的发展。
1 木质纤维素发酵抑制物的来源和抑菌机制
秸秆等木质纤维素原料的主要组分是纤维素、半纤维素和木质素[3]。在采用稀酸、湿式氧化和蒸汽爆破等方法对纤维原料进行预处理的过程中,上述物质会发生一系列复杂的理化反应,产生大量结构复杂的抑制物[4],如图1所示。
纤维素在酸水解过程中产生葡萄糖,并且在高温酸性条件下,葡萄糖可以继续降解生成5-羟甲基糠醛 (5-hydroxymethylfurfural,HMF)、甲酸和乙酰丙酸等物质。半纤维素在汽爆或酸性预处理条件下发生水解反应,产生木糖、阿拉伯糖、半乳糖等多种单糖组分,这些单糖组分在高温酸性条件下会进一步降解生成糠醛、HMF和甲酸等产物。此外,半纤维素上的乙酰基团会被水解,产生乙酸。木质素在预处理过程中也会发生少量降解,其降解的主要产物是多种单环芳香族类化合物。
Palmqvist等[6]将抑制物分为三大类:弱酸类、呋喃衍生物和酚类化合物。目前,有关这些物质的抑菌机制主要是以酿酒酵母为模式微生物进行研究而得到的。甲酸、乙酸和乙酰丙酸等弱酸性物质的抑制作用主要是通过破坏存在于细胞膜上H+浓度梯度实现的[7]。呋喃类衍生物主要是糠醛和5-羟甲基糠醛。醛类物质对酵母的抑制作用表现在降低酒精体积产率和生产率、抑制酵母生长。酚类化合物来源于木质素的降解,其中阿魏酸、3-甲基-4-羟基苯甲酸、4-羟苯乙酮、香草酸等是典型的酚类化合物,并且小分子量的酚类化合物的抑菌作用最强[6],其毒性大于糠醛[8]。另外,苯酚单体上基团的取代位置也影响化合物的毒性,甲氧基团的数目也与菌种生长的抑制作用有关。酚类物质的抑制作用一般认为是其渗透到细胞膜内,破坏细胞膜结构的完整性,从而影响发酵微生物的正常生长,降低发酵效率。
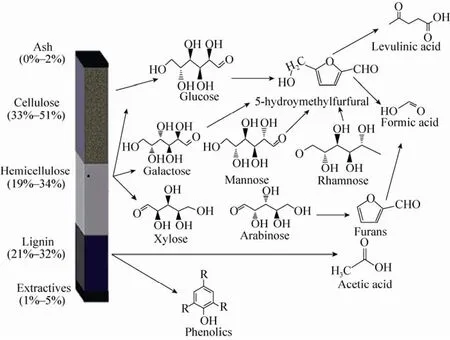
图1 木质纤维素主要组分及其降解物[5]Fig. 1 Main components of lignocellulose and the corresponding degradation products[5].
2 发酵抑制物解除策
抑制物解除的基本策略按照处理对象的不同,可以分为3种:木质纤维素物料脱毒、抑制物耐受菌筛选和过程控制优化。
2.1 木质纤维素物料脱毒
木质纤维素物料脱毒是指针对酸解、碱解、汽爆等预处理后的物料,通过一定手段,去除抑制物的过程。目前木质纤维素物料脱毒策略大体上可以分为物理法、化学法和生物法预处理3大类。物理法是直接去除水解液中的有毒物质,而化学法和生物法在于将有毒物质转化为无毒物质。
目前,文献已报道的物理法包括水洗法、蒸发法、吸附法、萃取法、离子交换法、电渗析法等。水洗法常用于去除汽爆预处理产生的可溶性发酵抑制物[9]。蒸发法是一种简单地去除预处理水解液中乙酸和糠醛等挥发性抑制物的方法[10]。萃取法则是利用糖类与抑制物在萃取剂中溶解性的不同,用溶剂将抑制物从发酵溶液中分离出来,如采用乙酸乙酯萃取可以去除木质纤维素水解液中56%的乙酸和所有的糠醛、香草醛和4-羟苯甲酸[11]。吸附法主要利用树脂和活性炭具有的较强的吸附能力,去除水解液中的抑制物。一般地,脱毒的效果依次为阴离子交换树脂>中性树脂>阳离子交换树脂[12]。在碱性条件下,阴离子交换树脂能有效地去除阴离子和中性抑制物。活性炭对抑制物的去除效果受抑制物性质、水解液pH、处理温度和时间以及活性炭浓度的影响[13]。电渗析是将阴阳离子交换膜交替排列于正负电极之间,用特质的隔板将其隔开,组成淡化和浓缩两个系统,在直流电源的作用下,以电位差为推动力,利用膜材料的选择透过性,把电解质从溶液中分离出来,从而实现溶质的分离、浓缩、精制和提纯。双极性膜是一种新型的离子交换复合膜。它由阳离子交换层 (N型膜) 和阴离子交换层 (P型膜) 复合而成,在直流电场的作用下将水离解,在膜两层分别得到氢离子和氢氧根离子。双极性膜电渗技术目前已经应用于酸的生产和回收工艺[14-15]。
化学法主要是通过加入化学试剂使水解液中的抑制物形成沉淀或者通过调节pH使抑制物解离以去除毒性化合物的方法。目前应用最广泛的是1945年Leonard和Hajny[16]报道的过量碱法 (Over liming),即先向预水解液中加入Ca(OH)2,调节pH到9−12,使抑制物沉淀,经过离心后再向得到的上清水解液中加入稀硫酸,调节pH到5.5。
生物法是指利用酶或者微生物的降解作用以达到改变抑制物结构、降低毒性的方法[17]。生物法可分为酶处理和微生物处理。由于酶具有专一性,所以酶处理只能去除特定的抑制物。漆酶对酚类化合物的去除作用是明显的,但对于乙酸、糠醛和羟甲基糠醛无去除作用[18]。灰盖鬼伞担子菌Coprinus cinereus IFO 8371生产的过氧化物酶在H2O2存在的情况下,可以将香豆酸、阿魏酸、4-羟基苯甲酸、香草醛、紫丁香醛、香草酸6种化合物转化成高分子量化合物,从而提高拜氏梭菌Clostridium beijerinckii利用木质纤维素水解液发酵丁醇的性能[19]。微生物脱毒指的是利用丝状软腐菌Trichoderma reesei等微生物,去除水解液中乙酸、糠醛和安息香酸衍生物等的方法。例如,利用丝状软腐菌处理蒸汽爆破预处理过的柳树半纤维素水解液,乙醇的产率可以提升3−4倍[20]。不同抑制物去除方法的优缺点对比见表1。
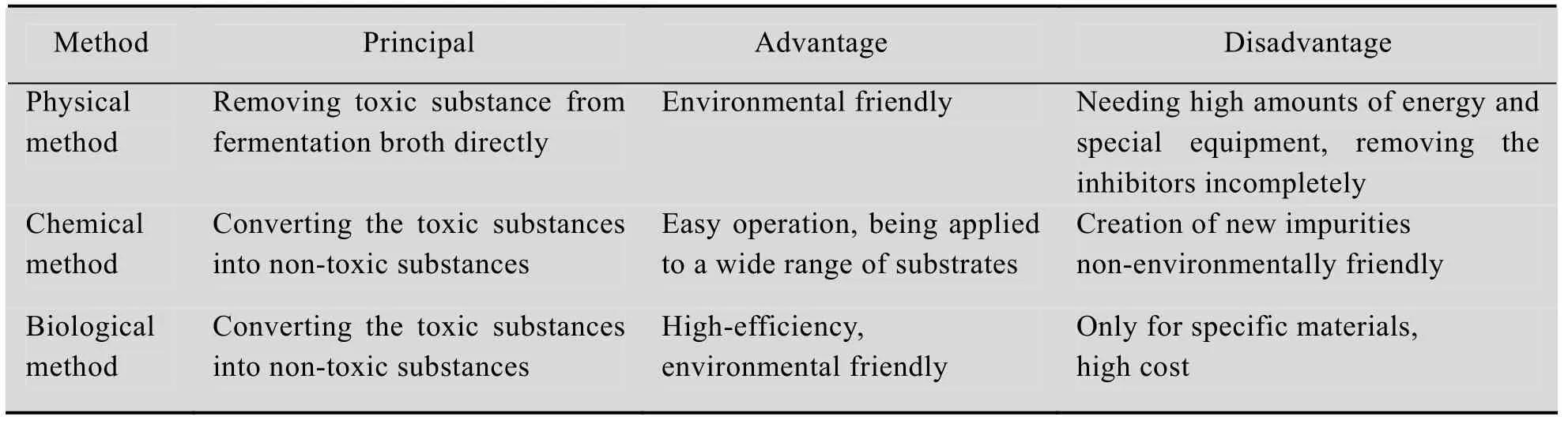
表1 不同抑制物去除方法优缺点对比Table 1 Comparison of the different inhibitors removal methods
2.2 抑制物耐受菌选育
物理、化学或生物等脱毒方法只能部分去除纤维素水解液中的抑制物,无法完全克服抑制物对宿主细胞的毒害作用,并且生物脱毒的费用一般占到总投入的30%−40%,几乎是木质纤维素生物转化过程中投入最大的一项工序,使得诸如丁醇等发酵产物进一步降低了自己在同类产品中的竞争力[21]。因此,从发酵微生物本身出发选育高耐受的菌株,则成为解决底物抑制物问题的另一种有效方法。根据育种方式的不同,可以分为传统诱变、代谢工程和合成生物学。
传统诱变是指通过一些强烈的化学诱变因子,如甲基磺酸乙酯 (EMS)、亚硝基胍 (NTC)、丙烯醇等,以及紫外线等物理诱变条件对出发菌进行诱变以获取抑制物耐受菌株的方法。由于单一的诱变方法具有菌种性状不稳定、突变方向随机等缺点,最近几年的研究多集中于复合诱变和菌种驯化。复合诱变是指利用多种诱变剂同时或者依次对出发菌进行处理。诱变剂的复合处理有一定的协同诱变效应,能增强诱变效果,并能将多种优良性状集中于同一菌株[22]。驯化是指让细胞长期在某一环境下生长,使其能够适应并具有良好性状的进化过程。驯化是在对机理知识理解不足的情况下获得具有目标特性菌株的有效方法。丁明珠等以酿酒酵母为出发菌种,通过紫外诱变结合驯化的方法筛选出1株对于糠醛、苯酚和乙酸都有很强耐受能力的菌株[23]。Keating等[24]利用糠醛、5-羟甲基糠醛和乙酸溶液对酿酒酵母进行驯化,得到了一株在纤维素水解液中具有良好发酵效果的酵母菌株。Liu等[25]也利用驯化的方法得到了能耐受糠醛的酵母菌株,从而实现了对纤维素水解液中糠醛抑制物的原位脱毒。
分子生物学技术的发展,使得产溶剂梭菌代谢工程改造成为了可能,外源基因和调控因子的引入,使代谢工程有别与传统意义上的菌种改造。利用重组技术调控细胞中酶反应、优化代谢物的转化与转运,可以有效增强宿主细胞对于抑制物的耐受能力。杨雪雪[26]对酿酒酵母同源二倍体单基因缺失株文库进行筛选,经过初筛、复筛、验证等步骤,得到了163个糠醛抗性相关基因,并成功构造出双倍体单基因缺失株siz1/siz1,dep1/dep1,sap30/sap30和单倍体单基因缺失株siz1,dep1,sap30菌株,其对10 mmol/L糠醛的抗性比各自相应的野生型菌株要高出100倍。Li等[27]利用酵母全基因组表达谱芯片,研究了酿酒酵母在转录组水平上对糠醛和醋酸的代谢响应,发现增强HMG1基因可以提高胞内糠醛的转化效率,从而增强菌体的耐受能力。Gorsich等[28]通过对酿酒酵母单基因突变体库的筛选找到62种与糠醛耐受性相关的基因。过表达其中的葡萄糖-6-磷酸脱氢酶基因ZWF1后,酿酒酵母可以在高浓度的糠醛下生长,这可能是因为过表达ZWF1使得葡萄糖-6-磷酸脱氢酶的活性增加,为糠醛还原酶或依赖NADPH的胁迫应激酶类提供了更多的还原动力 (NADPH),进而提高了菌体耐受性。
目前为止,所得到的各种抑制物耐受菌大多是通过驯化或者传统诱变筛选得到的。由于抑制物对于宿主细胞的抑制机理还不明确,很难通过定向设计获得具有高耐受性的菌种。因此,深入了解水解液中抑制物与细胞的相互作用关系,揭示细胞的脱毒机制,进而定向改造菌株,是当前代谢工程亟待解决的问题。
3 新型抑制物解除工艺
传统预处理方法[29-31]、菌种改造[24]等方法,对于突破木质纤维素抑制物瓶颈、实现木质素产业化生产是必不可少的[32]。但它们只专注于单一的技术突破,忽略了木质纤维素本身所具有的结构特点[33]。实际上,木质纤维素独特的组成特点,可以为我们提供新的研究思路[34];基于此,陈洪章课题组提出了“源头降低抑制物——纤维素木质素分级转化”炼制模式,为木质纤维素的开发和利用,探索出了一条全新的工艺路线;并在此基础上,进一步提出了“原位脱毒——发酵促进剂设计技术”,它们共同组成了当前最新型的抑制物解除工艺。
3.1 源头降低木质纤维素抑制物的分级转化炼制工艺
木质纤维素原料具有结构复杂、不均一的多级结构。从细胞组成上,可以分为纤维状的纤维细胞和杂细胞 (包括导管、薄壁细胞、表皮细胞等)。纤维细胞木质素含量较高,具有较发达的次生壁,因此厚度较大。薄壁细胞腔大、壁薄、长度短,其成分主要为纤维素[35]。由于结构和形态上的差异,这两类细胞所要求的预处理条件也是不同的[21]。纤维细胞,细胞壁木质化程度高,结构致密,受热过程中传质热阻力大,且不易被撕裂;薄壁细胞,壁薄而腔大,即有利于传质传热,有利于水蒸气闪蒸对其物理撕裂。因此,针对不同组织细胞分别优化处理条件,开发出了二段汽爆分梳技术。
其具体的工艺过程如下:
1) 将汽爆压力控制在0.5−1.0 MPa、维压1−10 min,对秸秆原料进行第一段蒸汽爆破处理。
2) 通过气流分级装置,将第一段汽爆物料进行分级,得到薄壁组织和纤维组织。薄壁组织可以直接用于纤维素发酵。
3) 将分梳得到的纤维组织在压力为1−1.5 MPa、维压时间为1−10 min条件下进行二段蒸汽爆破处理。
二段汽爆分梳工艺,不同于传统所指的二段汽爆工艺,前者采用较温和的汽爆条件进行第一段汽爆,通过气流分梳装置将第一段物料(薄壁细胞) 分级,得到薄壁组织和纤维组织,再将纤维组织在适当的条件下进行第二段汽爆。该工艺可以实现纤维素组分的有效分离,即能保证纤维组织达到较好的预处理效果,提高纤维原料的酶解效果,又能避免薄壁细胞的过度降解,从源头控制了抑制物的产生,减少了脱毒单元操作的引入,简化了工艺。
在二段汽爆以后,将汽爆后的秸秆渣送入1.2 m3酸水解罐中,同时加入0.3%−0.5%的稀硫酸,物料和稀硫酸的体积比控制在1∶5−1∶7,在110−120 ℃的温度下水解0.5−1.0 h,然后利用螺旋挤压机将水解液中的液体和固体分开,分别得到水解液和水解渣。水解液主要成分为非半纤维素,水解渣中主要为木质素和纤维素。继而采用2%的碱液提取残渣中的木质素,提取率可达96%,随后利用逐级酸性沉淀 (pH 5−2)分级木质素的方法,可以制得小于6 kDa,6−10 kDa,10−20 kDa和大于20 kDa等不同分子量范围的木质素,用于不同功能原料的开发。
本课题组的研究发现,汽爆秸秆酶解液中并不存在糠醛、5-羟甲基糠醛与乙酸的抑制问题,而汽爆秸秆木质素降解物才是抑制丁醇发酵的主要原因[36]。由于从源头去除了木质素对于半纤维素和纤维素发酵的干扰,发酵液中的抑制物种类较少,浓度较低,经过简单脱毒(5%−10%的活性炭吸附室温下处理8−12 h),即可用于正常的丁醇发酵。
基于以上重大技术突破,组建出与其技术相配套的自主加工的工业化装置系统,完成了年产600 t秸秆丁醇中试实验。所建立的技术工艺在中国吉林省松原市成功用于“30万t/年秸秆炼制”产业化生产。该生产线将为秸秆作为工业原料生产能源、材料和化学品提供新的思路和产业化示范。
该工艺有以下几个特点:1) 可以从源头降低抑制物的产生,简化了操作工序,降低了预处理的成本。2) 通过组分分离,保证了发酵底物的纯度,提高了溶质的传质速率和酶的接触面积,提高了发酵效率。3) 实现了秸秆全组分高价化经济全利用,通过经济分摊,增加了木质纤维素的经济竞争力。
本实验室所提出的“源头降低抑制物——纤维素木质素分级转化”炼制模式,为木质纤维素发酵抑制物的解除及木质纤维素开发利用提供了全新的技术路线。
3.2 基于木质纤维素发酵特点的过程强化工艺
从发酵微生物本身出发,通过增加发酵液中特殊的物质,来提高微生物细胞对抑制物的耐受能力;或者选育出能够耐受木质纤维素水解液中各种抑制物,并具有较高发酵性能的微生物,以达到脱毒的目的,这种方法通常被称为抑制物的原位脱毒。在木质纤维素发酵过程中,往往微量级别 (mg/L) 的“特殊物质”,就可以实现目标产物发酵效率的成倍增长,具有巨大的开发价值。
这些“特殊物质”称为发酵促进剂,大多数属于电子穿梭化合物,即具有多种氧化态和还原态的物质。它们在细菌代谢过程中扮演着重要的角色。外源添加这种电子穿梭化合物,可以改变胞内的电子流向,提高电子传递速率,进而理性调控生物胞内的能量状态和生理状态,提高菌体的耐受性和目标产物的合成能力。常见的电子穿梭化合物,包括中性红、亚甲基蓝、联苄吡啶、二磺酸蒽醌、Fe(OH)3和甲基紫精等。二磺酸蒽醌常用作腐殖酸的类似物,用于研究醌类物质在电子传递中的作用。外源添加还原性的二黄酸蒽醌可以改变Clostridium beijerinckii的代谢模式,提高H2的产量。Fe(OH)3是最常用的氢氧化物,在厌氧发酵中是良好的电子载体;甲基紫精同铁氧化还原蛋白的电势相似,可以参与一系列生化反应过程中的电子传递过程,通过铁氧化还原蛋白-NAD还原酶增强NAD(P)+的电子流。
1979年,Hongo等[37]首次提出了“电子能方法”(Electroenergizing) 的概念,他们向黄色短杆菌Brevibacterium flavum菌发酵液中添加中性红 (电子载体),发现谷氨酸的产量明显提高,而且从阴极传递的电子几乎全部被宿主细胞吸收。遗憾的是,他们并没有深入研究这些电子如何进入生化代谢途径。Yarlagadda等[38]通过外源添加甲基紫精,使得Clostridium sp. BC1的乙醇和丁醇产量分别提高了28倍和12倍,同时菌体对于丁醇等物质的耐受性明显提升。Liu等[39]认为这些物质与胞内的NADPH/NADP+和NADH/NAD+总比例有着直接的联系,NADPH/NADP+和NADH/NAD+总比例是主导胞内代谢状态的最主要因素。生物信息数据库KEGG中包括855和1 064个氧化还原反应,分别有106和88种以NAD+和NADP+为辅因子的酶催化反应 (到2012年10月为止),几乎涉及所有细胞骨架类化合物的构建 (如氨基酸、脂类和核酸)。通过改变胞内NADH的水平可以实现胞内代谢流的调控,提高目标产物的产量,增强菌体的抑制物耐受性[40-42]。
遗憾的是,目前对于发酵促进剂的研究,主要集中于抑制物耐受机理的阐明[43-46],实验过程中多采用合成培养基,而实际生产方面的应用几乎没有开展。基于此,我们率先开展了电子载体物质、氧化还原物质[47]与木质纤维素抑制物原位脱毒关联性的研究,利用秸秆水解液进行了实验验证,取得了良好的发酵结果;首次提出了“发酵促进剂设计技术”理念,综合运用前体工程、理论化学、计算化学和计算机辅助模拟等手段,构建出促进剂开发平台技术,为传统的发酵工艺提出了新的研究思路。其主要内容为:首先,运用组合化学手段,对已有的发酵促进剂进行归类分析,获取其决定作用的“母核”,然后运用虚拟组合库进行大通量筛选。虚拟组合库主要出自3个来源:一种是基于分子片段的直接枚举而产生的新的分子库;一种是基于反合成分析原理的片段化及重组而产生的新分子库;另一种是基于分子构象叠合和遗传算法中的杂交原理的分子重组而产生的新的分子。目前,已经成功完成了系列产品的研发,即将进行实际发酵的生产验证。
4 展望
发酵抑制物制约着木质纤维素的发酵效率,是木质纤维素生物炼制的主要瓶颈。现有的物理法、化学法、生物法等方法,只适用于特定抑制物的去除,而且投入成本较高,难以实现木质纤维素的大规模发酵。随着抑制物耐受机理研究的日益深入和以合成生物学为代表的菌种改造技术的成熟,抑制物耐受菌株的理性构建将成为可能,同时发展“高效、清洁、低成本”的抑制物解除工艺,必将助力于木质纤维素的大规模生产。笔者认为,充分结合原料的结构特点,发展“分级转化”炼制模式,从源头降低抑制物的产生,将是今后木质纤维原料预处理的发展趋势。“分级转化”炼制模式为木质纤维素的产业化提供了全新的思路和工艺“范本”,将对生物质炼制产业的发展起到推动作用。
REFERENCES
[1] Chen HZ. Biomass Science and Engineering. Beijing: Chemical Industry Press, 2008 (in Chinese).陈洪章. 生物质科学与工程. 北京: 化学工业出版社, 2008.
[2] Chen HZ. Theory and Application of Value Added Utilization of Straw. Beijing: Chemical Industry Press, 2006 (in Chinese).陈洪章. 秸秆资源生态高值化理论与应用. 北京: 化学工业出版社, 2006.
[3] Yang SH. Plant Fiber Chemistry. Beijing: China Light Industry Press, 2001 (in Chinese).杨淑蕙. 植物纤维化学. 北京: 中国轻工业出版社, 2001.
[4] Chen H, Li G, Li H. Novel pretreatment of steam explosion associated with ammonium chloride preimpregnation. Bioresour Technol, 2014, 153: 154–159.
[5] Almeida JR, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae. J Chem Technol Biot, 2007, 82(4): 340–349.
[6] Palmqvist E, Hahn-Hagerdal B. Fermentation of lignocellulosic hydrolysates. II: inhibitors and mechanisms of inhibition. Bioresour Technol, 2000, 74(1): 25–33.
[7] Taherzadeh M, Gustafsson L, Niklasson C, et al. Physiological effects of 5-hydroxymethylfurfural on Saccharomyces c erevisiae. Appl Microbiol Biot, 2000, 53(6): 701–708.
[8] Ando S, Arai I, Kiyoto K, et al. Identification of aromatic monomers in steam-exploded poplar and their influences on ethanol fermentation by Saccharomyces cerevisiae. J Biosci Bioeng, 1986,64(6): 567–570.
[9] Li H, Chen H. Detoxification of steam-exploded corn straw produced by an industrial-scale reactor. Process Biochem, 2008, 43(12): 1447–1451.
[10] Converti A, Dominguez JM, Perego P, et al. Wood hydrolysis and hydrolyzate detoxification for subsequent xylitol production. Chem Eng Technol, 2000, 23(11): 1013–1020.
[11] Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. I: inhibition and detoxification. Bioresour Technol, 2000, 74(1): 17–24.
[12] Nilvebrant NO, Reimann A, Larsson S, et al. Detoxification of lignocellulose hydrolysates with ion-exchange resins. Appl Biochem Biotech, 2001, 91(1/9): 35–49.
[13] Angın D, Altintig E, Köse TE. Influence of process parameters on the surface and chemical properties of activated carbon obtained from biochar by chemical activation. Bioresour Technol, 2013, 148: 542–549.
[14] Cheng KK, Cai BY, Zhang JA, et al. Sugarcane bagasse hemicellulose hydrolysate for ethanol production by acid recovery process. Biochem Eng J, 2008, 38(1): 105–109.
[15] Qureshi N, Ezeji TC, Ebener J, et al. Butanol production by Clostridium beijerinckii. Part I: Use of acid and enzyme hydrolyzed corn fiber. Bioresour Technol, 2008, 99(13): 5915–5922.
[16] Leonard RH, Hajny GJ. Fermentation of wood sugars to ethyl alcohol. Ind Eng Chem, 1945, 37(4): 390–395.
[17] Xue J, Pu H, Sun CB. Methods of the elimination of the inhibitors in the lignocellulosic hydrolysates. J Cell Sci Technol, 2004, 12(3): 48–53 (in Chinese).薛珺, 蒲欢, 孙春宝. 纤维素稀酸水解产物中发酵抑制物的去除方法. 纤维素科学与技术, 2004, 12(3): 48–53.
[18] Jönsson L, Palmqvist E, Nilvebrant NO, et al. Detoxification of wood hydrolysates with laccase and peroxidase from the white-rot fungus Trametes versicolor. Appl Microbiol Biot, 1998, 49(6): 691–697.
[19] Cho DH, Lee YJ, Um Y, et al. Detoxification of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanol production from Clostridium b eijerinckii. Appl Microbiol Biot, 2009, 83(6): 1035–1043.
[20] Palmqvist E, Hahn-Hägerdal B, Szengyel Z, et al. Simultaneous detoxification and enzyme production of hemicellulose hydrolysates obtained after steam pretreatment. Enzyme Microb Technol, 1997, 20(4): 286–293.
[21] Zhang YZ, Fu XG, Chen HZ. Pretreatment based on two-step steam explosion combined with an intermediate separation of fiber cells-optimization of fermentation of corn straw hydrolysates. Bioresour Technol, 2012, 121: 100–104.
[22] Mao SM, Zhang HY. Study on screening the butanol-tolerant mutant of Clostridium acetobutylicum and its physiological characteristics. J Central South Univ For Technol, 2012, 32(8): 103–107 (in Chinese).毛绍名, 章怀云. 丙酮丁醇梭菌高耐丁醇突变株的选育及其生理特性的研究. 中南林业科技大学学报, 2012, 32(8): 103–107.
[23] Ding MZ, Zhou X, Yuan YJ. Metabolome profiling reveals adaptive evolution of Saccharomyces cerevisiae during repeated vacuum fermentations. Metabolomics, 2010, 6(1): 42–55.
[24] Keating JD, Panganiban C, Mansfield SD. Tolerance and adaptation of ethanologenic yeasts to lignocellulosic inhibitory compounds. Biotechnol Bioeng, 2006, 93(6): 1196–1206.
[25] Liu ZL, Slininger PJ, Gorsich SW. Enhanced biotransformation of furfural and hydroxymethylfurfural by newly developed ethanologenic yeast strains. the 26th Symposium on Biotechnology for Fuels and Chemicals. Totowa: Humana Press, 2005: 451–460.
[26] Yang XX. Genome-wide study for genes involved in furfural tolerance in Saccharomyces cerevisiae [D]. Tianjin: Tianjin University, 2012 (in Chinese).杨雪雪. 酿酒酵母基因组中糠醛耐受相关基因的初步研究[D]. 天津: 天津大学, 2012.
[27] Li BZ, Cheng JS, Qiao B, et al. Genome-wide transcriptional analysis of Saccharomyces cerevisiae during industrial bioethanol fermentation. J Ind Microbiol Biot, 2010, 37(1): 43–55.
[28] Gorsich S, Dien B, Nichols N, et al. Tolerance to furfural-induced stress is associated with pentosephosphate pathway genes ZWF 1, GND 1, RPE 1, and TKL 1 in Saccharomyces c erevisiae. Appl Microbiol Biot, 2006, 71(3): 339–349.
[29] Chen HZ, Sun FB. Novel bioconversion of wheat straw to bio-organic fertilizer in a solid-state bioreactor. Bioproc Biosyst Eng, 2007, 30(2): 99–105.
[30] Li DM, Chen HZ. Biological hydrogen production from steam-exploded straw by simultaneous saccharification and fermentation. Int J Hydrogen Energ, 2007, 32(12): 1742–1748.
[31] Chen HZ, Han YJ, Xu J. Simultaneous saccharification and fermentation of steam exploded wheat straw pretreated with alkaline peroxide. Process Biochem, 2008, 43(12): 1462–1466.
[32] Chen HZ. Process Engineering in Plant-Based Products. Beijing: Chemicaly Industry Press, 2010 (in Chinese).陈洪章. 生物基产品过程工程. 北京: 化学工业出版社, 2010.
[33] Chen H, Qiu W. Key technologies for bioethanol production from lignocellulose. Biotechnol Adv, 2010, 28(5): 556–562.
[34] Zhao J, Chen H. Correlation of porous structure, mass transfer and enzymatic hydrolysis of steam exploded corn stover. Chem Eng Sci, 2013, 104: 1036–1044.
[35] Chen HZ, Wang L. Biomass Biochemical Conversion Technology. Beijing: Metallurgical Industry Press, 2012 (in Chinese).陈洪章, 王岚. 生物质生化转化技术. 北京: 冶金工业出版社, 2012.
[36] Wang L, Chen H. Increased fermentability of enzymatically hydrolyzed steam-exploded corn stover for butanol production by removal of fermentation inhibitors. Process Biochem, 2011, 46(2): 604–607.
[37] Hongo M, Iwahara M. Determination of electro-energizing conditions for L-glutamic acid fermentation. Agric Biol Chem, 1979, 43: 2083–2086.
[38] Yarlagadda VN, Gupta A, Dodge CJ, et al. Effect of exogenous electron shuttles on growth and fermentative metabolism in Clostridium sp. BC1. Bioresour Technol, 2012, 108: 295–299.
[39] Liu CG, Xue C, Lin YH, et al. Redox potential control and applications in microaerobic and anaerobic fermentations. Biotechnol Adv, 2013, 31(2): 257–265.
[40] Doi Y, Shimizu M, Fujita T, et al. Achromobacter denitrificans YD35 pyruvate dehydrogenase controls NADH production to tolerate extremely high nitrite levels. Appl Environ Microbiol, 2014, 80(6): 1910–1918.
[41] Kang TS, Korber DR, Tanaka T. Influence of oxygen on NADH recycling and oxidative stress resistance systems in Lactobacillus pa nis PM1. AMB Express, 2013, 3(1): 1–9.
[42] Jonsson LJ, Alriksson B, Nilvebrant NO. Bioconversion of lignocellulose: inhibitors and detoxification. Biotechnol Biofuels, 2013, 6(1): 16.
[43] Zhao XQ, Bai FW. Zinc and yeast stress tolerance: Micronutrient plays a big role. J Biotechnol, 2012, 158(4): 176–183.
[44] Nabais RC, Sá-Correia I, Viegas CA, et al. Influence of calcium ion on ethanol tolerance of Saccharomyces bayanus and alcoholic fermentation by yeasts. Appl Environ Microbiol, 1988, 54(10): 2439–2446.
[45] Dombek KM, Ingram LO. Magnesium limitation and its role in apparent toxicity of ethanol during yeast fermentation. Appl Environ Microbiol, 1986, 52(5): 975–981.
[46] Sootsuwan K, Thanonkeo P, Keeratirakha N, et al. Sorbitol required for cell growth and ethanol production by Zymomonas mo bilis under heat, ethanol, and osmotic stresses. Biotechnol Biofuels, 2013, 6(1): 180.
[47] Wang L, Xia ML, Zhang L, et al. Promotion of the Clostridium ac etobutylicum ATCC 824 growth and acetone-butanol-ethanol fermentation by flavonoids. World J Microbiol Biotechnol, 2014: 1–8. DOI 10.1007/s11274–014–1619–y.
(本文责编 陈宏宇)
Application of process engineering to remove lignocellulose fermentation inhibitors
Lan Wang, Menglei Xia, and Hongzhang Chen
Beijing Key Laboratory of Biomass Refining Engineering, Institute of Process Engineering, Chinese Academy of Science, Beijing 100190, China
Fermentation inhibitors are toxic to cells, which is one of the bottlenecks for lignocellulose bio-refinery process. How to remove those inhibitors serves a key role in the bioconversion of lignocellulose. This article reviews the sources and the types of the inhibitors, especially the updated removal strategies including physical methods, chemical methods, biological methods and inhibitor-tolerant strain construction strategies. Based on these, we introduce a new bio-refinery model named“fractional conversion”, which reduces the production of inhibitors at pretreatment stage, and a novel in situ detoxification method named “fermentation promoter exploitation technology”. This review could provide new research ideas on the removal of fermentation inhibitors.
lignocellulose, fermentation inhibitors, reducing inhibitors from the very beginning, fractional conversion, fermentation promoter
January 27, 2014; Accepted: March 10, 2014
Hongzhang Chen. Tel/Fax: +86-10-82627071; E-mail: hzchen@ipe.ac.cn
王岚, 夏梦雷, 陈洪章. 过程工程在木质纤维素发酵抑制物解除中的应用. 生物工程学报, 2014, 30(5): 716–725.
Wang L, Xia ML, Chen HZ. Application of process engineering to remove lignocellulose fermentation inhibitors. Chin J Biotech, 2014, 30(5): 716–725.
Supported by: Special Funds of the Science and Technology Innovation Base for Beijing Key Laboratory of Biomass Refining Engineering (No. Z13111000280000), National High Technology Research and Development Program (863 Program) (No. 2012AA021302), National Basic Research Program of China (973 Program) (No. 2011CB707401).
生物质炼制工程北京市重点实验室2013年度科技创新基地培育与发展工程专项项目 (No. Z13111000280000), 国家高技术研究发展计划 (863计划) (No. 2012AA021302), 国家重点基础研究发展计划 (973计划) (No. 2011CB707401) 资助。
时间:2014-04-01 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140063.html
