吗啡促乳腺癌细胞转移的YAP相关信号机制研究
2014-06-23杨远东张灵敏
杨远东,张灵敏,袁 慧,袁 伟
(西安交通大学医学院第一附属医院麻醉科,陕西西安 710061)
吗啡促乳腺癌细胞转移的YAP相关信号机制研究
杨远东,张灵敏,袁 慧,袁 伟
(西安交通大学医学院第一附属医院麻醉科,陕西西安 710061)
目的探讨YAP相关的分子信号通路在吗啡促乳腺癌细胞转移中的作用及机制。方法应用RNA干扰技术降低人乳腺癌BT474细胞中YAP蛋白的表达,体外Transwell细胞转移实验验证YAP蛋白被抑制后,吗啡对乳腺癌细胞转移的刺激作用。采用Western blot技术检测吗啡处理后,乳腺癌细胞中YAP蛋白及磷酸化YAP蛋白的表达;细胞免疫荧光分析吗啡对YAP蛋白细胞内定位的影响。结果siRNA能有效抑制乳腺癌BT474细胞中YAP蛋白的表达,吗啡干预后的乳腺癌BT474细胞转移数显著高于对照组(79.4±5.48 vs.32.2±6.42,P=0.000 5),而当YAP蛋白被抑制后,吗啡未能增加BT474细胞的转移(29.2±4.08 vs.21.2±2.58,P=0.135 9);Western blot检测发现,在BT474细胞的培养基中加入吗啡干预后后,磷酸化的YAP含量随着时间的增加而显著降低,但总YAP蛋白的表达无显著变化,同时,细胞免疫荧光证实吗啡能促进BT474细胞中YAP蛋白在细胞核内聚集。结论吗啡能通过激活细胞中的YAP蛋白从而促进乳腺癌的转移。
吗啡;乳腺癌;转移;YAP蛋白
阿片受体激动剂具有强大的镇痛作用,广泛使用于麻醉的诱导给药及疼痛治疗。其中,最具代表性的药物即为吗啡,其能通过与神经系统中阿片受体(μ、δ和κ)结合发挥镇静及镇痛作用。尽管吗啡具有一系列的副作用,如成瘾、呼吸抑制、免疫抑制等,但临床上仍把它作为严重疼痛的首选用药,特别是对于癌性疼痛[1]。然而,大量的证据表明,吗啡在抑制恶性疼痛的同时,也能促进肿瘤细胞的增殖、转移及侵袭[2-3]。在乳腺癌中,吗啡一方面能激活血管上皮生长因子受体(VEGFR)增加肿瘤的血管生成[4],另一方面又能促使乳腺癌细胞中的基质降解酶及纤溶酶原激活[5-6],并最终导致乳腺癌的远处转移。YAP,全称为Yes相关蛋白(Yes-associated protein),是一种共转录激活因子,具有调控其下游多种基因表达的作用。有研究显示,YAP表达或活性的升高可导致肿瘤细胞内VEGFR的激活增加,并促进肿瘤细胞转移及侵袭[7]。因此,我们设想吗啡能通过YAP信号分子促进乳腺癌细胞的转移。
1 材料与方法
1.1 实验试剂YAP、phospho-YAP(Ser127)抗体购于Cell Signaling公司;GAPDH抗体及YAP-siRNA购于Santa Cruz Biotechnology公司;荧光标记Alexafluor二抗购于Life Technologies;Lipofectamine 2000转染试剂购于Invitrogen;100 mL/L胎牛血清及RPMI 1640培养基均购于GIBCO公司。
1.2 培养及转染本实验中使用的BT474乳腺癌细胞系购于Cell Lines Service Inc.,并使用含100 m L/L胎牛血清及100μg/m L青霉素/链霉素(P/S)的RPMI 1640培养基培养。所有细胞均放置于含50 m L/L CO2的37℃的恒温培养箱中。利用siRNA转染时,于6孔板中每孔接种105个细胞,加入2 m L培养基,当细胞密度达到80%~90%时使用Lipofectamine 2000作为转染试剂,并在转染48 h后检测转染效率。
1.3 Western blot检测收集细胞,RIPA缓冲液裂解细胞提取总蛋白并进行定量,配制SDS-PAGE分离胶及浓缩胶,计算50 ng蛋白溶液上样体积,常规电泳、转膜后孵育一抗及荧光标记的二抗,使用Odyssey红外成像系统(Infrared Imaging System,Li-Cor Biosciences)检测膜上的荧光强度并进行分析。
1.4 细胞免疫荧光染色BT474细胞接种在带培养小室的载玻片上,按实验目的进行药物干预后,除去培养基,PBS漂洗3遍后40 g/L多聚甲醛室温固定15 min,封闭液(PBS、30 m L/L的羊血清、3 m L/L Triton X-100)封闭1 h后,加入YAP一抗(1∶100稀释,PBS、15 m L/L的羊血清、3 m L/L Triton X-100)4℃过夜。PBS再次漂洗后加入Alexa Fluor 488-标记的二抗(Invitrogen,1∶500稀释),室温孵育2 h后PBS漂洗3遍,DAPI染色后封片,荧光显微镜观察并拍照。
1.5 体外细胞转移实验在8μm孔径的Transwell小室(购于Corning公司)聚碳酸酯膜的下侧包裹10μL质量浓度为0.1 mg/m L的collagen I蛋白,室温干燥30 min;收集细胞,无血清培养基漂洗2次;下层24孔培养板中每孔加入0.3 m L含有或不含有干预药物(吗啡10μmol/L)的培养基;上层Transwell小室中加入0.3 m L含5×104个细胞的培养基;50 m L/L CO2、37℃恒温培养16 h;用湿棉签轻轻擦掉小室膜上侧未迁移的细胞,甲醇固定20 min,1 m L/L结晶紫染色20 min,用清水洗3遍以上,高倍显微镜下随机5个视野观察细胞并计数。
1.6 统计学方法采用SPSS 19.0统计软件进行分析。计量资料使用均数±标准差()表示,两两比较采用Student t检验,多组间比较采用ANOVA方差检验。
2 结 果
2.1 YAP-siRNA干扰对BT474细胞中YAP表达的影响为了降低乳腺癌BT474细胞中YAP蛋白的表达,我们利用YAP-siRNA转染细胞,48 h后Western blot检测空白对照组和干扰组细胞内YAP蛋白的表达。结果显示,干扰组细胞中YAP的含量明显低于对照组(P<0.000 1),表明了YAP-siRNA的有效性和脂质体转染系统的可靠性(图1)。

图1 siRNA抑制乳腺癌BT474细胞中YAP蛋白的表达Fig.1 siRNA down-regulated expression of YAP in BT474 cells
2.2 吗啡促进BT474细胞转移依赖于YAP蛋白表达为了检验YAP蛋白对吗啡促进乳腺癌细胞转移的影响,我们把细胞分为2组,一组为正常的BT474细胞,另一组为siRNA转染后YAP蛋白低表达的乳腺癌细胞,利用体外Transwell细胞转移实验分别比较吗啡刺激16 h后细胞的转移数。单侧ANOVA方差检验发现各组间细胞转移数存在统计学差异(P<0.000 1),在正常的BT474细胞培养基中加入10μmol/L吗啡后,与未加吗啡的对照组相比,细胞转移数明显增加(79.4±5.48 vs.32.2± 6.42,P=0.000 5,图2);而YAP蛋白表达被抑制后的BT474细胞在利用同浓度的吗啡刺激后,细胞的转移并未出现显著升高(29.2±4.08 vs.21.2± 2.58,P=0.135 9,图2);同时,我们还观察到BT474细胞的YAP蛋白受抑制后,与未干扰的细胞相比,其本身的转移能力也有所下降,但不具统计学意义(32.2±6.42 vs.21.2±2.58,P=0.150 6,图2)。

图2 吗啡促BT474细胞转移及YAP-siRNA抑制吗啡促细胞转移Fig.2 Morphin-induced migration of BT474 cells and inhibited by YAP-siRNA
2.3 吗啡去磷酸化激活YAP蛋白吗啡诱导乳腺癌细胞转移依赖于YAP蛋白,为了进一步了解其机制,我们使用吗啡刺激BT474细胞后,收集不同时间点的总蛋白,Western blot检测总蛋白中YAP含量的变化及其磷酸化状态的改变。结果显示,吗啡刺激细胞后,总YAP蛋白的含量未出现改变,而其磷酸化状态(p YAP)在2 h后逐渐降低(图3)。此外,利用细胞免疫荧光染色技术检测BT474细胞中YAP蛋白的定位,绿色荧光标记YAP蛋白,DAPI(红色荧光)标记细胞核,发现吗啡刺激4 h后,BT474细胞核内绿色荧光强度明显升高,表明细胞中YAP在核内浓集,进而发挥共转录激活因子的活性(图4,Overlay为YAP蛋白染色与核染色叠加后成像)。
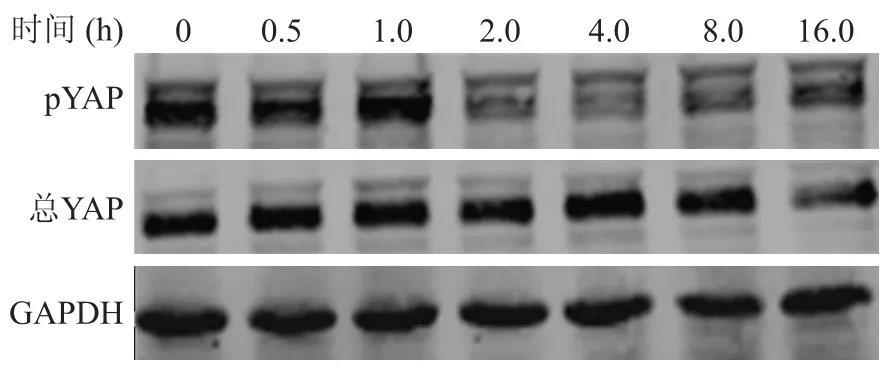
图3 吗啡促BT474细胞YAP去磷酸化Fig.3 Morphine-induced dephosphorylation of YAP in BT474 cells

图4 吗啡诱导BT474细胞中YAP蛋白核内浓集Fig.4 Morphine-induced YAP nuclear translocation in BT474 cells
3 讨 论
吗啡作为一种阿片类药物可以和大脑中的阿片类受体结合,具有强大的镇痛作用,并被广泛用于晚期癌症患者的疼痛治疗,以提高生存质量[8]。然而,一些研究证据显示,在乳腺癌中,吗啡具有促进肿瘤细胞增殖、转移及侵袭的作用,并对其在肿瘤治疗中的应用提出质疑[4,9]。本实验中,乳腺癌细胞BT474在吗啡刺激后,表现为转移能力的增加,也证实了之一观点,并与WEINGAERTNER等人[10]的研究具有一致性。但值得注意的是,另外也有一些研究表明,吗啡同样具有抑制乳腺癌生长或增加化疗敏感的作用[11-12],这可能是由于实验条件的不一致导致,如选用了不同的肿瘤细胞系、吗啡作用的剂量及时间不同,因此吗啡与乳腺癌进展恶化的研究尚待进一步研究。
肿瘤的进展恶化与新生血管的形成密不可分。既往研究发现,在乳腺癌研究模型中,吗啡具有促血管生成活性[9]。其涉及的分子机制可能包括激活了G蛋白-MAPK-VEGF受体信号、EGF受体信号、高表达COX-2或前列腺素E2等介导血管形成[4,10,13-14]。在这些信号分子中,有证据显示,细胞中的YAP蛋白能调控其中的VEGF受体的活化[7,15]。因此,我们设想YAP蛋白也可能作为吗啡促肿瘤细胞转移的重要调控因子之一。本研究发现,当乳腺癌细胞YAP蛋白表达降低时,与未干预的细胞相比,吗啡促使其转移的能力明显下降,这一结果证实了我们的设想。而针对YAP的研究发现,其可作为一种癌蛋白在多种肿瘤组织中表现为其本身表达升高或去磷酸化活化,最终导致细胞核内的YAP含量增加,并作为共转录激活因子促使其下游的肿瘤相关基因高表达[16]。我们认为,相对于YAP蛋白的表达增高,其磷酸化的状态更为重要。本研究也发现,吗啡刺激细胞后并未引起其高表达,而是通过抑制其磷酸化促使YAP更多的进入细胞核中。最近的研究证实,共转录激活因子YAP进入细胞核内,能促进细胞因子amphiregulin的大量分泌,其作为EGFR的配体能有效刺激EGFR信号通路的激活[7,15,17]。但在本实验中,未能对这一机制进行深入研究;同时吗啡作为一种细胞外分子,其如何通过与相应的受体结合活化YAP蛋白使其发生去磷酸的机制也有待进一步阐明。
[1]MANTYH PW.Cancer pain and its impact on diagnosis,survival and quality of life[J].Nat Rev Neurosci,2006,7(10):797-809.
[2]GACH K,WYREBSKA A,FICHNA J,et al.The role of morphine in regulation of cancer cell growth[J].Naunyn Schmiedebergs Arch Pharmacol,2011,384(3):221-230.
[3]BIMONTE S,BARBIERI A,PALMA G,et al.The role of morphine in animal models of human cancer:does morphine promote or inhibit the tumor growth?[J].Biomed Res Int,2013,2013(258141.
[4]FAROOQUI M,LI Y,ROGERS T,et al.COX-2 inhibitor celecoxib prevents chronic morphine-induced promotion of angiogenesis,tumour growth,metastasis and mortality,without compromising analgesia[J].Br J Cancer,2007,97(11):1523-1531.
[5]GACH K,SZEMRAJ J,FICHNA J,et al.The influence of opioids on urokinase plasminogen activator on protein and m RNA level in MCF-7 breast cancer cell line[J].Chem Biol Drug Des,2009,74(4):390-396.
[6]AFSHARIMANI B,BARAN J,WATANABE S,et al.Morphine and breast tumor metastasis:the role of matrix-degrading enzymes[J].Clin Exp Metastasis,2014,31(2):149-158.
[7]CAI H,XU Y.The role of LPA and YAP signaling in longterm migration of human ovarian cancer cells[J].Cell Commun Signal,2013,11(1):31.
[8]WIFFEN PJ,WEE B,MOORE RA.Oral morphine for cancer pain[J].Cochrane Database Syst Rev,2013,7,CD003868.
[9]GUPTA K,KSHIRSAGAR S,CHANG L,et al.Morphine stimulates angiogenesis by activating proangiogenic and survival-promoting signaling and promotes breast tumor growth[J].Cancer Res,2002,62(15):4491-4498.
[10]WEINGAERTNER IR,KOUTNIK S,AMMER H.Chronic morphine treatment attenuates cell growth of human BT474 breast cancer cells by rearrangement of the ErbB signalling network[J].PloS One,2013,8(1):e53510.
[11]HATZOGLOU A,OUAFIK L,BAKOGEORGOU E,et al. Morphine cross-reacts with somatostatin receptor SSTR2 in the T47D human breast cancer cell line and decreases cell growth[J].Cancer Res,1995,55(23):5632-5636.
[12]GE ZH,WANG ZX,YU TL,et al.Morphine improved the antitumor effects on MCF-7 cells in combination with 5-Fluorouracil[J].Biomed Pharmacother,2014,68(3):299-305.
[13]CHEN C,FAROOQUI M,GUPTA K.Morphine stimulates vascular endothelial growth factor-like signaling in mouse retinal endothelial cells[J].Curr Neurovasc Res,2006,3(3):171-180.
[14]CHANG SH,LIU CH,CONWAY R,et al.Role of prostaglandin E2-dependent angiogenic switch in cyclooxygenase 2-induced breast cancer progression[J].Proc Natl Acad Sci U S A,2004,101(2):591-596.
[15]YANG N,MORRISON CD,LIU P,et al.TAZ induces growth factor-independent proliferation through activation of EGFR ligand amphiregulin[J].Cell Cycle,2012,11(15):2922-2930.
[16]JOHNSON R,HALDER G.The two faces of Hippo:targeting the Hippo pathway for regenerative medicine and cancer treatment[J].Nat Rev Drug Discov,2013,
[17]ZHANG J,JI JY,YU M,et al.YAP-dependent induction of amphiregulin identifies a non-cell-autonomous component of the Hippo pathway[J].Nat Cell Biol,2009,11(12):1444-1450.
(编辑 卓选鹏)
The role of YAP in morphine-induced migration of breast cancer cells
YANG Yuan-dong,ZHANG Ling-min,YUAN Hui,YUAN Wei
(Department of Anesthesiology,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo investigate the role of yes-associated protein(YAP)signaling pathway in morphineinduced migration of breast cancer cells.MethodsYAP in BT474 cells was down-regulated using siRNA. Migration assays were conducted using in vitro transwell cell migration assays.Western blots were performed to detect changes of YAP and phosphorylated YAP expressions in breast cancer cells after treatment with morphine. The translocation of YAP in cells was analyzed by immunofluorescence staining.ResultsThe expression of YAP in BT474 cells was significantly inhibited by YAP-siRNA.Morphine could significantly increase the migration of breast cancer cells as compared to that of controls(79.4±5.48 vs.32.2±6.42,P=0.0005).Down-regulated YAP led to inhibition of morphine-induced BT474 cell migration(29.2±4.08 vs.21.2±2.58,P=0.135 9).In addition,morphine-induced YAP dephosphorylation and nuclear translocation in the time-dependent manner.Conclusion Morphine can promote the metastasis of breast cancer by activating YAP protein in the cancer cells.
morphine;breast cancer;migration;yes-associated protein(YAP)
R971.2
A
1671-8259(2014)05-0618-04
10.7652/jdyxb201405010
2014-01-07
2014-04-02
陕西省科技攻关项目(No.2013SF2-14) Supported by the Key Science and Technology Program of Shaanxi Province(No.2013SF2-14)
杨远东(1968-),男(汉族),主治医师.E-mail:yyd519@163.com
时间:2014-07-22 16∶31 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1631.011.html
