新疆莎车县5个扁桃品种抗寒性比较研究
2014-06-21王梦雪李志军
王 琳 王梦雪 李志军
扁桃(Amygdalus communis L.)属蔷薇科李亚科桃属扁桃亚属植物,为世界著名的干果树种,原产于中亚细亚和非洲北部山区,新疆也是扁桃的原产地之一[1]。其适应性强,耐旱、耐贫瘠、耐热、耐盐碱,特别适合在新疆发展,是南疆干旱荒漠及绿洲地区生态建设的优良树种。扁桃品种极其丰富,据报道,全世界有扁桃品种4 000余个,我国自行培育和引进的品种有200多个,其中新疆约有90多个[2]。主要集中在南疆的喀什、疏勒、疏附、英吉沙、叶城、泽普、和田等地,栽培面积约为10 000 hm2[3]。虽然品种资源丰富,但是由于冬季不能顺利越冬等原因影响其经济效益。因此,选育抗寒扁桃品种是促进扁桃产业化发展的必由之路,而研究扁桃品种的抗寒能力对抗寒品种的选育以及在我国各地的推广具有重要的意义。目前对新疆莎车县主栽扁桃品种抗寒性的研究尚未见报道。本研究以新疆莎车县5个主栽扁桃品种为研究对象,分析与抗寒性相关生理生化指标(相对电导率、MDA含量、Pro含量、SOD活性、可溶性蛋白及可溶性糖)的变化规律,初步评价5个扁桃品种在栽培地抗寒性的强弱,为抗寒性品种选育和栽培推广提供理论依据。
1 材料与方法
1.1 材料
供试材料为纸皮1号、阿曼尼莎11号、叶尔羌14号、晚丰18号、选育品种5号,5个扁桃品种一年生枝条于2013年1月取自新疆莎车县扁桃生产基地。
1.2 仪器
DDS-11C电导仪、高速台式冷冻离心机(HERMLE Z323K)、电子天平(梅特勒 -特利多AL104)、WD4005低温试验箱、755B单光束紫外可见分光光度计等。
1.3 试验方法
1.3.1 材料处理 将采集的供试扁桃1年生枝条剪成30~40 cm长的枝段,石蜡封闭两端剪口,先后用自来水和去离子水洗涤晾干后,用塑料袋分装好待处理。处理温度为-15℃、-20℃、-25℃、-30℃、-35℃、-40℃。每处理设3个重复,每个处理12个枝条。冷冻处理时,将分装好的枝条放人低温冰箱,以3℃/h-1速度降温,降到所设温度后维持24 h,备测。
1.3.2 萌芽率统计 将不同低温处理后的枝条于室温条件下进行水培,4周后统计萌芽率,每个处理重复3次,每个处理12个枝条。萌芽率=(萌发芽个数/水培枝条芽的总数)×100%。
1.3.3 生理指标的测定
1.3.3.1 电解质相对外渗率的测定[4]
将低温冷冻处理后的枝条切片,然后称取1g试样投入三角瓶中,加入50 ml的蒸馏水,浸泡24 h,即可以测定出浸出液的电导率值。测试材料需设重复三次,然后将低温处理后测定的各样品,放在水浴锅中煮沸1 h,杀死组织,再加蒸馏水补充到原来溶液的定量,静止冷却1 h后测定其电导率,用百分比法计算供试样品的电解质的相对外渗率。
电解质的相对外渗率(伤害度)=处理电导率值/处理煮沸后电导率值×100%
1.3.3.2 可溶性蛋白质含量的测定[5]:采用考马斯亮蓝G-250染色法。
1.3.3.3 丙二醛(MDA)含量的测定[4]:硫代巴比妥酸(TBA)法测定。
正常情况下由于植物体内活性氧的产生与清除处于平衡状态,不会导致植物伤害。但在低温胁迫环境下,植物器官往往发生膜脂过氧化作用。
1.3.3.4 脯氨酸含量的测定[6]:茚三酮法测定。
1.3.3.5 保护酶活性变化[6]:超氧化物歧化酶 S0D用愈创木酚法测定。
1.3.3.6 可溶性糖含量的测定[5]:蒽酮比色法。
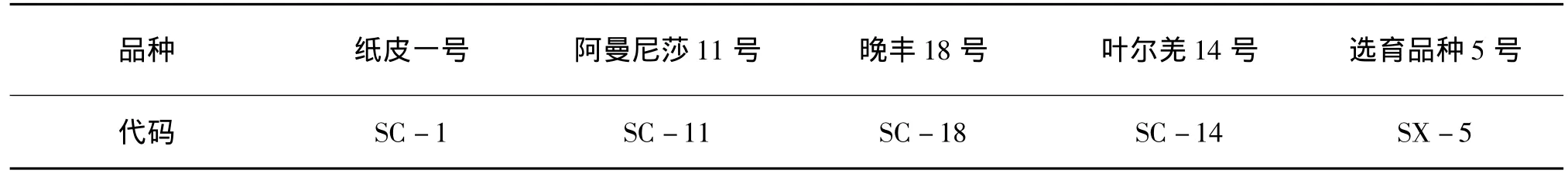
表1 扁桃不同品种代码
1.4 数据统计与分析
数据统计及图表制作用 Microsoft Excel,结果分析用DPS统计软件处理。
2 结果与分析
2.1 低温处理对不同品种扁桃枝条恢复生长的影响
树木受冻害后,枝条恢复生长是评价其受冻害程度最直观方法,能够客观反映品种的实际抗寒能力。该方法已在仁用杏[7]、野生扁桃[8]等植物的抗寒性研究中得到证实。不同扁桃品种经不同低温处理后,其萌芽率有明显的差异(见表2、图1)。随着处理温度的降低,枝条萌芽率随之降低,而抗寒性较强的品种,其枝条的恢复生长能力较强,从表2可以看出,当温度达-35℃时,5种扁桃供试材料中,SC-11枝条萌芽最高为13%,其次是SC-14枝条萌芽为2%。

表2 不同低温条件下不同品种扁桃枝条的萌芽率

图1 低温处理对扁桃品种枝条恢复生长情况
2.2 低温处理对扁桃枝条电解质外渗率的影响
细胞膜的破坏程度可以通过细胞内电解质外渗率的的大小来反映,抗寒性强的品种,其电解质渗出率相对较低。由图2可以看出,不同扁桃品种的枝条经低温处理后,其电解质外渗率随处理温度的降低总体呈上升趋势。说明随着温度的降低对细胞膜的伤害逐渐增大,细胞内可溶性物质大量外渗膜透性增加。随着温度的降低,5个扁桃品种休眠枝的解质外渗率变化均为从-15℃降至-30℃增加较缓慢,温度降至-35℃时达到高峰,此时SC-1和SC-18电解质渗出率达到了61.75%和60.56%。在整个过程中,SC-11的电解质渗出率均为最小,SC-14其次,表明这两品种抗寒性相对较强。综上可推测5个扁桃品种抗寒性表现为 SC-11>SC-14>SX-5>SC-18>SC-1,这与枝条萌芽率结果基本相符。
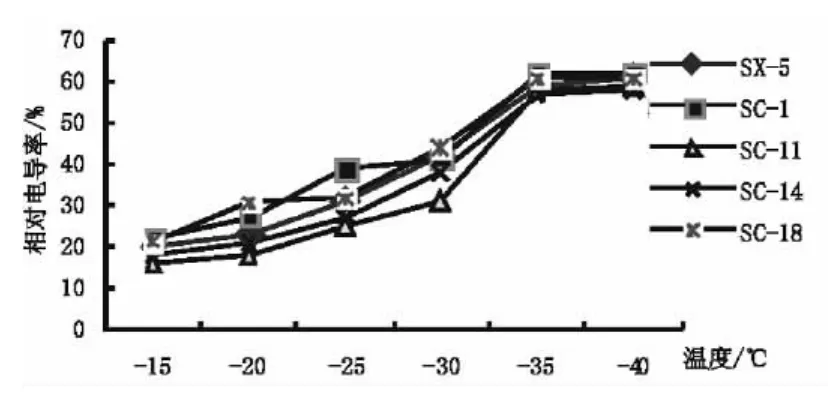
图2 低温对不同品种扁桃枝条相对电导率的影响
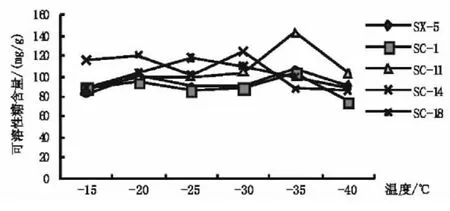
图3 温度处理过程中不同品种扁桃枝条可溶性糖的变化
2.3 低温处理对扁桃可溶性糖含量的影响
研究表明,可溶性糖含量与植物抗寒性间存在一定的相关性[9,10]。随着低温强度的增加,植物细胞内大分子物质可通过水解转化为糖,糖可通过提高细胞的渗透浓度。同时,糖还对原生质体、线粒体及膜上敏感偶联因子均有保护作用,从而在一定程度上提高了植物的抗寒性[7]。从图3可以看出,不同低温处理对不同扁桃品种休眠枝可溶性糖含量的影响不同。随着处理温度的降低,5个扁桃品种枝条中可溶性糖含量的变化总体呈先升高后下降的趋势,但不同品种达到最大值的温度不同,-25℃时,SC-18可溶性糖含量达到最大值,为 118.03 mg/g;-30℃时,SC-14可溶性糖含量达到最大值,为124.48 mg/g;-35℃时SC-11可溶性糖含量达到最大值,为142.23 mg/g,表明抗寒性弱的品种可溶性糖含量峰值出现早于抗寒性强的品种,而整个过程中SC-1、SX-5可溶性糖含量均保持相对较低的水平,说明其抗寒性相对较差。
2.4 低温处理对扁桃枝条脯氨酸含量的影响
脯氨酸是植物在逆境协迫下的一种重要的渗透调节物质。研究表明,脯氨酸含量高的品种抗寒性较强,反之较弱[11]。从图4中可以看出,在休眠枝条中随处理温度的降低脯氨酸含量呈先上升后下降的趋势,在整个过程中SC-14及SC-11两个品种中脯氨酸含量相对最高,分别从最初的839.74 μg/g和671,47 μg/g至最大值 2 418.27 μg/g和2 370.19μg/g,分别比最初增加了2.88倍和3.53倍,说明其枝条对低温的适应较好。而SC-1增幅最小,由最初的615.38μg/g增至1 280.45μg/g,比最初增加了2.08倍,并且在这个过程中脯氨酸含量相对较低。

图4 不同温度对不同品种扁桃枝条脯胺酸含量的影响

图5 不同温度处理对不同品种扁桃枝条两二醛含量的影响
2.5 低温处理对扁桃枝条丙二醛(MDA)含量的影响
从图5可知,在降温过程中供试的5个扁桃品种休眠枝的丙二醛(MDA)含量的变化趋势与枝条的相对电导率的变化趋势基本相似,随处理温度的降低总体呈上升趋势。在整个低温处理过程中SC-11、SC-14的MDA含量相对最小,当温度为-35℃时 MDA含量分别为0.443 3 mmol/L和0.455 9mmol/L,而SC-1在整个低温处理过程中都保持相对较高的MDA含量,当温度为-35℃时MDA含量为0.561 2 mmol/L。当植物受到冻害后引发和加剧了膜脂过氧化作用,造成膜脂过氧化产物MDA增多,而其在组织中含量的多少反映了植物细胞受伤害的程度。MDA含量高说明植物的抗寒性弱,反之,则抗寒性强。因此,由图5可推知整个过程中供试扁桃的抗寒表现为SC-11>SC-14>SC-18> SX-5>SC-1。
2.6 低温处理对扁桃枝条SOD含量的的影响
SOD酶是清除超氧阴离子自由基的重要酶类,可有效清除因环境胁迫而累积的生物自由基,在保护生物免遭逆境伤害方面具有重要作用,SOD酶活性的大小和超氧阴离子自由基产生速率都可以表示植物抗寒过程中的生理状况[12,13]。SOD 酶活性强的品种抗寒性较强[14,15]。从图6可以看出,从总体变化趋势来看,5个扁桃品种的SOD酶活性随处理温度的降低明显呈先升后降的趋势,在-30℃时达到最大。而SC-11及SC-14在整个低温过程中SOD酶都保持相对较高的活性,SX-5品种的SOD酶活性最低。
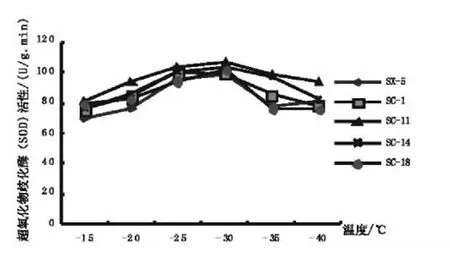
图6 低温处理过程中扁桃枝条SOD酶活性的变化

图7 低温处理过程中不同品种扁桃枝条可溶性蛋白含量的变化
2.7 低温处理对扁桃可溶性蛋白含量的影响
可溶性蛋白作为渗透调节物质、能量物质和信息传递物质在植物的抵御逆境的过程中起到较大的作用[13]。有研究表明,遭受低温胁迫的植物,体内可溶性蛋白含量会增加,且细胞内可溶性蛋白和抗寒冻性之间表现出明显的相关性[16,17]。从图7可以看出,随着处理温度的降低,5个扁桃品种可溶性蛋白含量都有一个先上升后下降的变化趋势,其中,SC-1、SC-14、SX-5在-30℃时可溶性蛋白含量达到最大,分别为 3.04 mg/g、3.01 mg/g、2.81 mg/g,而SC-11、SC-18在-35℃时可溶性蛋白含量达到最大,分别为3.69 mg/g、3.29 mg/g,表明抗寒性弱的品种可溶性蛋白含量峰值的出现早于抗寒性强的品种。
3 结论
本研究通过对低温处理后休眠枝条的萌芽率及相对电导率、丙二醛(MDA)含量、脯氨酸(Pro)含量、可溶性蛋白含量、可溶性糖含量、超氧化物歧化酶(SOD)的活性7个生理生化指标的综合分析,得出5个供试扁桃品种的抗寒性顺序为SC-11>SC-14>SC-18>SX-5>SC-1。
在关于果树抗寒性的研究过程中,细胞膜膜透性、渗透调节物质、抗氧化酶都被用作抗寒性的鉴定指标[18,19,20],然而植物的抗寒性受多种因素影响,孤立地用单一的生理指标很难反映植物的抗寒的实质,也不利于揭示植物抗寒的本质。而在本研究中,5个扁桃品种依据不同测定指标所得抗寒性排序结果也存在着一定的差异,因此,为了服单一指标对扁桃抗寒性鉴定的不足,必须通过综合评价方法对本试验测定的生理生化指标进行综合分析,进一步确定了各测定指标对抗寒性的贡献,并探讨抗寒性鉴定的方法和模型,以期获得新疆莎车县扁桃品种抗寒性鉴定的有效方法,为该地区主栽扁桃种质资源评价和扁桃品种的引种提供依据。
[1] Kester D E,Gradziel T M.Almonds[R].Fruit Breeding,Volume Ⅲ,1996.
[2] 成建红,侯平,李疆,等.巴旦杏的产业发展及其研究进展[J].干旱区研究,2000,17(1):32 -38.
[3] 李疆,胡芳名,李文胜,等.扁桃的栽培及研究概况[J].果树学报,2002,19(5):346 -350.
[4] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[5] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[6] 高俊风.植物生理学实验技术[M].世界图书出版公司,2000.
[7] 郑元,杨途熙,魏安智,等.低温胁迫对仁用杏几个抗寒生理指标的影响.西北农林科技大学学报(自然科学版,2008,36(1):163 -167.
[8] 魏钰,郭春会,张国庆,等.我国几个扁桃种抗寒性的研究[J].西北农林科技大学学报[自然科学版],2012,40(6):99-105.
[9] 王飞,陈登文,王卿,等.杏品种的需寒量与抗寒性的相关研究[J].中国农业科学,2001,34(5):465 -468.
[10] 张婷,车凤斌,潘俨,等.低温胁迫对核桃枝条几个抗寒生理指标的影响[J].新疆农业科学,2011,48(8):1428-1433.
[11] Arbaoui M,Balko C,Link W.Study of faba bean(Vicia faba L.)winter 2 hardiness and development of screening methods[J].field Crops Research,2008,106:60 -67.
[12] 杨向娜,魏安智,杨途熙.仁用杏3个生理指标与抗寒性的关系研究[J].西北林学院学报,2006,21(3):30-33.
[13] 李捷,王有科.不同杏品种花的抗寒性研究[J].北方园艺,2009(8):47-50.
[14] 李捷,王有科.四个杏品种抗寒性的比较研究[J].甘肃农业大学学报,2010(1):37-40.
[15] 黄永红,沈洪波,陈学森.杏树抗寒生理研究初报[J].山东农业大学学报(自然科学版),2005,35(2):191-195.
[16] WallisF G,Wang H,Guerra D J.Expression ofa synthetic an-tifreeze protein in potato reduces electrolyte release at freezing temperatures[J].PlantMolecular Biology,1997,35(3):323 -330.
[17] 王飞,陈登文,王卿,等.杏品种的需寒量与抗寒性的相关研究[J].中国农业科学,2001,34(5):465-468.
[18] 潘晓云,王根轩,曹琴东.兰州地区引种的美国扁桃的越冬伤害与临界致死低温[J].园艺学报,2002,29(1):63-65.
[19] 蒋宝,郭春会,梅立新,等.沙地植物长柄扁桃抗寒性的研究[J].西北农林科技大学学报:自然科学版,2008,36(5):92 -96,102.
[20] 龚鹏,李秀霞,李增萍,等.低温胁迫对扁桃枝条细胞膜系统和渗透调节物质的影响[J].新疆农业科学,2007,44(5):561 -566.
