耐盐氨基甲酸乙酯水解酶的分离纯化及酶学性质
2014-06-19卜攀攀陈坚堵国成
卜攀攀,陈坚,堵国成
江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
氨基甲酸乙酯 (Ethyl carbamate, EC) 早在1943年就被发现是一种致癌物质[1-2]。自从1971年Lofroth等[3]在发酵食品中发现了氨基甲酸乙酯的存在以后,许多学者又先后在酱油、面包、蒸馏酒、白兰地和威士忌等发酵食品与饮料中检测到了氨基甲酸乙酯[4-8]。目前食品中氨基甲酸乙酯的危害已被认为是继黄曲霉毒素之后的又一重要食品安全问题[8]。
氨基甲酸乙酯在食品发酵和长期的贮藏过程中均可产生[9-10]。目前,人们主要是通过选育优良菌株、控制发酵条件和向完成的发酵食品中添加脲酶[11-13]来控制氨基甲酸乙酯的形成。但是,由于氨基甲酸乙酯的化学性质比较稳定,一旦形成就很难被降解,以致于氨基甲酸乙酯会在发酵食品中不断地增加和积累。20世纪八九十年代,国外报道了一些关于氨基甲酸乙酯水解酶的研究[14-17],氨基甲酸乙酯水解酶能将一分子的氨基甲酸乙酯水解为一分子的氨、二氧化碳和乙醇。但是,不同氨基甲酸乙酯水解酶的适宜工作环境不同,而且发酵食品的成分复杂,以致合适的氨基甲酸乙酯水解酶还未得到开发。于是,研究氨基甲酸乙酯水解酶的性质对其在实际生产中的应用有着十分重要的参考意义。
我们已从小鼠的胃部分离获得了一株产氨基甲酸乙酯水解酶的肺炎克雷伯氏菌。超声破碎后的粗酶液有良好的NaCl耐受特性,对于高盐的酱油类发酵食品中氨基甲酸乙酯的消除有很高的参考价值。本研究利用硫酸铵沉淀、HiTrap Q FF和 Mono Q离子交换层析及Superdex 200 prep grade凝胶过滤层析实现了肺炎克雷伯氏菌氨基甲酸乙酯水解酶的分离纯化,并研究了该酶的理化性质。
1 材料与方法
1.1 材料
产氨基甲酸乙酯水解酶的肺炎克雷伯氏菌由本实验室从小鼠的胃部分离筛选得到。HiTrap Q FF柱、Mono Q柱和Superdex 200 prep grade柱为GE公司产品。氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸丁酯、乙酰胺、谷氨酰胺、苯甲酰胺购自Sigma-Aldrich公司。
终止剂:10 g三氯乙酸,超纯水定容至100 mL。
显色剂Ⅰ:15 g苯酚,0.625 g亚硝基铁氰化钠,超纯水定容至250 mL。
显色剂Ⅱ:13.125 g 氢氧化钠,7.5 mL 次氯酸钠,超纯水定容至250 mL。
1.2 方法
1.2.1 肺炎克雷伯氏菌氨基甲酸乙酯水解酶的分离纯化
1) 粗酶液制备:接种适量的肺炎克雷伯氏菌于营养肉汤培养基中,37 ℃、200 r/min培养12 h。 发酵培养物 4 ℃、 8 000 r/min 离心 20 min,收集菌体。在 20 mmol/L的磷酸盐缓冲溶液(pH 7.0) 中重悬,置于冰水浴中超声1 s,间歇1 s,25 W破碎20 min,4 ℃、10 000 r/min离心30 min,收集上清。
2) 硫酸铵沉淀:将粗酶液在冰浴中边搅拌边缓慢加入硫酸铵粉末至一定饱和度,4 ℃静止4 h,10 000 r/min离心20 min收集30%−60%饱和度的沉淀,重新溶于20 mmol/L的磷酸盐缓冲溶液 (pH 7.0) 中,并用相同的缓冲溶液彻底透析脱盐。
3) 离子交换层析:将上述经透析脱盐后的粗酶液,高速离心收集上清液。加到已用20 mmol/L的磷酸盐缓冲溶液 (pH 7.0) 平衡的HiTrap Q FF阴离子交换柱上,0−1 mol/L的NaCl阶段洗脱,收集有酶活性的部分。然后将收集的粗酶液透析脱盐后加入到预先用20 mmol/L的磷酸盐缓冲溶液 (pH 7.0) 平衡的Mono Q阴离子交换柱上,用0−1 mol/L的NaCl线性梯度洗脱,收集有酶活性的部分。
4) 凝胶过滤层析:Superdex 200 prep grade凝胶柱预先用 20 mmol/L的磷酸盐缓冲溶液(pH 7.0) 平衡。将上述收集的粗酶液上柱,并用相同的缓冲溶液洗脱,收集有酶活性的部分。
1.2.2 蛋白质浓度的测定
以牛蛋白血清为标准蛋白,用 Bradford法测定蛋白质含量[18]。
1.2.3 氨基甲酸乙酯水解酶酶力的测定
采用靛酚蓝反应法[19]。在 0.2 mL 含 3%(W/V) 氨基甲酸乙酯的20 mmol/L 磷酸缓冲液(pH 7.0) 中加入0.2 mL 经过适当稀释的酶液,于55 ℃温育15 min,加入0.2 mL终止剂终止反应,8 000 r/min 离心1 min后取上清,然后依次加入0.2 mL显色剂Ⅰ、0.2 mL显色剂Ⅱ,摇匀,37 ℃水浴保持1 h。在波长625 nm下测定吸光度,计算酶活。实验条件下,每分钟分解底物产生 1 mmol/L NH4+所需要的酶量为一个活力单位 (U)。
1.2.4 SDS-PAGE分析
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳用于分析蛋白质的分子量,分离胶浓度为 12%,染色使用考马斯亮蓝R-250[20]。
1.2.5 酶学性质
1) 酶的最适反应温度及热稳定性:在20 mmol/L (pH 7.0) 磷酸缓冲液中,酶分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃和 70 ℃不同温度下测定酶活,考察酶的最适反应温度。将酶在37 ℃、45 ℃和55 ℃下保温0 min、30 min、60 min、90 min和120 min后检测残余酶活力,考察酶的温度稳定性。
2) 酶的最适反应pH:分别在柠檬酸盐缓冲液 (pH 4.0–6.0)、磷酸盐缓冲液 (pH 7.0)、硼酸盐缓冲液 (pH 8.0)和硼酸盐-氢氧化钠缓冲液(pH 9.0–10.0)中测定酶对氨基甲酸乙酯的水解活力[15],研究酶促反应的最适pH。
3) 酶反应动力学性质:将酶液与不同浓度(50−90 mmol/L) 的氨基甲酸乙酯底物作用,测定酶反应的初速度,用Lineweaver-Burk双倒数作图法求出酶对氨基甲酸乙酯的Km值和Vmax值。
4) 酶的底物特异性:将酶液与3% (W/V) 的不同底物 (氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸丁酯、乙酰胺、谷氨酰胺、苯甲酰胺) 作用,测定酶活力。
5) 金属离子和化学试剂对酶活力的影响:将酶加入 1 mmol/L的不同金属离子 (Cu2+、Mg2+、Mn2+、Zn2+、Ca2+、Fe2+) 和试剂 (EDTA、DTT、SDS) 中,37 ℃保温5 min后测定残余酶活,观察金属离子和试剂对酶活力的影响。
6) 酶的乙醇耐受性:将酶液加入含 1.5%(W/V) 氨基甲酸乙酯和不同浓度 (0−30%) 乙醇的磷酸缓冲液 (pH 7.0) 中,于55 ℃温度下反应15 min后加入终止剂测定酶的活力,观察酶对乙醇的耐受性。
7) 酶的NaCl耐受性:将酶液加入含1.5%(W/V) 氨基甲酸乙酯和不同浓度 (0−18%) NaCl的磷酸缓冲液 (pH 7.0) 中,于55 ℃温度下反应15 min后加入终止剂测定酶的活力,观察酶对NaCl的耐受性。
2 结果与分析
2.1 肺炎克雷伯氏菌氨基甲酸乙酯水解酶的分离和纯化
肺炎克雷伯氏菌氨基甲酸乙酯水解酶粗酶液经过上述一系列纯化操作,分离纯化结果见表1,肺炎克雷伯氏菌氨基甲酸乙酯水解酶从粗酶液到最后的纯化产物回收率为 19%,纯化后的酶活力为 351.222 U/mg。SDS-PAGE凝胶电泳 (图1) 显示纯化后的肺炎克雷伯氏菌氨基甲酸乙酯水解酶为单一条带,分子量大小约为55 kDa。
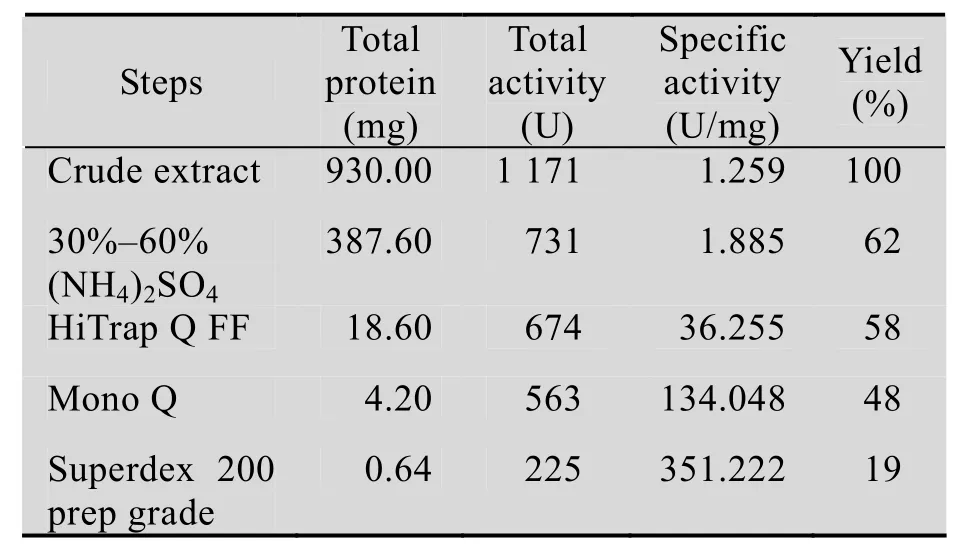
表1 肺炎克雷伯氏菌氨基甲酸乙酯水解酶的纯化Table 1 Purification of urethanase from Klebsiella pneumoniae

图 1 肺炎克雷伯氏菌氨基甲酸乙酯水解酶纯酶的SDS-PAGE凝胶电泳图Fig. 1 SDS-PAGE analysis of purified urethanase from Klebsiella pneumoniae. M: protein marker; 1:purified urethanase.
2.2 酶的最适温度和热稳定性
酶在不同温度下反应的酶活见图2,该酶的最适反应温度为55 ℃左右,温度超过60 ℃后酶活急剧下降。将酶置于37 ℃、45 ℃和55 ℃放置并取样测量酶的剩余活力,结果见图3。酶在37 ℃保温120 min后酶活保持70%,45 ℃下保温120 min后酶活下降至45%,而当温度升至55 ℃时保温120 min后酶活力降至7%,几乎完全失活,表明该酶对热较敏感。

图 2 温度对肺炎克雷伯氏菌氨基甲酸乙酯水解酶活力的影响Fig. 2 Effects of temperature on the activity of urethanase from Klebsiella pneumoniae.

图 3 肺炎克雷伯氏菌氨基甲酸乙酯水解酶的热稳定性Fig. 3 Thermostability of urethanase from Klebsiella pneumoniae.
2.3 酶的最适反应pH
实验结果表明 (图4),肺炎克雷伯氏菌氨基甲酸乙酯水解酶催化水解反应的最适pH为7.0,当反应pH 从6.0升到7.0,酶活上升比较快,而当pH 超过8.0后,酶活迅速下降,表明该酶
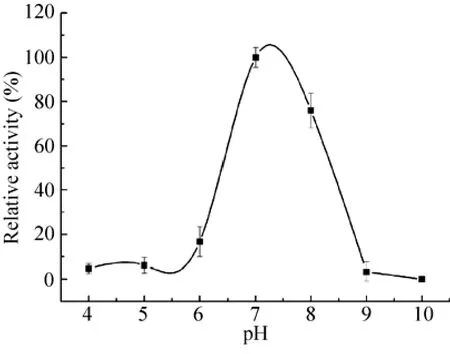
图4 pH对肺炎克雷伯氏菌氨基甲酸乙酯水解酶的影响Fig. 4 Effects of pH on the activity of urethanase from Klebsiella pneumoniae.
对酸碱环境较敏感。
2.4 酶反应动力学性质
分别以浓度50 mmol/L、60 mmol/L、70 mmol/L、80 mmol/L和90 mmol/L的氨基甲酸乙酯为底物,测定底物反应速率,用Lineweaver-Burk双倒数作图法,求得Km值为 74 mmol/L,Vmax为0.307 mmol/(min·mg protein) (图 5)。
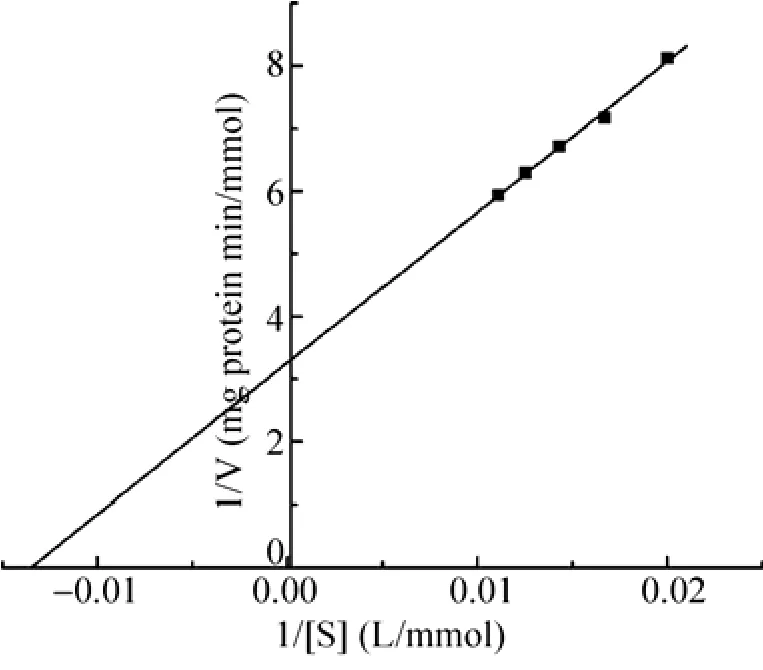
图 5 肺炎克雷伯氏菌氨基甲酸乙酯水解酶水解氨基甲酸乙酯的Lineweaver-Burk图Fig. 5 Lineweaver-Burk plot of purified urethanase from Klebsiella pneumoniae.
2.5 酶的底物特异性
分别以1.5% (W/V) 的氨基甲酸甲酯、氨基甲酸乙酯、氨基甲酸丁酯、乙酰胺、谷氨酰胺、苯甲酰胺、尿素为底物,测定NH4+的生成速度,结果如表 2所示。该酶能水解氨基甲酸酯类化合物和乙酰胺,而其中对氨基甲酸乙酯的作用是其他物质的数十倍。表明该酶对氨基甲酸乙酯作用特异性较强。
2.6 金属离子和化学试剂对酶活力的影响
从表 3结果可知,实验中所选用金属离子对酶催化活力均有不同程度的影响,其中Cu2+、Zn2+对酶活有较强的抑制作用,Mg2+有微弱的抑制作用,而Mn2+、Ca2+、Fe2+有微弱的激活作用;EDTA和DTT对酶活力有很强的激活作用,SDS也有微弱的激活作用。

表 2 肺炎克雷伯氏菌氨基甲酸乙酯水解酶的底物特异性Table 2 Substrate specificity of urethanase from Klebsiella pneumoniae
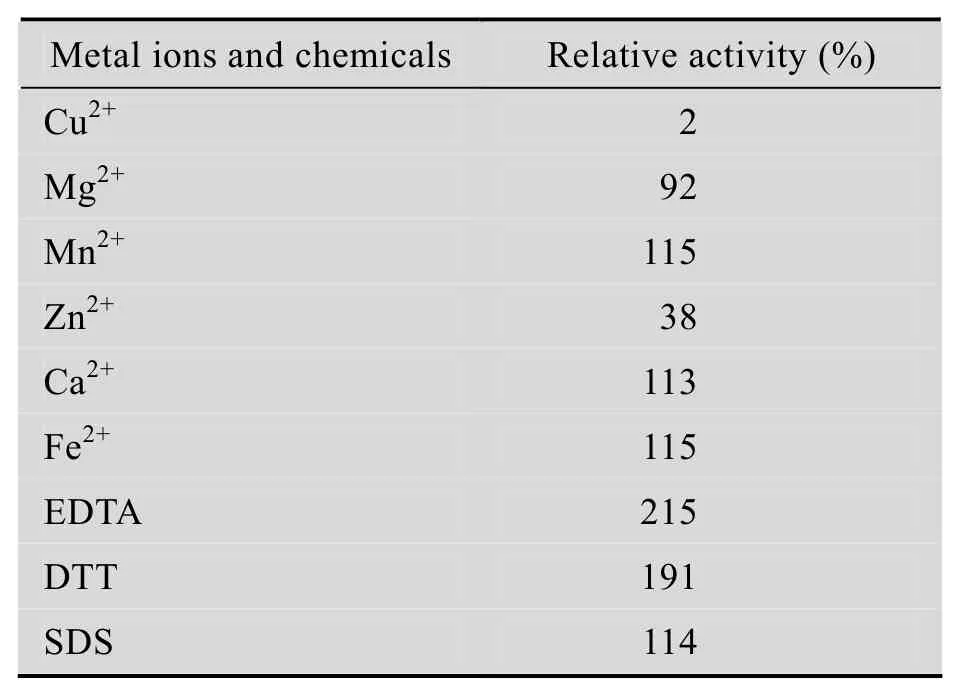
表 3 金属离子和化学试剂对肺炎克雷伯氏菌氨基甲酸乙酯水解酶的影响Table 3 Effects of metal ions and chemicals on the activity of urethanase from Klebsiella pneumoniae
2.7 酶的乙醇耐受性
分别测定酶在 0−30% (V/V) 的乙醇环境中的活力,结果见图6。10%的乙醇环境下酶活保持在20%,20%的乙醇环境下酶活已不足10%,而当环境的乙醇含量升至 30%后该酶活力几乎完全丧失,与已报道过的氨基甲酸乙酯水解酶[15,17,21]相比,该酶只能耐受低浓度的乙醇。
2.8 酶的NaCl耐受性
酶在0−18% (W/V) 的NaCl环境中的活力见图7。酶在0−3%的NaCl低盐溶液中酶活有所上升;NaCl浓度高于3%后,随着NaCl浓度的增加,酶活逐渐下降。当NaCl浓度高达18%时,仍能保留 40%的酶活。该酶对 NaCl耐受性较强。
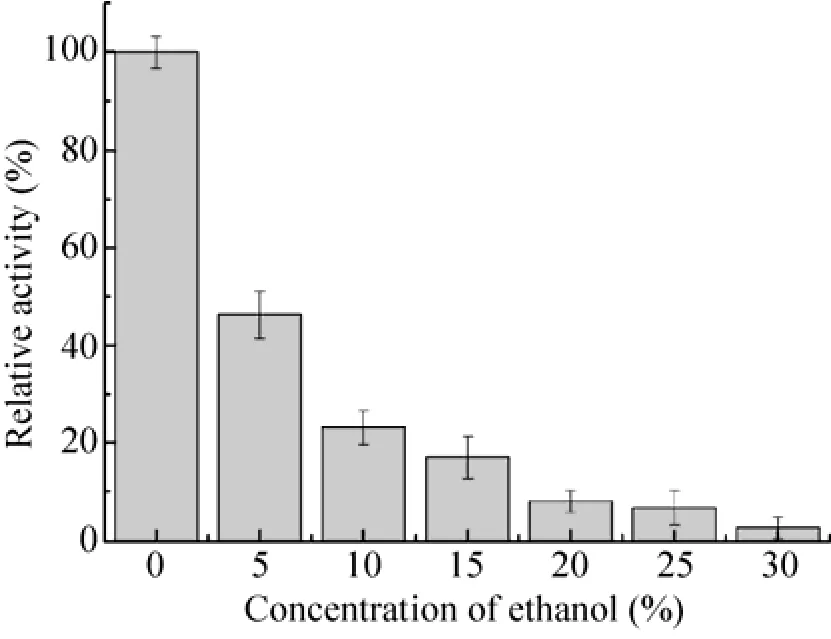
图 6 乙醇浓度对肺炎克雷伯氏菌氨基甲酸乙酯的影响Fig. 6 Effects of ethanol concentration on the activity of urethanase from Klebsiella pneumoniae.
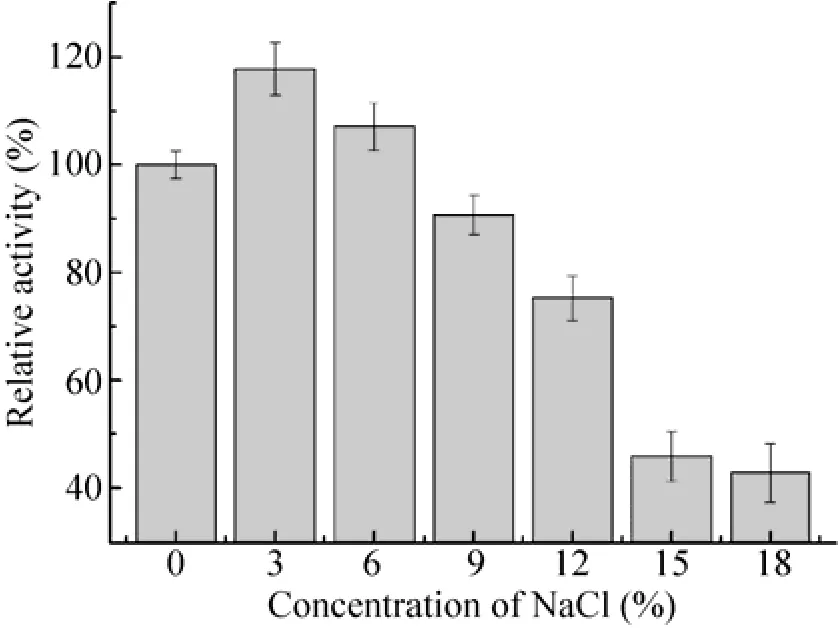
图7 NaCl浓度对肺炎克雷伯氏菌氨基甲酸乙酯水解酶的影响Fig. 7 Effects of NaCl concentration on the activity of urethanase from Klebsiella pneumoniae.
3 讨论
氨基甲酸乙酯水解酶已在多种微生物中发现并研究,本文首次从肺炎克雷伯氏菌中分离获得一种氨基甲酸乙酯水解酶并对其酶学性质进行了研究。研究发现:这种酶在55 ℃下短时间作用的活力较高,但稳定性不佳;在一定的低盐环境中酶的活力会有一定的上升趋势,超出一定范围后酶活力逐渐下降;另外,低浓度的表面活性剂SDS的添加会让酶的活力有略微的提高。这些现象都可以说明:酶的部分结构的变化对酶活性提高有促进作用。目前尚未报道过氨基甲酸乙酯水解酶的结构,对于这种现象还有赖于酶的具体结构解析的证实。
与之前发现的氨基甲酸乙酯水解酶[15,17,21]相比,这种氨基甲酸乙酯水解酶对氨基甲酸酯类化合物的水解有特异性,对氨基甲酸乙酯有较高的底物专一性和作用活力。
另外,之前的文献报道均是致力于氨基甲酸乙酯水解酶的乙醇耐受性[15,17,21]的考察,而对其NaCl耐受性尚未见报道。本研究除对此氨基甲酸乙酯水解酶的乙醇耐受性作了研究,还首次考察了氨基甲酸乙酯水解酶的NaCl耐受性。研究发现该酶能耐受低浓度的乙醇和高浓度的NaCl。由于该酶来源于非食品安全级微生物,所以此酶不适宜在酒精饮料和酱油中直接添加应用。酱油中的食盐浓度一般在 18%左右,而在 18%的高盐溶液中酶能保持 40%的活力,具有良好的耐盐特性。因此,经过对其蛋白序列解析后能为今后氨基甲酸乙酯水解酶的耐盐特性改造和酱油中氨基甲酸乙酯的消除提供十分重要的参考。
[1]Nettleship A, Henshaw PS, Meyer HL. Induction of pulmonary tumors in mice with ethyl carbamate(urethane). J Natl Cancer I, 1943, 4(3): 309–319.
[2]Weber JV, Sharypov VI. Ethyl carbamate in foods and beverages: a review. Environ Chem Lett, 2009,7(3): 233–247.
[3]Lofroth G, Gejivall T. Diethyl pyrocarbonate:Formation of urethane in treated beverages.Science, 1971, 174(15): 139–144.
[4]Shi WN, Liu XY, Zhao YQ, et al. Residue level of ethyl carbamate in fermented foods. China Brewing, 2009, 11(212): 124–126 (in Chinese).
石维妮, 刘晓毅, 赵玉琪, 等. 发酵性食品中的氨基甲酸乙酯含量调研. 中国酿造, 2009,11(212): 124–126.
[5]Lee KG. Analysis and risk assessment of ethyl carbamate in various fermented foods. Eur Food Res Technol, 2013, 236(5): 891–898.
[6]Jagerdeo E, Dugar S, Foster G, et al. Analysis of ethyl carbamate in wines using solid-phase extraction and multidimensional gas chromatography/mass spectrometry. J Agric Food Chem, 2002, 50(21): 5797–5802.
[7]Schmeltz I, Chiong KG, Hoffmann DJ. Fomation and determination of ethyl carbamate in tobacco and tobacco smoke. J Anal Toxicol, 1978, 2(6):265–268.
[8]Wu SJ, Wang HX. Research advancement of ethyl carbamate in fermented food. Chem Bioeng, 2009,26(9): 15–19 (in Chinese).
吴世嘉, 王洪新. 发酵食品中氨基甲酸乙酯的研究进展. 化学与生物工程, 2009, 26(9): 15–19.
[9]Riffkin HL, Wilson R, Howie D, et al. Ethyl carbamate formation in the production of pot still whisky. J I Brewing, 1989, 95(2): 115–119.
[10]Monteiro FF, Trousdale EK, Bisson LF. Ethyl carbamate formation in wine: use of radioactively labeled precursors to demonstrate the involvement of urea. Am J Enol Viticult, 1989, 40(1): 1–8.
[11]Bao JH. The changes and research of ethyl carbamate in the wine [D]. Tianjin: Tianjin University of Science and Technology, 2008 (in Chinese).
宝菊花. 氨基甲酸乙酯在葡萄酒中的含量的变化及研究[D]. 天津: 天津科技大学, 2008.
[12]Chen K. Qantification and accumulation conditions of ethyl carbamate in soy sauce [D]. Wuxi:Jiangnan University, 2012 (in Chinese).
陈可. 酱油中氨基甲酸乙酯的定量分析[D]. 无锡: 江南大学, 2012.
[13]Zhao XR, Du GC, Zou HJ, et al. Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages. Trends Food Sci Tech, 2013,32(2): 97–107.
[14]Zhao CJ, Kobashi K. Urethanase in rat tissues. J Toxicol Environ Health, 1992, 37(1): 37–45.
[15]Mohapatra B, Bapuji M. Characterization of urethanase fromMicrococcusspecies associated with the marine sponge (Spirasfrellaspecies). Lett Appl Microbiol, 1997, 25(6): 393–396.
[16]Zhao CJ, Imamura L, Kobashi K. Urethanase ofBacillus licheniformissp. isolated from mouse gastrointestine. Chem Pharm Bull, 1991, 39(12):3303–3306.
[17]Kobashi K, Takebe S, Sakai T.Urethane-hydrolyzing enzyme fromCitrobactersp.. Chem Pharm Bull, 1990, 38(5): 1326–1328.
[18]Shu ZY, Yan JK, Yan YJ. Purification and characterization of a lipase fromAspergillus nigerF044. Chin J Biotech, 2007, 23(1): 96–100 (in Chinese).
舒正玉, 杨江科, 闫云君. 黑曲霉F044脂肪酶的分离纯化及酶学性质研究. 生物工程学报, 2007,23(1): 96–100.
[19]Scheiner D. Determination of ammonia and Kjeldahl nitrogen by indophenol method. Water Res, 1976, 10(1): 31–36.
[20]Wang JZ, Fan M. Protein Technical Manual.Beijing: Science Press, 2000: 77–124 (in Chinese).
汪家政, 范明. 蛋白质技术手册. 北京: 科学出版社, 2000: 77–124.
[21]Zhao CJ, Kobashi K. Purification and characterization of iron-containing urethanase fromBacillus licheniformis. Biol Pharm Bull, 1994,17(6): 773–778.
