改良冠状动脉介入技术建立猪冠状动脉微栓塞动物模型*
2014-06-15马国添曾志羽罗晨源林士云
马国添 曾志羽 吴 海△ 罗晨源 林士云
改良冠状动脉介入技术建立猪冠状动脉微栓塞动物模型*
马国添1曾志羽1吴 海1△罗晨源2林士云1
目的 探讨建立简便又经济的小型猪冠状动脉微栓塞(CME)模型的技术。方法将11只小型猪随机分为对照组5只和CME组6只。采用21号桡动脉穿刺针穿刺股动脉,5 F造影管及1.8 F微导管往CME组左前降支注入栓塞微球。检测栓塞前及栓塞6 h后血清脑利钠肽(BNP)及心肌肌钙蛋白I(cTnI)水平。栓塞6 h后取心尖部心肌光镜下观察。结果对照组5只全部存活,CME组1只死亡。5 F造影管及1.8 F微导管可顺利到位。微栓塞前CME组与对照组血清BNP(ng/L:143.00±13.51 vs 134.00±15.57)及cTnI水平(μg/L:0.39±0.09 vs 0.38±0.10)差异无统计学意义(t分别为0.976、0.294,均P>0.05)。微栓塞后CME组血清BNP(561.00±80.65)及cTnI水平(2.75±0.58)均高于对照组(BNP、cTnI分别为139.00±13.87、0.54±0.14),差异有统计学意义(t分别为11.530、8.337,均P<0.001)。光镜下CME组心肌可见栓塞微球、微梗死、炎症细胞浸润。结论利用新的手术耗材可以成功建立小型猪CME模型,该技术简便、经济、实用,值得推广。
冠状动脉微栓塞;血管内操作;动物模型;小型猪
冠状动脉微栓塞(coronary microembolization, CME)是指由于血小板聚集,动脉粥样硬化碎片和血管收缩物质引起破裂斑块远端微血管闭塞。Otto等[1]报道冠心病合并糖尿病患者行经皮冠状动脉介入治疗,如果发生CME,除了观察到术后24 h心肌肌钙蛋白I(cTnI)达到峰值,术后2年的主要心脏不良事件也明显增加。因此,利用某些动物模型开展CME的基础研究很有必要。此前,Ma等[2]已成功建立小型猪的CME模型,随着介入治疗耗材的革新,笔者对造模方法进行改良,以实现简便、经济、有效地建立CME模型。
1 材料与方法
1.1 实验动物及分组 广西巴马小型猪11只(许可证号:SCXK桂2007-0003),雌雄不拘,体质量25~30 kg,45~55周龄,由广西大学动物科学技术学院提供。采用随机数表法将将11只小型猪分为对照组5只和CME组6只。
1.2 主要试剂 栓塞剂:Embosphere三丙烯栓塞微球(规格40~120 μm,美国Biosphere Medical公司生产)。猪脑利钠肽(BNP)-26 RIA Kit为瑞士Bachem公司产品。猪cTnI酶联免疫吸附检测(ELISA)Kit为美国Innovative Research公司产品。
1.3 建立CME动物模型 小型猪肌内注射氯胺酮和阿托品诱导麻醉后,穿刺耳大静脉给予戊巴比妥钠静脉滴注维持麻醉,偶有躁动不安时静脉注射地西泮。腹股沟皮皱下方1 cm,缝匠肌与股薄肌之间陷窝局部浸润麻醉,切开皮肤,皮下组织,在两块肌肉之间钝性分离,暴露股神经、股静脉,在搏动最明显处用21号Cordis桡动脉穿刺针穿刺,成功后置入6 F桡动脉鞘。给予肝素200 U/kg以达到肝素化,此后每延长1 h静脉注射肝素100 U/kg维持肝素化。然后用移动式C形臂X射线机(HMC-36型)行冠脉造影。用5 F Radial TIG造影管或者5 F JR4.0造影管进入冠状动脉左主干开口,随之送入Finecross微导管(1.8 F,Terumo公司)至冠状动脉左前降支(LAD)分出第一对角支的远端;必要时先送入Runrough NS导丝(Terumo公司)至LAD,再送入微导管。微导管到位后,将造影管退出左主干开口。Embosphere栓塞微球10万个,混悬于20 mL生理盐水,通过微导管注入CME组小型猪LAD,20 min注射完毕,对照组注入等量生理盐水。术中心电监护及听诊,及时处理室速、室颤及急性左心衰。因手术时间40~60 min,故无需呼吸机支持。
1.4 血清BNP及cTnI检测 造模前及造模后6 h,均采取动脉血10 mL,全血静置30 min后,1 800 r/min离心15 min,分离血清置-80℃冰箱保存。放射免疫分析方法检测猪血清BNP水平;ELISA法检测猪血清cTnI水平。
1.5 光镜下心肌组织病理改变 造模后6 h,取被处死小型猪左心室心尖部心肌,4%多聚甲醛固定24 h,HE染色后光镜下观察。
1.6 统计学方法 采用SPSS 13.0统计软件,符合正态分布的计量资料以±s表示,2组间比较用独立样本t检验,组内前后比较用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CME模型建立情况 对照组5只全部存活,CME组1只在造模过程中因为造影管嵌顿在右冠状动脉导致猝死。用5 F Radial TIG造影管或者5 F JR4.0造影管结合1.8 F Finecross微导管,可以顺利到位,见图1、2。

Figure 1 Coronary angiography of left coronary artery by 5 F Radial TIG catheter.图1 5 F Radial TIG造影管左冠脉造影

Figure 2 Coronary angiography of the mid to distal part of LAD by 1.8 F Finecross microcatheter.图2 1.8 F微导管左前降支中远段造影
2.2 微栓塞前、后血清BNP及cTnI的变化 微栓塞前2组血清BNP及cTnI水平差异无统计学意义(P>0.05)。微栓塞6 h后CME组血清BNP及cTnI水平均高于对照组(均P<0.001)。对照组微栓塞前、后血清BNP及cTnI水平差异无统计学意义(P>0.05),CME组微栓塞后血清BNP及cTnI水平均高于微栓塞前(均P<0.001)。见表1。
Table 1 Changes of serum BNP and cTnI levels between pre-microembolization procedure and postmicroembolization procedure表1 微栓塞前、后血清BNP及cTnI的变化(n=5,±s)

Table 1 Changes of serum BNP and cTnI levels between pre-microembolization procedure and postmicroembolization procedure表1 微栓塞前、后血清BNP及cTnI的变化(n=5,±s)
*P<0.001
组别对照组CME组t BNP(ng/L)术前134.00±15.57 143.00±13.51 0.976术后139.00±13.87 561.00±80.65 11.530*t 0.953 10.286*组别对照组CME组t cTnI(μg/L)术前0.38±0.10 0.39±0.09 0.294术后0.54±0.14 2.75±0.58 8.337*t 2.508 10.247*
2.3 光镜下心肌组织病理改变 微栓塞6 h后,CME组心肌组织光镜下可见血管内栓塞微球,周围炎症细胞浸润,并可见心肌微梗死。见图3。
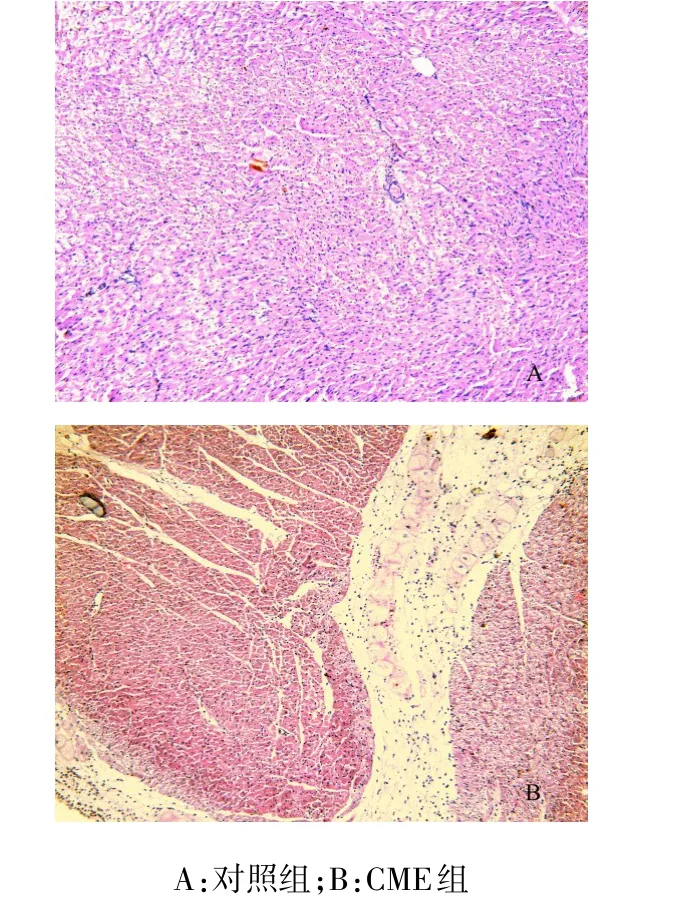
Figure 3 Pathological changes of cardiac muscle tissues 6 hours after microembolization procedure(HE×100)图3 微栓塞6 h后心肌组织病理改变(HE,×100)
3 讨论
现多以猪、羊、牛等大型动物建立CME的动物模型,利用经皮冠状动脉介入技术为主流。利用经皮冠状动脉介入技术,避免了开胸所导致的全身反应和内环境的改变。Ma等[2]已建立小型猪的CME模型,因为涉及使用血管内超声导管、多普勒导丝、压力导丝,故当时使用6 F XB 3.5指引导管。但是,如果只是为了在小型猪的LAD中远段注入栓塞微球,是否利用5 F造影管就可以完成此操作;而且,结合小型猪血管细小的特点,多采用管径小的耗材,如Cordis桡动脉穿刺针、1.8 F Finecross微导管是否更便于操作值得探讨。
本研究结果表明,Cordis桡动脉穿刺针可以顺利地穿刺小型猪股动脉。而尽管是小型猪股动脉,其实与人的桡动脉类似,很容易痉挛,初学者一定要注意动作轻柔,很多经验与笔者穿刺人桡动脉是一样的。造影管到达左主干开口后,通常可以直接送入1.8 F Finecross微导管至LAD,个别需要借助Runrough NS导丝才能送入微导管。向LAD注入栓塞微球时,速度要慢,否则会引起心动过速、甚至急性左心衰。CME的典型后果是心肌微梗死、炎症反应、收缩功能障碍和冠脉储备下降[3]。本研究中模型心肌HE染色可以观察到栓塞微球、心肌微梗死、炎症反应;血清BNP、cTnI水平较对照组增高,均证实所构建模型是成功的。采用桡动脉穿刺针、5 F造影管、1.8 F微导管较之前用股动脉穿刺针、6 F指引导管相比较,更适合小型猪股动脉、升主动脉、左主干内径特点,血管损伤减少,操作更简便,手术时间短,无需呼吸机支持;且费用更低廉,有明显优势。
利用上述的技术,少许变通尚可以建立其他疾病的模型,具有很好的实用性。如少量多次向LAD注入栓塞微球建立慢性缺血性心力衰竭模型[4-5],而用球囊阻断LAD血流90 min可以建立大面积心肌梗死模型[6],短时间往LAD注入大量的栓塞微球建立可以建立心源性休克模型[7]。因此,利用桡动脉穿刺套装,5 F的造影管,1.8 F微导管可以顺利建立小型猪CME动物模型,简便、经济、实用,值得推广。
[1]Otto S,Seeber M,Fujita B,et al.Microembolization and myonecrosis during elective percutaneous coronary interventions in diabetic patients:an intracoronary Doppler ultrasound study with 2-year clinical follow-up[J].Basic Res Cardiol,2012,107(5):289.doi: 10.1007/s00395-012-0289-x.
[2]Ma J,Qian J,Ge J,et al.Changes in left ventricular ejection fraction and coronary flow reserve after coronary microembolization[J]. Arch Med Sci,2012,8(1):63-69.doi:10.5114/aoms.2012.27283.
[3]Heusch G,Kleinbongard P,Böse D,et al.Coronary microembolization:from bedside to bench and back to bedside[J].Circulation,2009,120(18):1822-1836.doi:10.1161/CIRCULATIONAHA. 109.888784.
[4]Schmitto JD,Coskun KO,Coskun ST,et al.Hemodynamic changes in a model of chronic heart failure induced by multiple sequential coronarymicroembolization in sheep[J].Artif Organs,2009,33 (11):947-952.doi:10.1111/j.1525-1594.2009.00921.x.
[5]Sherwood LC,Sobieski MA,Koenig SC,et al.Benefits of aggressive medicalmanagementin a bovine modelofchronic ischemic heart failure[J].ASAIO J,2013,59(3):221-229.doi:10.1097/ MAT.0b013e3182894e66.
[6]Saeed M,Hetts SW,Do L,et al.MRI quantification of left ventricular function in microinfarct versus large infarct in swine model[J]. Int J Cardiovasc Imaging,2013,29(1):159-168.doi:10.1007/ s10554-012-0076-7.
[7]How OJ,Røsner A,Kildal AB,et al.Dobutamine-norepinephrine, but not vasopressin,restores the ventriculoarterial matching in experimental cardiogenic shock[J].Transl Res,2010,156(5):273-281.doi:10.1016/j.trsl.2010.07.011.
(2013-10-15收稿 2014-02-11修回)
(本文编辑 陈丽洁)
Improving Technique of Coronary Intervention to Build Pig Model of Coronary Microembolization
MA Guotian1,ZENG Zhiyu1,WU Hai1,LUO Chenyuan2,LIN Shiyun1
1 Department of Geriatric Cardiology,the First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China; 2 Department of Pathophysiology of Guangxi Medical University
ObjectiveTo develop miniature pig model of coronary microembolization(CME)by easy and cost-efficient technique.MethodsA total of 11 miniature pigs were divided into control group(n=5)and CME group(n=6).Femoral artery was punctured using 21 gauge needle that is normally used for transradial procedures.Microspheres were injected into the left anterior descending artery of the CME group by 5 F coronary radiography catheter and 1.8 F coronary microguide catheter.Serum concentrations of brain natriuretic peptide(BNP)and cardiac troponin I(cTnI)were evaluated just before CME and 6 hours after CME.Apical myocardial pathological lesions were evaluated by optical microscope 6 hours after CME.ResultsAll miniature pigs in control group survived,but one died in the CME group.5 F coronary radiography catheter and 1.8 F coronary micro-guide catheter reached designated location successfully.Before CME,serum BNP(ng/L:143.00±13.51 vs 134.00±15.57)and cTnI(μg/L:0.39±0.09 vs 0.38±0.10)showed no significant differences between these two groups(t values are 0.976 and 0.294 respectively,both P>0.05).By contrast,serum BNP(561.00±80.65)and cTnI (2.75±0.58)were much higher in CME group than those(BNP 139.00±13.87;cTnI 0.54±0.14)in control group after CME(t values are 11.530 and 8.337 respectively,both P<0.001).In CME group,microspheres,micro-infarction and inflammatory cell infiltration were seen under an optical microscope which are absent in control group.ConclusionUsing new surgical consumables can successfully develop miniature pig model with CME.And the technique is simple,cost-efficient,practical so it is worth promoting.
coronary microembolization;endovascular procedures;animal model;swine,miniature
R543.3
A
10.3969/j.issn.0253-9896.2014.06.011
*广西医疗卫生适宜技术研究与开发课题(项目编号:S201303-01);广西医科大学青年科学基金(项目编号:GXMUYSF201213)
1广西医科大学第一附属医院老年心内科(邮编530021);2广西医科大学病理生理学教研室
△通讯作者 E-mail:280515487@qq.com
