纳米氧化硅空心球负载光敏剂对肝癌体内外的杀伤作用研究*
2014-06-14刘忠涛刘志鹏苗雄鹰林良武
刘忠涛,刘志鹏,熊 力,苗雄鹰,林良武,文 宇*
(中南大学 a.湘雅二医院普外科;b.中南大学粉末冶金国家重点实验室,湖南 长沙 410083)
0 引文
原发性肝癌是世界上发病率和死亡率均较高的十大恶性肿瘤之一[1,2]。我国肝癌病例数约占全世界肝癌总例数的43.7%,肝癌死亡率居我国恶性肿瘤病死率的第 2 位,为 20.37/10 万人[l,3],而且肝癌发病率呈现逐年上升趋势,因此严重威胁我国人民的健康。然而原发性肝癌发病比较隐匿,早期诊断比较难,且多数在肝硬化基础上发病,因此治疗困难、而且临床肝癌诊疗中还存在着复发转移率高。治疗缺乏针对性、源头创新药物和治疗手段少等问题,因此对肝癌诊治新技术、新疗法的研究尤为重要和迫切[4]。
PDT是一种临床认可的,副作用较小,并且可以选择性杀死肿瘤细胞的治疗,是近20年来发展起来的一种新的治疗恶性肿瘤的方法,现已证明对多种实体肿瘤具有良好的治疗效果[5,6]。但早期主要用于体表和脑内肿瘤,对肝脏肿瘤等腹腔内肿瘤的治疗的相关研究较少。PDT治疗分为两个过程:人实施了对光敏感的光敏剂后,光通过光纤到达人体的肿瘤部分,以适当波长的光照射,使光敏剂活化,活化的光敏剂可以把能量传递给氧,通过一系列反应导致细胞凋亡或坏死。由于纳米颗粒是光敏剂的理想载体,因此将纳米颗粒作为光敏剂的载体是一个非常可行的办法。
本实验研究将Photosan与空心氧化硅纳米粒子结合后,对其药物性质及效果的改善。通过设计体内、体外实验,探讨应用负载Photosan的空心氧化硅纳米粒子的光动力疗法对肝癌的作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌细胞系HepG2购自中南大学湘雅医学院细胞中心。实验动物SPF级BALB/c裸小鼠,雌性,日龄26-30天,体重18-22 g,由中国科学院上海实验动物中心提供。饲养、实验地点在中南大学湘雅二医院SPF级动物实验室。
1.1.2 主要仪器 LD-630半导体激光光动力仪(中国深圳雷迈公司)光纤(中国深圳雷迈公司)超净工作台(中国苏州净化设备有限公司)恒温CO2细胞培养箱(美国、Thermo)高速冷冻多用途离心机(美国、Beckman)倒置相差显微镜(日本、奥林巴斯)酶联免疫检测仪(美国、Thermo)流式细胞仪(美国、BD公司)摇床(中国、其林贝尔)电泳仪(中国、北京六一)水平琼脂糖电泳槽(中国、北京六一)转膜仪(中国、北京六一)
1.1.3 主要试剂 Photosan(Seeh of Laboratorium F&E GmbH Wesselburenerkoog德国)中空氧化硅纳米化Photosan(中南大学粉末冶金国家重点实验室)DMEM培养液(Gibco公司,美国)FBS(Gibco公司,美国)胰酶(四季青公司,中国)MTT(Sigma-Aldrich公司,美国)Annexin V-FITC/PI双染试剂盒(Roche公司,瑞士)RIPA裂解液(北京普利莱)蛋白酶抑制剂(Merck,美国)SuperECL Plus超敏发光液(Thermo pierce,美国)显影液,定影液(WellBiology,中国)Goat anti-rabbit IgG(Proteintech,美国)IHC二抗显色试剂盒(KPL,美国)
2.2 方法
2.2.1 细胞培养及传代 从液氮罐中取出冻存管,迅速放入37~42℃水浴箱中,迅速摇匀使之尽快融化,将细胞悬液注入无菌离心管中,滴加10 mL DEME细胞培养基,吹打混匀。1000 r/min离心5~10 min,去上清后用适当体积的10%DEME细胞培养基稀释后转入无菌培养瓶,于5%CO2,37℃培养箱中培养,24 h后更换一次培养液,继续培养。每日观察细胞生长情况,定期换液。细胞长成单层后,以胰蛋白酶消化适当后传代。
2.2.2 MTT法测定普通 Photosan-PDT及纳米化Photosan-PDT对人肝癌细胞的杀伤作用 取对数生长的细胞,倒置显微镜下计数,调整细胞浓度为1×105/mL,每孔200 μL接种于96孔板上,置于37℃恒温培养箱中培养。首先分两大组,即普通光敏剂组和空心纳米粒子光敏剂组。然后再分四小组,分别为完全空白对照组:既不加光敏剂,也不光照。单纯光敏剂组:用不同浓度光敏剂处理细胞,不光照。单纯光照组:不加光敏剂,用不同强度光照。实验组:加不同浓度的光敏剂,用不同强度的光照。实验组按实验设计加入含 0、1.25、2.5、5、10、20 mg/L 浓度的光敏剂培养基100 μL,各组的加药与光照间隔时间分别为1、2、4 h,在严格避光的条件下,置于恒温箱中孵育,到达光照时间前,吸去光敏剂培养液,并用PBS洗两遍,再加入完全培养基并光照,每组间隔时间分别分三块板,分别接受2.5、5、10 J/cm2能量密度的光照,光照后继续在恒温箱中培养24 h,光敏剂实验组按间隔时间分别去除光敏剂培养液,换完全培养基继续培养24 h,然后应用MTT法以以下公式计算细胞抑制率:细胞抑制率=1-(实验组0D值-空白对照组OD值)/实验对照组OD值-空白对照组OD值)×100%。整个实验操作在暗室内进行。照光前整个培养板用锡纸覆盖,照光时,只照光孔揭开锡纸。相同实验重复3次。
2.2.3 流式细胞仪检测Photosan及纳米化Photosan介导PDT对诱导细胞凋亡或坏死的影响 根据之前MTT实验的结果,本实验共分为4组:A组(完全空白对照组)、B组(纳米化Photosan使用自身最佳作用参数PDT组)、C组(Photosan使用纳米化Photosan最佳作用参数PDT组)、D组(Photosan使用自身最佳作用参数PDT组)。准备Annexin V-FITC结合液,原液为4×,用双蒸水将其稀释至1×。各分组样本予以相应的干预处理后,收集细胞。将细胞培养液吸出,置于一合适离心管内。用PBS洗涤贴壁细胞一次后,将PBS吸出亦置于离心管内。用0.25%胰酶(不含EDTA)消化细胞。细胞消化下来后,同样置于上步中收集的细胞培养液的离心管中,然后1000 r/min离心5 min,弃上清,将沉淀的细胞用PBS轻轻重悬,将细胞计数。取10万左右重悬的细胞,1000 r/min离心 5 min,弃上清,加入 195 μL Annexin V-FITC结合液(1×)轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀。室温(20-25 ℃)下避光静置10 min。1000 r/min离心5 min,弃上清,加入190 μL Annexin V-FITC结合液(1×)轻轻重悬细胞。加入10 μL PI染色液,轻轻混匀,冰浴避光静置。上机行流式细胞计数检测,Annexin V-FITC为绿色荧光,PI为红色荧光。以上实验重复3次。
2.2.4 Western-blot检测 Photosan 及纳米化 Photosan介导PDT肝癌中凋亡蛋白Caspase-3和Caspase9表达情况 取对数生长的细胞,倒置显微镜下计数,调整细胞浓度为4×105/mL,每孔2 mL接种于6孔板上,置于37℃恒温培养箱中培养。实验分三组,正常对照组(A组)、纳米粒子光敏剂组(B组)和普通光敏剂组(C组)。纳米粒子光敏剂组和普通光敏剂组。给予的光敏剂浓度都为5 mg/L,光照剂量为5 J/cm2,间隔时间为2 h,干预后,收集细胞,加入500 μL RIPA裂解液,在冰上,蛋白裂解30分钟,4℃下,12000 r/min离心5 min(提前开启离心机预冷),将离心后的上清液分装转移到0.5 mL离心管中,按照BCA蛋白定量试剂盒(Wellbio)的使用说明操作,测定蛋白浓度。配胶,上清液,电泳,用15%聚丙烯酰胺凝胶分离蛋白质,再从凝胶转移到PVDF膜,封闭。随后,将膜与一抗一起孵育,4℃过夜。孵育结束,TBS-T洗3次,每次15 min。之后,用封闭液稀释HRP标记的二抗,稀释比例1∶3000,将稀释后的二抗与膜共同孵育45~60 min。孵育结束,TBS-T洗3次,每次15 min。最后,ECL显色曝光,将曝光后的底片扫描。
2.2.5 观察 Photosan与纳米化Photosan介导的PDT治疗裸鼠人肝癌移植瘤的效果 收集常规培养的对数生长期肝癌细胞,台盼兰染色证实活细胞率超过99%,PBS洗涤细胞,离心,再以PBS重悬细胞,浓度为2×106/mL。每只裸鼠予以右侧腋下注入0.2 mL细胞悬液(含4×105个人肝癌 HepG2细胞)。常规饲养裸鼠,每隔1天观察裸鼠成瘤情况,一般5~7天后可见裸鼠前肢皮下成瘤,成瘤后用游标卡尺测量肿瘤大小,记录肿瘤的长径、短径及高。当肿瘤体积达到0.5 cm3左右时,开始分组治疗。分为三组,每组15只,分别为正常对照组(不加光敏剂也不光照)、纳米粒子光敏剂治疗组和普通光敏剂治疗组,每组腹腔注射光敏剂浓度为0.2 mg/mL,注射剂量按裸鼠体重计算,为10 mg/kg。给药4 h后予以630 nm的激光照射(500 mW,10 min)。成瘤后可见皮下移植瘤为椭球体,用椭球体积计算公式算出肿瘤体积:V=a×b×c×π×4/3(a:瘤体长径;b:瘤体短径;c:瘤体的高),每组治疗后每隔一天用游标卡尺测量肿瘤的大小,重复测量3次求平均值,按前述公式计算出肿瘤体积,并观察治疗前后裸鼠肿瘤生长的延迟期,以及最终生存时间。
2.2.6 统计学分析 采用SPSS统计学软件行单因素方差分析处理数据。
3 结果
3.1 普通 Photosan-PDT及纳米化 Photosan-PDT对人肝癌细胞的杀伤作用
在相同的光敏剂浓度及激光照射剂量的情况下,光敏剂的孵育时间不同,各组细胞存活率显著不同;且Photosan及纳米化Photosan在相同的孵育时间下,纳米粒子光敏剂介导的光动力作用的细胞存活率明显低于普通光敏剂。在5 mg/L的光敏剂浓度、10 J/cm2的光照剂量的情况下;Photosan实验组中,在孵育时间为4 h之前,HepG2细胞存活率随孵育时间的增加而下降;而孵育时间超过4 h后,细胞存活率与孵育4 h相比较没有显著差异。纳米化Photosan组中,2 h的孵育时间与1 h孵育时间比较,细胞存活率有显著差异;而孵育时间大于2 h之后,各组间的差别均无统计学意义(如图1)。以上结果证实:普通光敏剂的最佳孵育时间为4 h,纳米粒子光敏剂的最佳孵育时间为2 h。
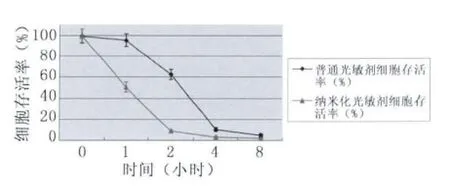
图1 Photosan及纳米化Photosan孵育时间对PDT治疗效果的影响(细胞存活率)
在相同的光敏剂孵育时间及激光照射剂量的情况下,光敏剂的浓度不同,各组的细胞存活率也显著不同;且Photosan及纳米化Photosan在相同的光敏剂浓度下,纳米粒子光敏剂介导的光动力作用的细胞存活率明显低于普通光敏剂。在2 h的光敏剂孵育时间、10 J/cm2的光照剂量的情况下,Photosan实验组中,在Photosan的浓度由0 mg/L向20 mg/L递增时,细胞存活率逐渐下降,且各组之间的差别均有统计学意义。当Photosan的浓度为20 mg/L时,与相同浓度的纳米化Photosan组相比,细胞存活率没有统计学差异。纳米化Photosan组中,在光敏剂浓度低于5 mg/L时,HepG2细胞存活率随着光敏剂浓度的增而下降;而光敏剂浓度高于5 mg/L后,细胞存活率与5 mg/L相比较没有显著差异(如图2)。以上结果显示:普通光敏剂的最佳光敏剂浓度为10 mg/L,纳米粒子光敏剂的最佳光敏剂浓度为5 mg/L。
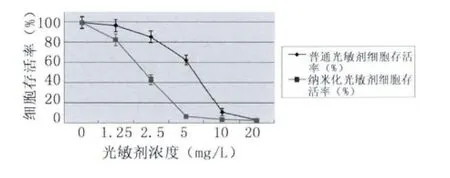
图2 Photosan与纳米化Photosan浓度对PDT杀伤效果的影响(细胞存活率)
在相同的光敏剂孵育时间及光敏剂浓度的情况下,光照剂量不同,各组的细胞存活率显著不同;且Photosan及纳米化Photosan在相同的光照剂量下,纳米粒子光敏剂介导的光动力作用的细胞存活率明显低于普通光敏剂。在2 h的光敏剂孵育时间、5 mg/L的光敏剂浓度的情况下,Photosan实验组中,在光照剂量为2.5、5、10 J/cm2递增时,细胞存活率逐渐下降,且各组之间的差别有统计学意义。纳米化Photo-san组中,2.5 J/cm2与 5 J/cm2的光照剂量比较,细胞存活率有显著差异;5 J/cm2与10 J/cm2的光照剂量比较,细胞存活率无显著差异(如图3)。以上结果显示:普通光敏剂的最佳光照强度为10 J/cm2,纳米粒子光敏剂的最佳光照强度为5 J/cm2。
3.2 普通 Photosan-PDT及纳米化 Photosan-PDT对人肝癌细胞的凋亡影响
应用流式细胞仪定量测定普通Photosan-PDT及纳米化Photosan-PDT对人肝癌细胞的凋亡发生率,结果显示:A组、B组、C组、D组凋亡率分别为:17.14% 、80.33%、40.66%,72.33% 。治疗组(B、C、D组)与对照组(A组)相比,凋亡+坏死率均有显著差异(P<0.05)。B组与D组之间的凋亡+坏死率比较无显著差异(P>0.05);而凋亡+坏死率的比较中,B组的凋亡+坏死率高于C组,且具有统计学差异(P<0.05)。流式细胞计数法进一步证实了PDT对胆管癌细胞的杀伤作用及光敏剂纳米化前后的效果差别。在使用相同的作用参数的情况下,Photosan介导的PDT对细胞的杀伤作用明显低于纳米化Photosan组(P<0.05)。而使用各自的最佳作用参数的情况下,纳米化Photosan组仍具有更高的细胞杀伤作用,显著高于Photosan组(P<0.05)(图4)。

图3 光照剂量对PDT治疗效果的影响(细胞存活率)
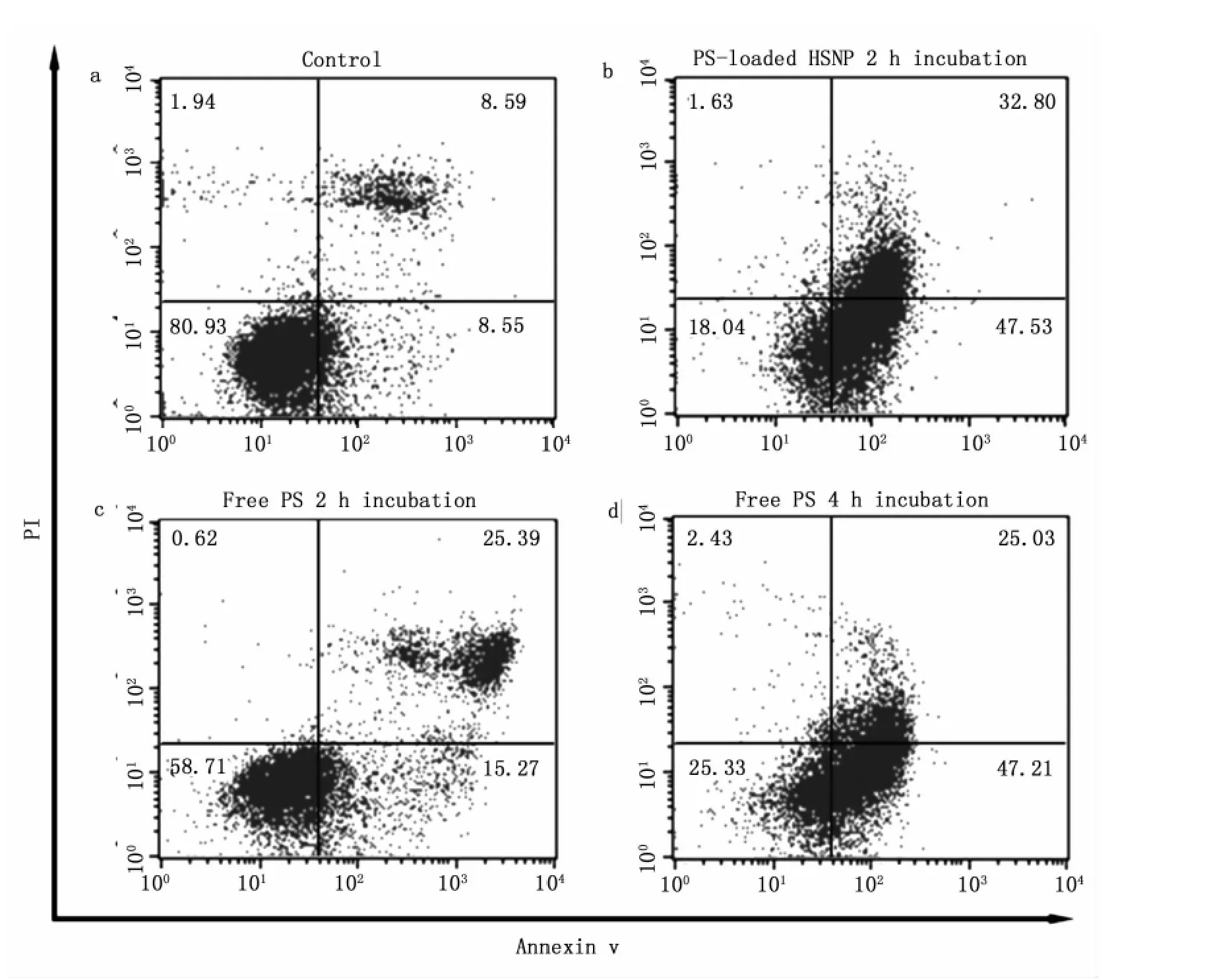
图4 A、B、C、D四组的流式细胞仪其分析:流式细胞仪中四个象限分别为左下代表正常细胞、右下代表凋亡细胞、右上代表坏死或晚期凋亡细胞、左上代表机械损伤细胞,凋亡率等于凋亡细胞+坏死或晚期的凋亡细胞/总细胞数
3.3 Photosan及纳米化Photosan介导PDT肝癌中凋亡蛋白Caspase-3和Caspase-9表达水平
结果显示:在5 mg/L的光敏剂浓度以及5 J/cm2的光照强度,光敏剂孵育时间间隔为3 h下,纳米化Photosan处理组的标本中,激活形式的Caspase3(即Caspase320 kD)表达显著增高(P<0.05);而Photosan处理组的标本中激活形式的Caspase3表达亦显著增高(P<0.05);且纳米粒子光敏剂干预组的蛋白表达显著高于普通光敏剂干预组(P<0.05)(如图5)。
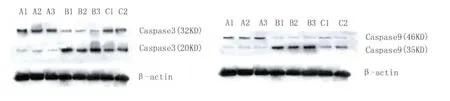
图5 各组肿瘤中激活形式的Caspase-3及caspase-9蛋白表达(A:空白对照组;B:纳米化Photosan处理组;C:Photosan处理组)
3.4 Photosan与纳米化Photosan介导的PDT治疗裸鼠人肝癌移植瘤的效果
PDT治疗前,各组肿瘤体积大小无差异,在空白对照组,肿瘤生长相对较快,肿瘤种植两周后,各组肿瘤体积达到(0.5 ±0.03)cm3,此时开始干预,在纳米化光敏剂组,光动力治疗后1-2天,肿瘤组织出现明显的坏死,肿瘤体积迅速开始缩小,创面出组织再生结痂,在6-8天时,创面结的痂脱落,肿瘤重新长出,但相对于对照组及Photosan组肿瘤明显要小,且生长缓慢。Photosan介导的PDT治疗组,经PDT治疗后初期与纳米化Photosan组的治疗效果类似,鼠肿瘤同样发生严重的坏死反应;之后坏死组织脱落,创面结痂,而肿瘤的复发较早,且相对于纳米化Photosan组来说肿瘤体积要大,且生长更迅速。治疗后第2天起,直到实验结束,纳米化Photosan组和Photosan组的肿瘤体积均显著小于对照组(P<0.05)。而纳米化Photosan组和Photosan组之间的肿瘤体积比较,治疗后6天之前无差异,第6天之后直到实验结束均可见前者肿瘤体积显著小于后者,有统计学差异(P <0.05)(见表1,图6)。

表1 裸鼠皮下移植瘤体积(cm3)
在对照组,肿瘤体积的生长达到2 cm3需要(21±2)天,同样的是,在普通光敏剂组,肿瘤生长到同样的体积需要(32±3)天,与对照组肿瘤相比延迟(9±0.3)天,纳米粒子光敏剂组需要56天,与对照组肿瘤相比延迟35±0.34天。在普通光敏剂组和纳米粒子光敏剂组,肿瘤的生长延迟有明显的差异(P<0.05)。另外,在研究裸鼠经两种光敏剂干预治疗后,两组的裸鼠的生存期存在明显差异,30%的裸鼠在种植肿瘤80天后仍然存活,而普通光敏剂组的裸鼠80天后基本全都死亡。对照组的裸鼠平均生存期为35天,明显短于普通光敏剂和纳米粒子光敏剂组的裸鼠平均生存期,且纳米粒子光敏剂组的平均生存期要长于普通光敏剂组,分别为49天和71天,具有统计学差异(P<0.05)。这些结果与肿瘤生长的延迟观察结果是一致的。
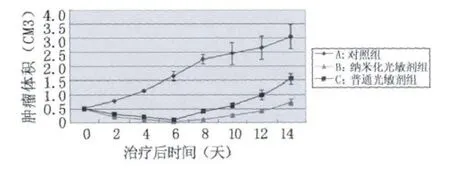
图6 肿瘤体积(cm3)的生长趋势
在对照组,肿瘤体积的生长达到2 cm3需要(21±2)天,同样的是,在普通光敏剂组,肿瘤生长到同样的体积需要(32±3)天,与对照组肿瘤相比延迟(9±0.3)天,纳米粒子光敏剂组需要56天,与对照组肿瘤相比延迟(35±0.34)天。在普通光敏剂组和纳米粒子光敏剂组,肿瘤的生长延迟有明显的差异(P<0.05)。另外,在研究裸鼠经两种光敏剂干预治疗后,两组的裸鼠的生存期存在明显差异,30%的裸鼠在种植肿瘤80天后仍然存活,而普通光敏剂组的裸鼠80天后基本全都死亡。对照组的裸鼠平均生存期为35天,明显短于普通光敏剂和纳米粒子光敏剂组的裸鼠平均生存期,且纳米粒子光敏剂组的平均生存期要长于普通光敏剂组,分别为49天和71天,具有统计学差异(P<0.05)。这些结果与肿瘤生长的延迟观察结果是一致的。
4 讨论
原发性肝癌(简称肝癌)是我国最常见的恶性肿瘤之一,尽管手术切除及肝移植治疗可以明显延长肝癌病人的生存期,但是由于疾病发现时多属晚期,无法行手术治疗。因此,非手术治疗在原发性肝癌的治疗中起着举足轻重的作用,然而原发性肝癌的非手术治疗,总的来说疗效仍非常有限[7]。因此对肝癌诊治新技术、新疗法的研究尤为重要和迫切[8]。
光动力疗法(Photodynamic therapy,PDT)是自20世纪80年代兴起的一种治疗肿瘤的新方法,其基本原理是光敏剂能被选择性的摄取并储留于肿瘤组织,在一定波长的光照激发下产生有细胞毒作用的一单态氧或氧自由基,毒杀肿瘤细胞,破坏肿瘤血管,激发机体免疫调节,导致肿瘤坏死、脱落,达到治疗目的[9-11]。
PDT涉及到激光和光敏药物(光敏剂)。特别是光敏剂,它(或其代谢产物)在适当波长光的激发下能产生光动力效应而破坏靶细胞。PDT的提出、发展及应用都是随着光敏剂的发展而逐渐完善的。但是目前为止,文献提及的大多数光敏剂都有一些弊端:主要是其疏水性或者说由于在水中的溶解度有限,导致其在液体中(例如血液中)积聚,影响其光化学特性,降低了单线态氧等的产量等,从而影响了治疗效果。然而近年来纳米药物的研究进展为解决此问题提供了途径。尽管人们已研发出多种能运载光敏剂的纳米药物载体,如脂质体(liposomes)[12,13]、多聚物载体(Polymer carrier)[14]、聚氧乙烯蓖麻油乳化液(Cremophor emulsion)[15],微球(Microspheres)和纳米粒子(Nanoparticles)[16],均能改善光敏剂的属性,但是他们均需要一个将装载的药物释放出来的过程。这将会减慢肿瘤细胞吸收光敏剂的速率,延长光敏剂达到有效药物浓度所需的时间[17]。所以,如果有一种纳米载体不需要释放所装载的光敏剂的过程,那么将大大提高光敏剂的药物效果,缩短光敏剂到达有效药物浓度所需的时间。近来,氧化硅纳米粒子因其形状和大小可控性高、水溶性好、性质稳定、生物相容度高等优势,已经引起了人们越来越多的重视。更为重要的是,氧化硅硅纳米粒子对于单态氧这种小分子来说是可穿透的[18,19],而单态氧正是PDT中关键的效应分子。故使用氧化硅纳米粒子来装载光敏剂,与其它传统的需要释放出装载的光敏剂的纳米载体相比,具有明显的优势[20]。所以,氧化硅纳米粒子是一种可提高光敏剂的光动力效应的理想的纳米载体。
在本部分的体外细胞实验中,我们首先用MTT实验验证了Photosan及纳米化Photosan介导的PDT对肝癌HepG2细胞的杀伤作用,并且证明了将Photosan纳米化后确实能增加其杀伤效率,缩短光敏剂的孵育时间,提高PDT疗效。PDT的疗效在一定的范围内与以下因素均相关:光敏剂的浓度、光敏剂的孵育时间、光照剂量。将Photosan纳米化后,在同样的治疗效果的情况下,可以减少Photosan的用量、缩短孵育时间。并且纳米粒子光敏剂本身在试验中未显示出细胞毒性。这对于将来增加光敏剂的实用性打下了基础。
在接下来的流式细胞计数实验中,我们进一步验证了Photosan纳米化前后介导的PDT均对肝癌细胞具有显著的杀伤作用,并且初步确定了其各自的导致细胞死亡的途径。Photosan与纳米化Photosan介导的PDT导致细胞死亡的途径均主要以诱导细胞凋亡为主,但纳米化Photosan介导的PDT导致的坏死细胞比例较Photosan为多。在Photosan及纳米化Photosan使用相同的作用参数时,后者的治疗效果显著优于前者。而当Photosan使用更高的光敏剂浓度及更长的孵育时间的情况下,其导致细胞死亡的比例仍然显著低于纳米化Photosan组。
另外,在体内实验中,我们通过追踪种植肝癌裸鼠模型在两种不同光敏剂治疗当中,瘤体体积的变化,肿瘤生长的延迟以及裸鼠的平均生存期,我们可以直观看到纳米粒子光敏剂治疗组的效果要明显优于普通光敏剂组。从而证实了纳米粒子光敏剂不仅在体外对肿瘤细胞杀伤效应的优越性,还证实了纳米粒子光敏剂在体内应用的可行性,为以后的临床试验提供了良好的动物载体实验基础。
我们在本文第一、二部分的试验中,通过MTT、流式细胞技术等方法已经证实,Photosan及纳米化Photosan介导的PDT对细胞的杀伤作用主要是通过诱导其凋亡和坏死。PDT引起细胞凋亡的机制主要通过两条信号通路:1、死亡受体介导的外源性通路;2、线粒体介导的内源性通路。外源性通路在PDT诱导的细胞凋亡中并不占主导,由内源性通路激活引起的[99-100]。细胞质 Cyc与凋亡蛋白酶激活因子1(Apaf-1)相结合,构成七聚凋亡复合体,与Caspase酶原-9结合,导致其裂解和激活。Caspase-9水解并活化Caspase-3/7,达到与外源性通路相同的终端。死亡受体介导的外源性通路又叫Caspase-8途径,最终为激活Caspase-3导致细胞凋亡,两种通路最后都是通过Caspase的活化来完成。
我们在本部分的实验中发现,Photosan及纳米化Photosan介导的PDT处理后,激活形式的Caspase3、Caspase9的蛋白表达水平均明显增高,与空白对照组之间的差异有统计学意义;并且Photosan组与纳米化Photosan组之间相比,也存在统计学差异-后者的Caspase3、Caspase9蛋白水平的表达均较前者高。这说明Photosan及纳米化Photosan介导的PDT引起肿瘤细胞凋亡通过了内源性与外源性两种途径,而纳米化Photosan引起的这种效应更为强烈。
5 结论
综上所述,我们通过体内外实验探讨了Photosan和纳米化Photosan带来的PDT的效果、细胞毒性及导致细胞死亡的主要途径等。从实验结果可得出,纳米粒子光敏剂对肝癌细胞的杀伤能力高于普通光敏剂。光敏剂纳米化改善了普通光敏剂的光化学效能,提高了其水溶性,增加了肿瘤组织内有效光敏药物的浓度,从而提高肿瘤细胞的光动力治疗的效果。
[1]PARKIN D M,BRAY F,FERLAY J,et al.Global cancer statisties.2002[J].CA:A Caneer Journal for Clinicians,2005,55(2):74-108.
[2]SHERMAN M.Hepatocellular carcinoma:epidemiology,risk factors and sereening[J].Liver Disease,2005,25(2),143-154.
[3]BAGNATO V S,KURACHI C,FERREIRA J,et al.New photonic technologies for the treatment and diagnosis of Hepatic diseases:an overview of the experimental work performed in collaboration,between physics institute of Sao Carlos and ribeirao preto faculty of medicine of the university of sao paulo[J].Acta Cir Bras,2006,21(Suppl 1):3-11.
[4]ALLISON R R,SIBATA C H.Oncologic photodynamic therapy photosensitizers:a clinical review[J].Photodiagnosis and Photodynamic Therapy,2010,7(2):61-75.
[5]CHEN B T,WITTE P A.Antivascular tumor eradication by hypericin-mediated photodynamic therapy[J].Photochemistry and Photobiology,2002,76(5):509-513.
[6]KONAN Y N,GURNY R,ALLEMANN E.State of the art in the delivery of photosensitizers for photodynamic therapy[J].Photochemistry and Photobiology,2002,66(2):89-106.
[7]SONCIN M,POLO L,REDDI E,et al.Effect of the delivery system on the biodistribution of Ge(IV)octabutoxy-phthalocyanines in tumour-bearing mice[J].Cancer Lett,1995,89(1):101-106.
[8]XIAO FENG DENG,LI XIONG,LIANG WU LIN,et al.Photosan-II loaded hollow silica nanoparticles:Preparation and its effect in killing for QBC939 cells[J].Photodiagnosis and Photodynamic Therapy,2013,10(4):460-469.
[9]BIEL M.Advances in Photodynamic therapy for the treatment of head and neek cancers[J].Lasers Surg Med,2006,38(5):349-355.
[10]DOUGHERTY T,GOMER C,HENDERSON B,et al.Photodynamic therapy[J].J Natl Cancer Inst,1998,90(2):889-905.
[11] HATAKEYAMA H,AKITA H,HARASHIMA H.A multifunctional envelope type nano device(MEND)for gene delivery to tumours based on the EPR effect:a strategy for overcoming the PEG dilemma[J].Adv Drug Deliv Rev,2011,63(11):152-160.
[12]ALLISON R R,SIBATA C H.Oncologic photodynamic therapy photosensitizers:a clinical review[J].Photodiagnosis Photodyn Ther,2010,7(2):61-75.
[13]CHEN B,ROSKAMS T,WITTE P A.Antivascular tumor eradication by Hypericin-mediated photodynamic therapy[J].Photochem Photobiol,2002,76(5):509-513.
[14]GARG A D,NOWIS D,GOLAB J,et al.Immunogenic cell death,DAMPs and anticancer therapeutics:an emerging amalgamation[J].Biochim Biophys Acta,2010,1805(1):53-71.
[15]KENNEDY J C,POTTIER R H,PROSS D C.Photodynamic therapy with endogenous protoporphyrin IX:basic principles and present clinical experience[J].Photochem Photobiol B,1990,6(1-2):143-148.
[16]ASCENCIO M,COLLINET P,FARINE M O,et al.Protoporphyrin IX fluorescence photobleaching is a useful tool to predict the response of rat ovarian cancer following hexaminolevulinate photodynamic therapy[J].Lasers Surg Med,2008,40(2):332-341.
[17]DE ROSA F S,BENTLEY M V.Photodynamic therapy of skin cancers:sensitizers,clinicalstudies and future directives[J].Pharmaceutical Research,2000,17(12):1447-1455.
[18]ROY I,OHULCHANSKYY T Y,PUDAVAR H E,et al.Ceramic-basednanoparticles entrapping water-insoluble photosensitizinganticancer drugs:a novel drug-carrier system for photodynamic therapy[J].Journal of the American Chemical Society,2003,125(26):7860-7865.
[19]WANG S Z,GAO R M,ZHOU F M,et al.Nanomaterialsand signlet oxygen photosensitizers:potential applicationsin photodynamic therapy[J].Journal of Materials Chemistry,2004,14(4):487-493.
[20]HAMBLIN M R,NEWMAN E L.On the mechanism of the tumour-localising effect in photodynamic therapy[J].Photochem Photobiol B,1994,23(1):3-8.
