黄瓜愈伤组织继代培养中激素浓度组合的优化*
2014-06-14黄玉兰殷奎德岳才军
黄玉兰,殷奎德,岳才军
(黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319)
黄瓜属葫芦科黄瓜属植物,其鲜果脆嫩多汁,营养丰富,清香可口,深受人们喜爱[1]。总黄酮类化合物作为一种功能成分,具有许多有益的生理效应与药理作用,越来越引起人们的重视[2-5],随着人们对总黄酮类物质的生物效能的逐步认识,对黄酮类化合物的研究也日益增多,有研究表明黄瓜叶中含有丰富的黄酮类物质[6],而直接从黄瓜叶中提取总黄酮,不但耗费植物材料,而且生产周期长。在培养的植物细胞、组织中,大部分次生代谢产物的含量超过了野生植物的含量,因此以黄瓜培养细胞为材料提取该物质就成为一条重要的途径,黄瓜培养细胞有两种,一种是以固体培养的愈伤组织细胞,一种是以液体进行的悬浮培养细胞[7]。悬浮细胞可不断增值,生长速度快,更有利于次级代谢产物的提取,而悬浮细胞体系建立的重要前提是愈伤组织的诱导。
本试验以黄瓜无菌苗不同外植体为材料进行愈伤组织的诱导,采用响应面设计分析方法对黄瓜愈伤组织继代培养基中激素浓度组合进行优化,筛选出最佳的激素配比,为黄瓜进一步悬浮细胞培养及生产次生代谢物奠定基础。
1 材料与方法
1.1 材料
黄瓜津研4号由黑龙江八一农垦大学生命科学技术学院提供。
1.2 方法
1.2.1 消毒方法 将黄瓜种子用清水洗净,在超净工作台中用 0.1%升汞溶液浸泡10 min,75%乙醇浸30-60 s,无菌水冲洗5次后,备用。
1.2.2 初代愈伤组织的获得 将消毒好的黄瓜种子接种于不含任何激素的MS培养基中,进行暗培养,制备无菌苗。将5-7 d无菌苗子叶叶片切成0.5 cm ×0.5 cm 的小块;胚轴和胚根切成 0.3-0.5 cm的小段,用长柄镊子将切好的外植体接种到诱导培养基上 MS+1.0 mg/L 6-BA+0.5 mg/L NAA中,注意外植体的切口处向下(接触培养基表面)。然后再以封口膜将三角锥瓶封上。将接种的培养瓶放入组织培养室的光照架上进行愈伤组织诱导,获得初代愈伤组织,愈伤组织诱导率 =接种后第20 d产生愈伤组织的外植体个数/接种外植体总数×100%。同时筛选出诱导初代愈伤组织的最佳外植体。
1.2.3 愈伤组织继代培养激素配比设计 邱超等研究表明,6-BA是黄瓜组织培养中诱导愈伤组织形成必不可少的植物生长调节剂[8],并根据一些文献报道[9-10],选择组织培养中常用的三种激素6-BA,IAA,AgN03为试验因素,考察各因素不同水平下对愈伤组织净增鲜重的影响,选择最佳的单因素激素条件。在单因素实验的基础上进行响应面设计,结果如表1,共20个组合,设计安排试验(表2)。
1.2.4 最佳培养基的筛选 将培养15 d的初代愈伤组织切成大小平均为0.3 g的小块,接入表2设计的不同培养基中进行继代培养,每个处理接种5瓶,每瓶4块,每个处理共20块,总质量为 6 g,即初始鲜重为6 g。接种15 d以后,再以初始鲜重的方法进行称重即为最终鲜重,(最终鲜重-初始鲜重)即净增鲜重为指标,进行最佳培养基的筛选。
1.2.5 数据分析 在不同因素试验的基础上,以6-BA,IAA,AgN03为考察变量,以净增鲜重为响应值,应用Design-Expert7.1软件,优化黄瓜愈伤组织继代培养中激素浓度的组合。
2 结果与分析
2.1 不同外植体愈伤组织诱导情况
表1为不同外植体愈伤组织诱导情况。从表1可见,子叶和下胚轴均有较高的愈伤组织诱导率,而胚根和真叶的愈伤组织诱导情况不理想,胚根诱导的愈伤组织有褐化现象,真叶的诱导率较低,诱导率只是子叶和下胚轴的一半。下胚轴与子叶相比,诱导的愈伤组织的数量相差不多,但愈伤组织呈水渍状,质量较差,不适合继代培养。而子叶诱导的愈伤组织无论从颜色,数量和质量上都相对较好,而且其实生苗利用率较高,每株无菌实生苗上可获取6-8个。前期实验表明,子叶中的总黄酮含量高于下胚轴,因此,确定子叶为愈伤组织诱导的最佳外植体。
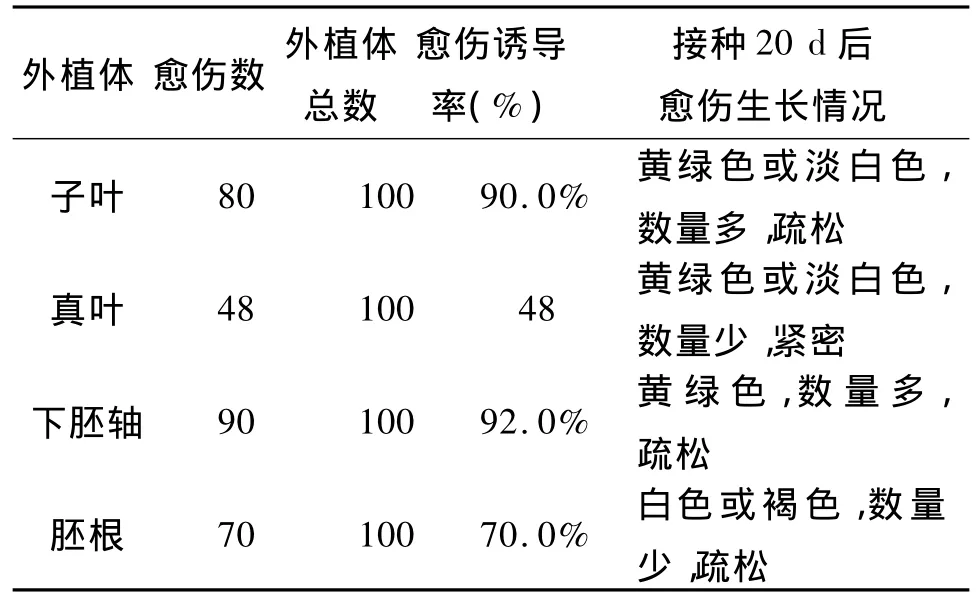
表1 不同类型外植体对愈伤组织诱导的影响Tab.1 Effect of different explants on cullus induction
2.2 愈伤组织继代培养激素配比的优化
2.2.1 6-BA对愈伤组织净增鲜重的影响 将初代培养的黄瓜愈伤组织6.00 g,置于培养瓶内,在固定条件下:IAA为0.5 mg/L,AgN03为1 mg/L条件下,选择不同激素浓度 0.5、0.8、1.0、1.2、1.5、1.8 mg/L条件下,考察6-BA对愈伤组织净增鲜重的影响,结果见图1。
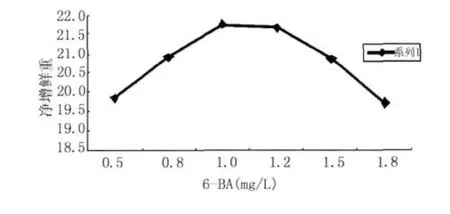
图1 不同浓度6-BA对愈伤组织净增鲜重的影响Fig.1 Effects of different 6-BA on net fresh weight extraction rate of cucumber callus
由图1可知,随着6-BA浓度的增大,愈伤组织净增鲜重不断增加,当浓度增加到1.0 mg/L时,净增鲜重开始下降。这也正符合激素诱导愈伤组织的一般规律,虽然其中促进细胞分裂,促进非分化组织分化,促进生物体内物质的积累。但6-BA的另一个重要特征是在植物体内的移动性差,其生理作用局限于处理部位及其附近,而且随着6-BA浓度的增加愈伤组织有褐化的趋势,褐化会影响组织分化,进而影响愈伤组织净增鲜重。因此认为6-BA浓度1.0 mg/L左右为宜。
2.2.2 IAA对愈伤组织净增鲜重的影响 将初代培养的黄瓜愈伤组织6.00 g,置于培养瓶内,在固定条件下:6-BA 为1.0 mg/L,AgN03为 1.0 mg/L 条件下,选择不同激素浓度 0.1、0.3、0.5、0.7、0.9、1.1 mg/L条件下,考察IAA对愈伤组织净增鲜重的影响,结果见图2。

图2 不同浓度IAA对愈伤组织净增鲜重的影响Fig.2 Effects of different IAA on net fresh weight extraction rate of cucumber callus
由图2可知,随着IAA浓度的增大,愈伤组织净增鲜重不断增加,当浓度增加到0.5 mg/L时,净增鲜重开始缓慢,而当浓度达到0.9 mg/L时,净增鲜重显著下降。不同种类的外源激素对黄瓜愈伤的诱导和分化作用是不同的,IAA通过改变愈伤组织中内源激素含量而起作用的。主要可能通过影响有关激素“库”大小的酶活性(过氧化物酶和IAA氧化酶)实现的。本实验中即使较低浓度的IAA也能诱导出较高量的愈伤组织。可见,愈伤组织的增值是受组织内激素IAA的浓度调控的,认为IAA浓度0.5 mg/L左右为宜。
2.2.3 AgN03对愈伤组织净增鲜重的影响 将初代培养的黄瓜愈伤组织6.00 g,置于培养瓶内,在固定条件下:6-BA 为1.0 mg/L,IAA 为0.5 mg/L条件下,选择不同激素浓度 0.5、0.7、0.9、1.0、1.2、1.5 mg/L条件下,考察AgN03对愈伤组织净增鲜重的影响,结果见图3。

图3 不同浓度AgN03对愈伤组织净增鲜重的影响Fig.3 Effects of different AgN03on net fresh weight extraction rate of cucumber callus
从图3可以看出,随着AgN03的增加,愈伤组织的净增鲜重也随之增加,当浓度达到1 mg/L时,净增鲜重有下降的趋势。本研究中添加AgNO3提高了愈伤组织诱导率,这主要是低浓度的AgNO3能够有效抑制培养物形成乙烯,减少组织老化变褐,诱导愈伤组织的发生[11]。但当AgNO3浓度高于1.0 mg/L后,对愈伤组织生长可能转成了抑制作用,这可能是浓度过高降低了激素的水平,产生了毒害作用[12]。
2.3 愈伤组织继代培养激素配比的优化
2.3.1 响应面分析方案及试验结果 在单因素试验基础上,选择6-BA,IAA,AgN03为自变量,根据中心组合(Box-Behnken)试验设计原理采用三因素五水平的响应面分析法,确定愈伤组织继代培养中激素组合的最佳配比。利用 De-sign Expert7.0软件进行数据拟合,其具体试验方案及结果见表2、3。
2.3.2 模型的建立及其显著性检验 利用Design-Expert软件对表2试验数据进行二次多项式逐步回归拟合,得到数学模型为:Y=23.03+0.084X1+0.059X2+0.088X3+0.013X1X2+0.013X1X3+0.013X2X3 -1.17X12-0.070X22-0.18X32。对表3中的试验结果进行统计分析,得到的方差分析结果如表4所示。由表4可知,6-BA,IAA,AgN03的一次项,平方项均达到显著水平(P<0.05)。由 F值可知,各因素对愈伤组织净增鲜重的影响次序为:6-BA(X3)>AgN03(X1)>IAA(X2)。此模型的决定系数R2为0.9957,经拟合检验可知该二次方程模型达到极显著水平,并且失拟项不显著,说明该方程与实际情况拟合很好,能够正确反映愈伤组织净增鲜重与6-BA,IAA,AgN03激素之间的关系。
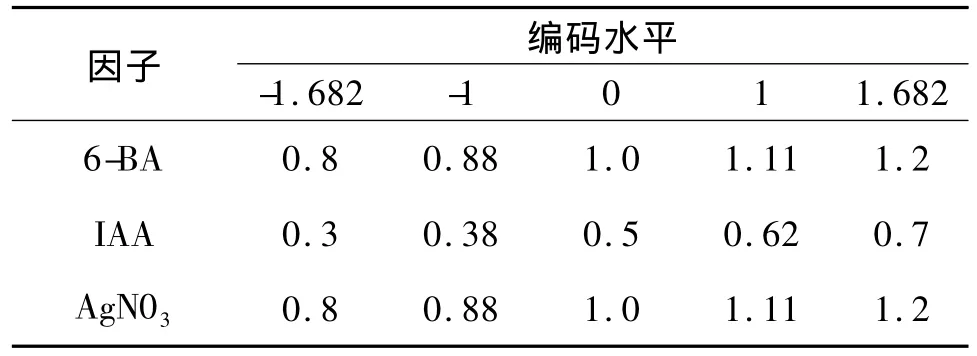
表2 因素水平编码表Tab.2 Coding of factors and levels
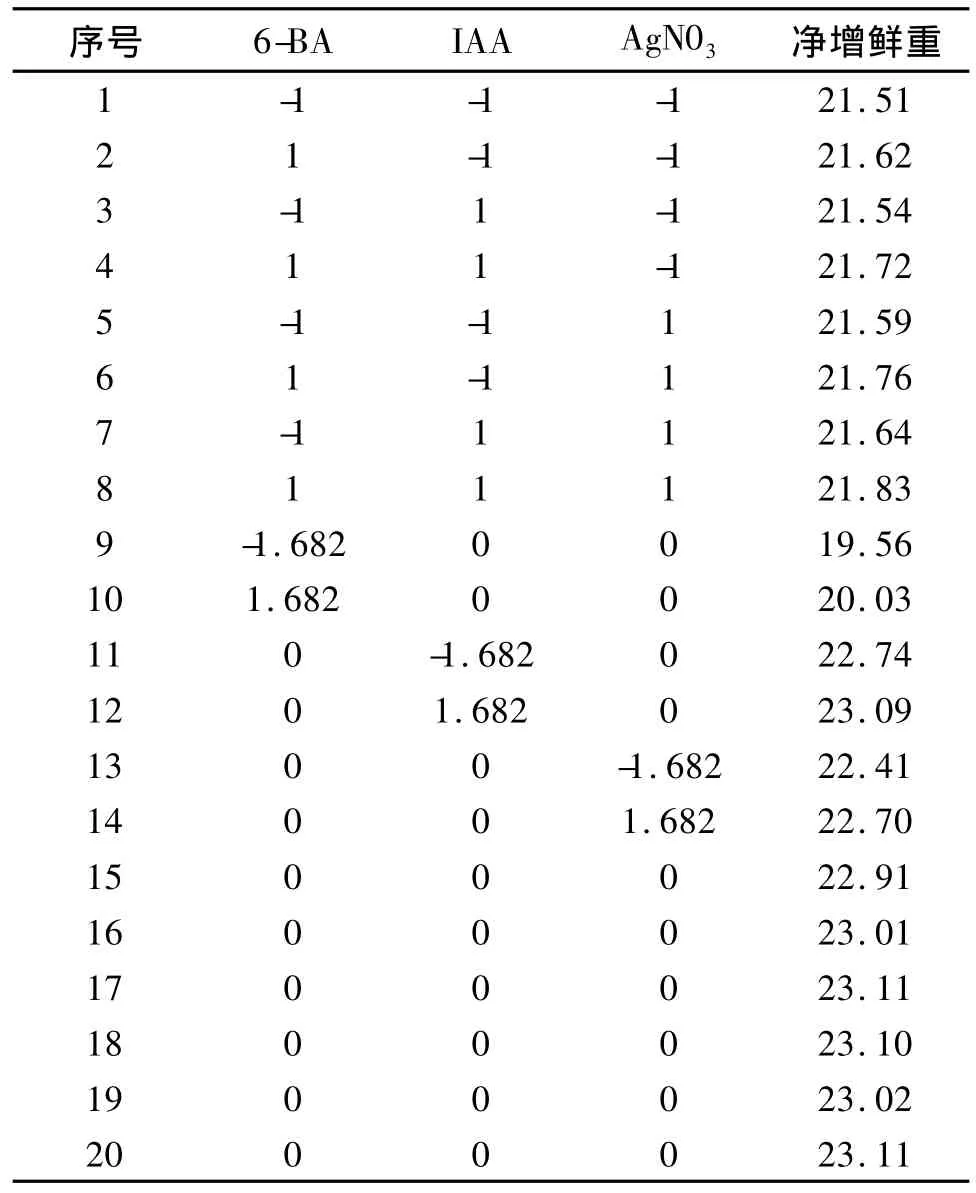
表3 试验设计方案及试验结果Tab.3 Test designs and results
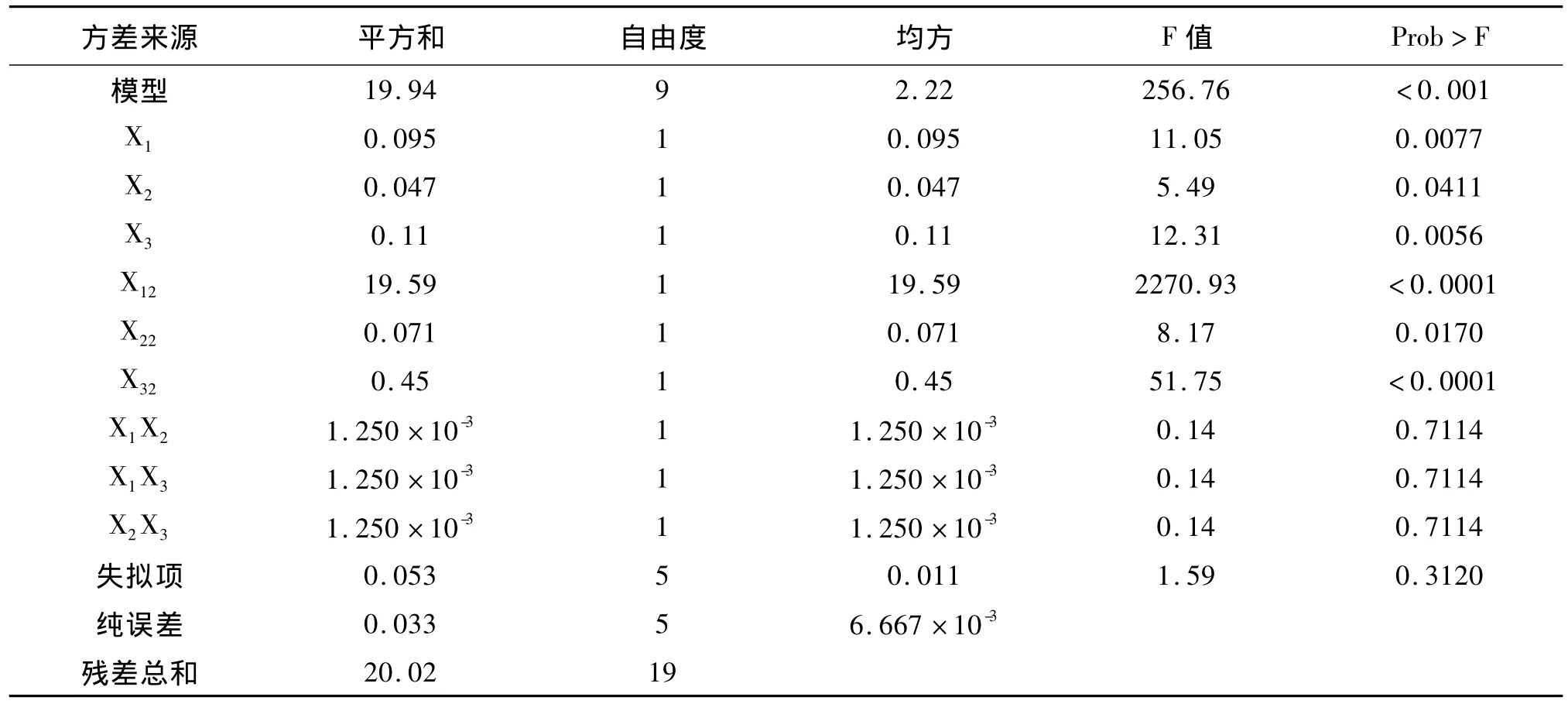
表4 回归模型各项的方差分析Tab.4 Variance analysis of regression equation
2.3.3 响应面分析 根据回归方程,做出各个激素组合对黄瓜愈伤组织净增鲜重的响应面和等高线,考察拟合响应曲面的形状,分析6-BA,IAA,AgN03三种激素浓度对黄瓜愈伤组织净增鲜重的影响,见图4~6。等高线图直观地反映出三种激素的交互作用对愈伤组织净增鲜重的影响。椭圆形表示两因素交互作用显著,而圆形则表示两因素之间的交互作用不明显。由图可以看出,6-BA和IAA,6-BA和AgN03的交互作用显著,IAA和AgN03交互作用较小。

图4 6-BA和IAA对黄瓜愈伤组织净增鲜重的响应面和等高线图Fig.4 Response surface and contour for effects of 6-BA and IAA on net fresh weight extraction rate of cucumber callus
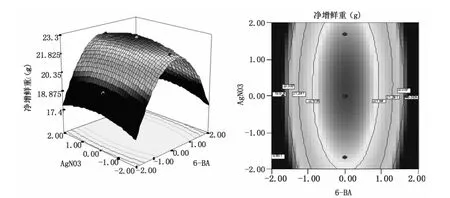
图5 6-BA和AgN03对黄瓜愈伤组织净增鲜重的响应面和等高线图Fig.5 Response surface and contour for effects of 6-BA and AgN03on net fresh weight extraction rate of cucumber callus
图4~6直观地反映了各激素对净增鲜重的影响,由等值线图可以看出存在极值的条件应该在圆心处。比较3组图可知:6-BA对黄瓜愈伤组织净增鲜重影响较为显著,表现为曲线较陡;而 IAA和AgN03,表现为曲线较为平滑,且随其数值的增加或减少,响应值变化较小。同时也说明了6-BA是黄瓜脱分化过程中必须激素之一。
2.3.4 最佳激素的配比及验证 为进一步确定最佳的激素浓度,在模型浓度范围内选择出发点,按照模型使用快速上升法优化,可得愈伤组织净增鲜重的最佳激素配比为:6-BA为1.0091 mg/L,IAA为0.5502 mg/L,AgN03为 1.1026 mg/L,在此最佳激素配比下愈伤组织净增鲜重的理论提取率23.14 g。在此激素条件下,实际测得的平均提取率23.13 g,与预测值基本一致,证实了该模型的有效性。因此选出的培养基 MS+6-BA1.009 mg/L+IAA 0.5502 mg/L+AgN031.1026 mg/L为黄瓜愈伤组织继代培养的最佳培养基。继代培养的黄瓜愈伤组织为黄绿色,质地紧密,数量较多。在最佳激素浓度组合后的培养基上诱导出的愈伤组织见图7A。

图6 IAA和AgN03对黄瓜愈伤组织净增鲜重的响应面和等高线图Fig.6 Response surface and contour for effects of IAA and AgN03on net fresh weight extraction rate of cucumber callus
2.3.5 黄瓜细胞悬浮培养 将最佳培养基上生长状态良好的愈伤组织,接种到不加琼脂的液体培养基:MS+6-BA 1.009 mg/L+IAA 0.5502 mg/L+AgN031.1026 mg/L中进行黄瓜细胞的液体悬浮培养,结果发现,悬浮细胞可不断增值,生长速度快,状态良好,悬浮细胞见图7B。

图7 最佳培养基的黄瓜愈伤组织及细胞悬浮培养Fig.7 Cucumber callus induced under optimized culture condition and cucumber suspension cells of cucumber
3 结论
本试验通过黄瓜外植体的不同部位的愈伤组织诱导情况,得出子叶为愈伤组织诱导的最佳外植体。在愈伤组织继代培养激素优化的过程中采用响应面分析方法,确定的数学模型为:Y=23.03+0.084X1+0.059X2+0.088X3+0.013X1X2+0.013X1X3+0.013X2X3 -1.17X12-0.070X22-0.18X32。通过模拟寻优得到的黄瓜愈伤组织继代培养的最佳培养基为:MS+6-BA1.009 mg/L+IAA 0.5502 mg/L+AgN031.1026 mg/L,并且得到黄瓜最大愈伤组织净增鲜重为23.14 g。通过验证实验在筛选出的最佳培养基上培养得到的黄瓜愈伤组织净增鲜重为23.13 g,与预测值基本一致。此结果说明,利用响应面设计对黄瓜愈伤组织增殖培养基的优化是可行的,同时在最佳培养基进行黄瓜细胞的悬浮培养,增值速度快,生长状态良好,为进一步研究黄瓜悬浮细胞培养生产次生代谢产物奠定基础。
[1]任绿枝,李珊珊,王东方,等.高效黄瓜愈伤组织诱导培养的研究[J].山东轻工业学院学报,2011,25(3):32-35.REN Luzhi,LI Shanshan,WANG Dongfang,et al.Research on efficient callus culture of cucumber[J].Journal of Shandong Polytechnic University,2011,25(3):32-35.
[2]张婉,唐丽,谢坤,等.蒿属植物黄酮类化学成分及药理活性研究概况[J].中央民族大学学报:自然科学版,2009,18(1):73-77.ZHANG Wan,TANG Li,XIE Kun,et al.Studies on chemical constituents and pharmacological activities of Artemisia plant flavonoids[J].Journal of Minzu University of China:Natural Science Edition,2009,18(1):73-77.
[3]潘国庆,梁永欣.黄酮类化合物结构与抗氧化活性关系研究[J].研究与开发,2005,12(3):28-30.PAN Guoqing,LIANG Yongxin.Study on the relationship between structure and antioxidant activity of flavonoids compounds[J].Research and Development,2005,12(3):28-30.
[4]HUANG H Y,CHA X L.Development in research of antitumor effect of flavones compounds[J].Chinese Journal of New Drugs and Clinical Remedies,2002,21(7):428-433.
[5]YANG D M,XU SHB.The preliminary research of anti-inflammation and toxicity of cansora Lucidissima Hand Mazz[J].Academic Journal of Guangdong College of Pharmacy,2001,17(1):33-35.
[6]蔡健,王薇.黄瓜叶中总黄酮含量的研究[J].食品学报,2005,26(8):194-196.CAI Jian,WANG Wei.Study on the total flavonoids content in leaves of cucumber[J].Journal of Food,2005,26(8):194-196.
[7]王丽艳,荆瑞勇,郭永霞,等.大豆愈伤组织继代培养中激素浓度组合的优化[J].中国油料作物学报,2013,35(4)446-450.WANG Liyan,JING Ruiyong,GUO Yongxia,et al.Optimum combination of hormone concentration during callus subculture of soybean[J].Chinese Journal of Oil Crop,2013,35(4)446-450.
[8]邱超,黄作喜.黄瓜组织培养研究进展[J].内江师范学院学报,2010,25(增):487-489.QIU Chao, HUANG Zuoxi. Advances in tissue culture of Cucumber[J].Journal of Neijiang Normal University,2010,25(adding):487-489.
[9]王梅,李铭,陈丽,等.黄瓜愈伤组织诱导研究技术[J].墨室园艺,2004(3)54-56.WANG Mei,LI Ming,CHEN Li,et al.Study of callus induction cucumber[J].The Ink Chamber Gardening,2004(3)54-56.
[10]赵隽,王华,潘俊松,等.黄瓜子叶节离体再生体系的研究[J].上海交通大学学报:农业科学版,2004,22(1):43-53.ZHAO Jun,WANG Hua,PAN Junsong,et al.Study on in vitro regeneration system of Cucumber cotyledonary node[J].Journal of Shanghai Jiao Tong University:Agricultural Sciences,2004,22(1):43-53.
[11]孙敬三,朱至清.植物细胞工程实验技术[M].北京:化学工业出版社,2005.SUN Jingsan,ZHU Zhiqing.Plant cell engineering[M].Beijing:Chemical Industry Press,2005.
[12]刘娟,汤浩茹,王小蓉,等.硝酸银在植物离体培养中的应用之研究进展[J].中国农学通报,2007,23(10):400-406.LIU Juan,TANG Haoru,WANG Xiaorong,et al.Research progress of Silver nitrate in vitro plant culture[J].Chinese Agricultural Science Bulletin,2007,23(10):400-406.
[13]王丽艳,荆瑞勇,肖莉杰.扁茎黄芪离体快繁及多倍体诱导[J].草业学报,2009,18(1):94-99.WANG Liyan,JING Ruiyong,XIAO Lijie,et al.Rapid propagation in vitro and polyploid induction of Astragalus complanatus[J].Acta Prataculturae Inica,2009,18(1):94-99.
