松针纤维素降解菌的筛选及其混合发酵1)
2014-06-13范金霞王宏燕
范金霞 王 瑶 王宏燕 张 珏
(东北农业大学,哈尔滨,150030)
我国大兴安岭地区松针资源丰富,品种较多,而松针是松树类植物的主要副产物之一,具有再生速度快、四季均可采收、天然蓄积量大的特点,而且松林区发生火灾的危害极为严重。因此,积极研究开发并合理利用松针资源拥有重大意义。松针中纤维素类物质的质量分数高达56.4%[1]。纤维素占陆地生态系统生物量的80%,是地球上数量最大的可再生资源,每年通过全球生物合成可再生性纤维素达1 000亿t以上[2]。对于降解纤维素的菌种目前研究较多的是霉菌,尤以绿色木霉、里氏木霉和康氏木霉为典型[3-4],而对细菌的研究很少有报道。纤维素的生物降解研究表明[3],单一微生物对纤维素的降解是很难完成的,或只能微弱进行,必须依靠两种或两种以上的微生物共同作用才能完成。
笔者从筛选降解松针纤维素的细菌菌株入手,筛选出酶活力性高而且降解纤维素快速的细菌。以松针粉末为主要碳源,结合菌株间的协同效应,用纤维素降解菌的单独及混合发酵培养来考查菌株对松针纤维素的分解力,以便为这些菌株的应用提供理论支持。
1 材料与方法
1.1 材料
样品采集。从大兴安岭松林区采集腐殖土样品,于4℃保存备用。
原料。大兴安岭林区的落叶松和云杉的松针,烘干后粉碎,过100目筛。
培养基。无机盐筛选培养基:KH2PO40.5 g、(NH4)2SO40.4 g、MgSO4·7 H2O 0.07 g、CaCl20.07 g、CuSO40.005 g、ZnCl20.001 g、Na2HPO40.5 g、C6H6O620g;蛋白胨纤维素培养基(PCS):蛋白胨0.5 g、松针 0.5 g、NaCl 0.5 g、CaCO30.3 g、酵母浸粉 0.1 g;细菌培养基(LB):蛋白胨 5.0 g、NaCl 5.0 g、酵母浸粉2.5g;羧甲基纤维素钠培养基:KH2PO40.5 g、(NH4)2SO40.4 g、MgSO4· 7 H2O 0.07 g、CaCl20.07 g、CuSO40.005 g、ZnCl20.001 g、Na2HPO40.5 g、CMC(羧甲基纤维素)—Na 15.0 g。
1.2 方法
1.2.1 富集和纯化
将从菌源地采样得来的土壤样品取5 g加入到100 mL无机盐培养基,激活菌源土中的菌种,28℃,转速151 r/min摇床培养,重复传接V代。将第V代菌液稀释成一系列不同的稀释度,取 10-4、10-5、10-63种稀释度,涂布于无机盐琼脂培养基平板,每个稀释度涂布3个平板,28℃恒温培养长出菌群后,反复划线分离至长出单菌落,镜检确定菌体为较纯的单菌落后,接种于保藏培养基上保存。
1.2.2 纤维素降解细菌的初筛
将得到的细菌菌株分别用刚果染色法对平板筛选,其中平板5次重复,37℃恒温箱中培养72 h,每个平板倒入20 mL刚果红溶液(质量浓度1 g·L-1),染色 30 min 后,再用 1 mol·L-1氯化钠溶液洗涤2~3次,测量透明圈和菌体的直径。选取两比值较大的菌落进行下一步的单独发酵培养。
1.2.3 纤维素降解细菌的复筛
纤维素分解菌的单独与混合发酵培养:取100 mL的锥形瓶,装入50 mL的液体发酵培养基,并以体积比为5%的接种量接种,使其活菌数量达到1×109个/mL,于28℃、151 r/min的摇床震荡培养,每隔24 h测量羧甲基纤维素酶活力。
粗酶液制备:取培养24h的发酵液10mL,在6 000 r·min-1条件下离心 10 min,所得上清液即为粗酶液。
羧甲基纤维素酶活力测定[5-6]:取 0.5%CMC—Na(溶于pH值5.0的醋酸—醋酸钠缓冲液)2.0 mL,加入粗酶液1.0 mL。于50℃恒温水浴保持30 min。取出加入 DNS试剂3.0 mL,于沸水浴中放置 10 min。冷却后于540 nm处测定其吸光度值,按DNS法测定还原糖。纤维素酶活力的国际单位为1 mL酶底物反应液1 min内产生相当于1 mg/L葡萄糖的还原糖量,即为1 U。
滤纸酶活力:将 0.03 g的滤纸浸入 1 mL 0.05 mol/L pH值5.0的醋酸—醋酸钠缓冲液中,后加入1.0 mL适当稀释的酶液,在50℃的水浴条件下反应60 min,加入3.0 mL DNS试剂终止反应,沸水浴中煮沸10 min,立即用冷水冷却,于540 nm比色。扣除酶液和底物的空白后,通过标准曲线计算酶活力。
β-糖苷酶(β-Gase)活力:以 1.0 mL 0.5%的水杨素为底物(用0.05 mol/L pH值5.0的醋酸—醋酸钠缓冲液配制),其余同CMC。
微晶纤维素酶活力:1 mL的1%微晶纤维素溶液(用0.05 mol/L pH5.0 的柠檬酸缓冲溶液配制),加入1.0 mL适当稀释的酶液,于50℃反应120 min后,5 000 r/min离心10 min除去不溶物。然后取1.0 mL反应上清液用DNS法测定还原糖,即取1 mL反应上清液,加入 1 mL 0.05 mol/L pH=5.0 的醋酸—醋酸钠缓冲液和3.0 mL DNS试剂,沸水浴中煮沸10 min,冷水冷却后于540 nm比色。
2 结果与分析
2.1 富集和纯化
从菌源土中取8个平行,进行36个小瓶的摇瓶筛选,其中1—10号瓶在28℃恒温培养箱静置培养,11—26号瓶以151 r/min 28℃摇床培养,27—36号瓶在37℃恒温培养箱静置培养。每隔24 h测定纤维素酶活力。
经实验得知,测定1~6 d的纤维素酶活力,1—10号瓶总体在第3天的纤维素酶活力达到最高值,其中9号瓶的纤维素酶活力最高,为8.61 U;其次是3号瓶,达6.95 U。结果充分体现9号瓶与3号瓶中的纤维素降解菌群的酶活力相对较高,为筛选单独菌种做理论基础。而11—26号瓶在第4天时总体达到最高,其中第16号瓶中的微生物菌群的酶活力最高,达到20.10 U;11号与13号瓶的酶活力分别为1.18和 1.60 U,其酶活力要远远小于 16号瓶,可能因为菌群之间相互抑制的作用,或该部分菌群不适应这样的发酵条件与发酵培养基。27—36号瓶中的菌群的纤维素酶活力经实验测得在第2天和第7天均出现峰值。
将筛选得出酶活力高的瓶进行菌落分离与纯化,根据刚果红透明圈直径大小与菌落直径的比值和该酶活力成正比的原理,经羧甲基纤维素琼脂平板与滤纸培养基初筛,筛出19株细菌,分别为a、b、c、d、e、f、g、h、i、j、k、l、m、n、o、p、q、r、s,结果见表 1。可知,a、b、d、h、r、o 6 株细菌水解圈比较大,可为下一步单独发酵培养提供依据。
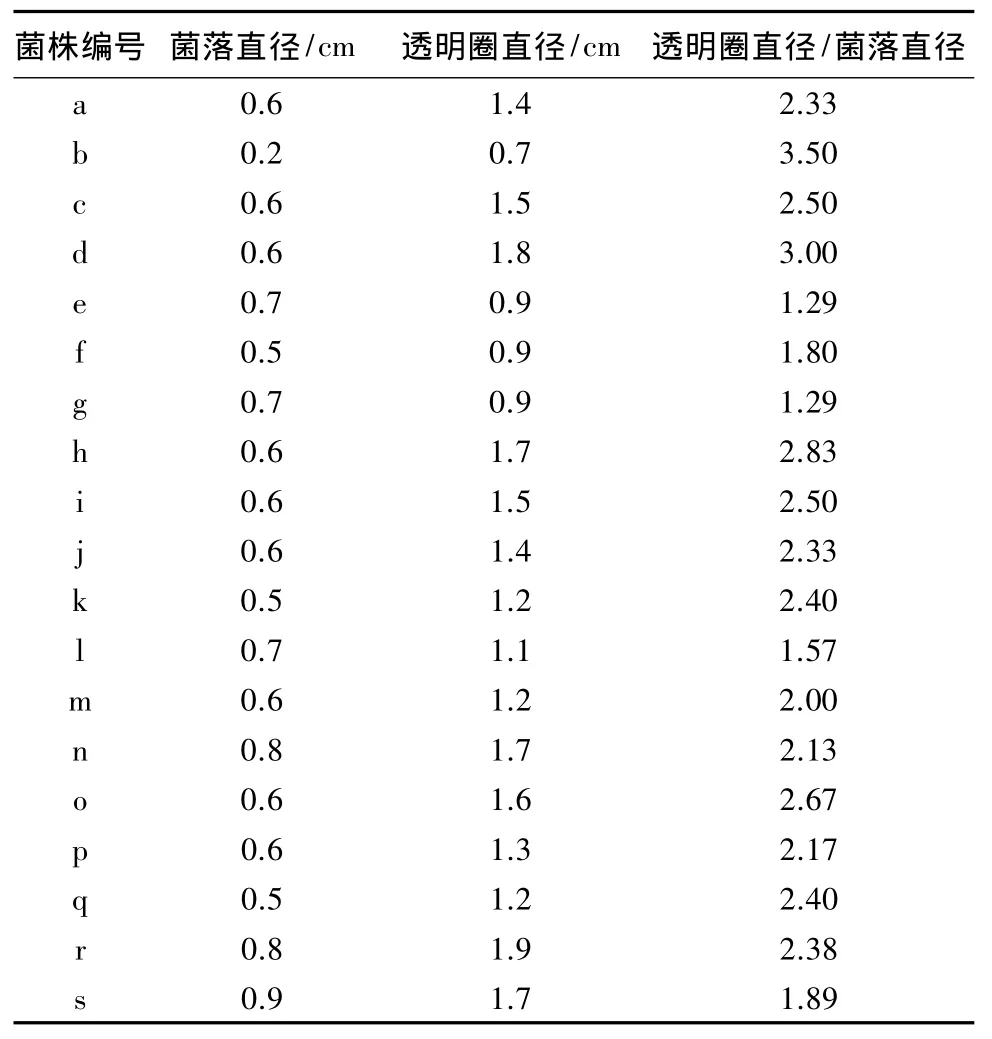
表1 培养24 h的不同细菌菌株的透明圈平均直径
2.2 摇瓶筛选
2.2.1 菌株单独发酵培养
将初筛得到的5株纤维素降解细菌接入到以松针粉为主要碳源的液体发酵培养基中培养,每24h测定羧甲基纤维素、微晶纤维素与滤纸酶活力。
由表2可知,筛选到的6株菌都具有一定的产纤维素酶能力,据文献报道[7]羧甲基纤维素酶活力反映的是纤维素酶组分中内切酶的活性。其中菌株h相对其他菌株酶活力最高,达21.06 U,其次是菌株 d,酶活力 19.35 U;菌株 r,酶活力 16.89 U;菌株b,酶活力 12.93 U。1~9 d,6 株菌均有两个峰值,且第1个峰值高于第2个峰值。
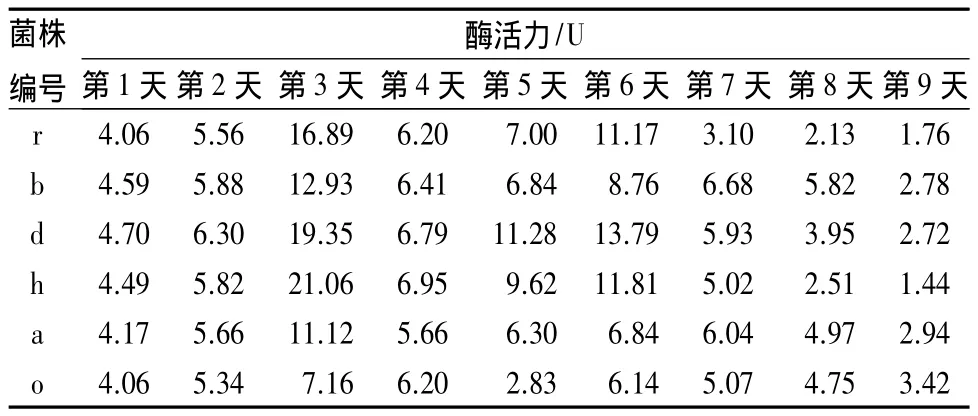
表2 细菌单独培养的羧甲基纤维素酶活力
实验测得这几株菌1~9 d的微晶纤维素酶活力均在第3天和第6天达到峰值,从表3可得出6株菌的纤维素酶活力都在90 U以上,其中菌株b最高,纤维素酶活力可达127.58 U;其次是菌株d,酶活力达121.80 U;再次是菌株h和r,酶活力分别为118.27 U和112.55 U。在达到第2个峰值后酶活力缓慢下降。
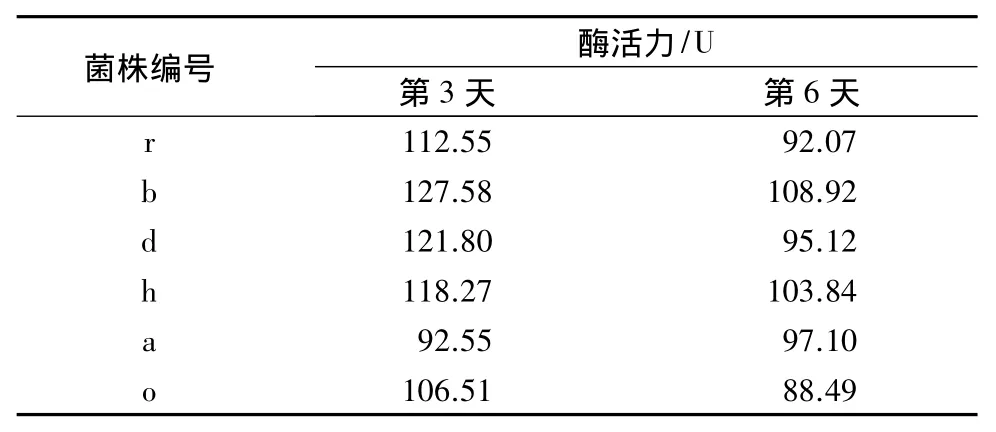
表3 细菌单独培养的微晶纤维素酶活力
可以看出,6株滤纸的酶活力总体从第1天缓慢上升,然后在第3天均达到最高值,菌株r酶活力达66.46 U,菌株 d酶活力达62.77 U,菌株 h酶活力达52.93 U,菌株 b 酶活力 52.15 U,其中菌株 r的滤纸酶活力是6株菌中最高的。
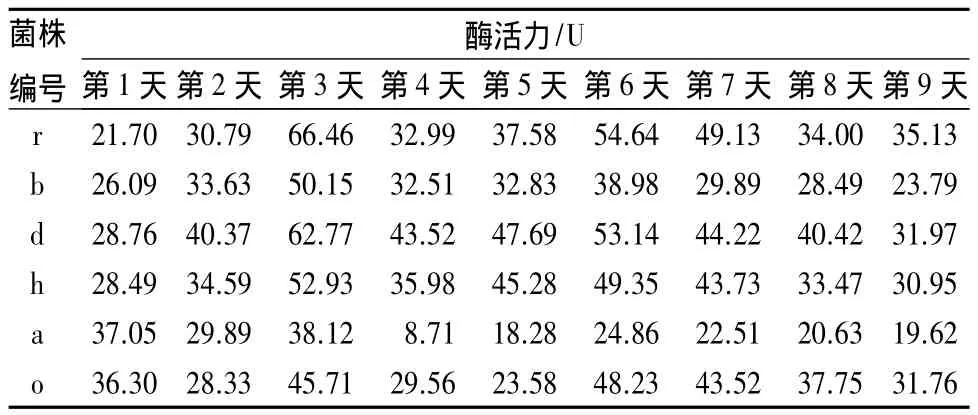
表4 细菌单独培养的滤纸酶活力
可以得出纤维素、微晶纤维素和滤纸酶活力均较高的 4 株菌,分别是菌株 b、d、h、r。
2.2.2 菌株混合发酵培养
将筛选出的4株菌b、d、h、r经过24 h恒温培养,分别以V(菌株)∶V(培养基)=1∶20的比例接种于液体发酵培养基中,进行2~4种混合培养,结果见表5—表8。可以看出,细菌菌株混合培养在一定程度上会提高酶活力。
从表5可以看出混合菌组合中菌株bdh组合的酶活力最高,达31.38 U,远远大于 b、d、h 3 株菌单独培养的最高纤维素酶活力。菌株rd组合的酶活力相对较高,为29.19 U,仅仅低于组合bdh。可以看出,混合菌中菌株相互有促进作用,共同分泌纤维素酶达到高效分解纤维素的目的。
混合菌株组合的微晶纤维素酶活力见表6。1~9 d经历两个峰值,第3天的峰值是最高的。菌株rd组合的微晶纤维素酶活力是最高的,为158.27 U,远远高于其他的组合;其次是菌株bdh组合,酶活力为150.41 U,其他组合基本都很平稳,酶活力没有太大的变化。
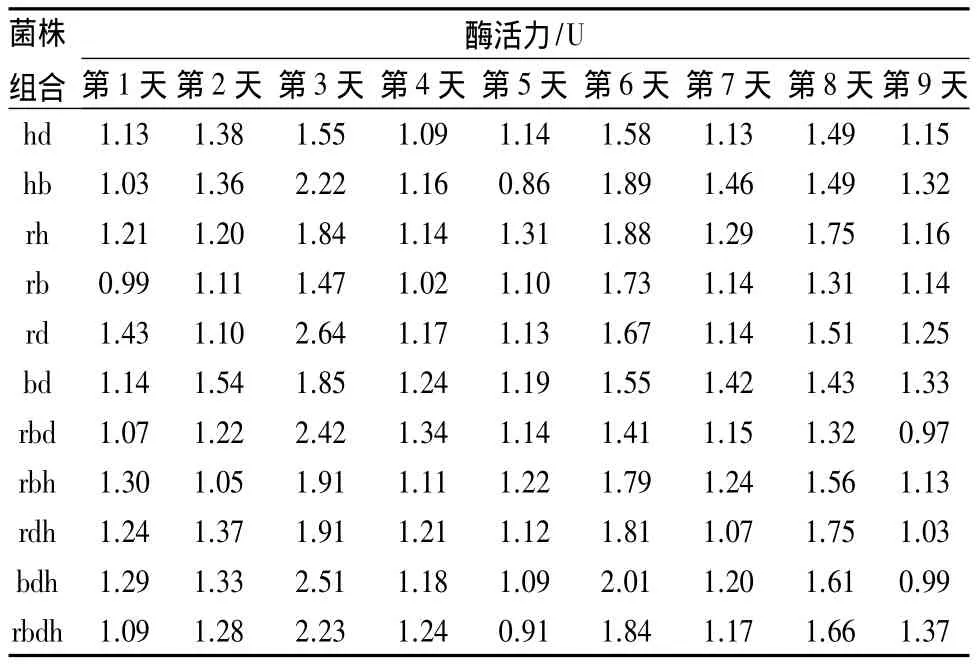
表6 混合菌株组合的微晶纤维素酶活力
混合菌组合的β-葡萄糖苷酶的酶活力见表7。菌株rd组合的β-葡萄糖苷酶酶活力最高,为30.37 U;而菌株 bdh 组合的酶活力为 26.04 U,远远超过别的组合菌株。可以看出菌株rh、bd、bh组合的β-葡萄糖苷酶的酶活力基本没有太大的变化,这3组两株菌的组合中存在着菌株之间的相互作用。而β-葡萄糖苷酶活力高的组合,在菌株混合之后相互促进β-葡萄糖苷酶的分泌。纤维素的酶水解是由外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶系统作用的结果[8]。
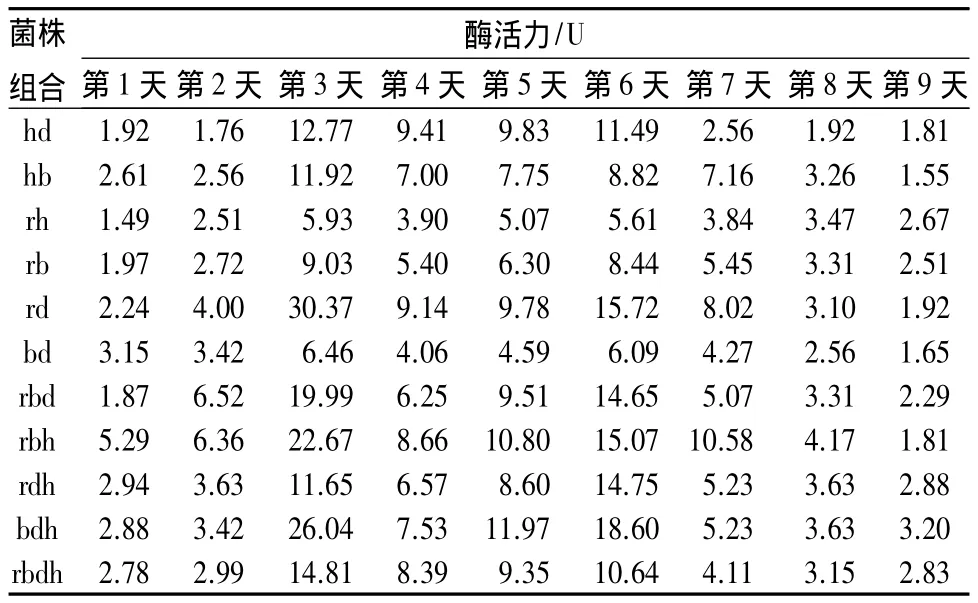
表7 混合菌组合的β-葡萄糖苷酶酶活力
混合菌组合的滤纸酶活力见表8,其中最高的两个组合是菌株rd和菌株bdh组合,酶活力达66.89 U和72.13 U,菌株之间具有协同效应。而rbdh组合酶活力仅仅达53.68 U,可见并不是把各种菌放在一起才会是效果更好,菌株之间存在相互抑制产酶的作用,导致4种菌混合在一起酶活力并没有特别高。从第6天起,各种组合的酶活力缓慢下降。
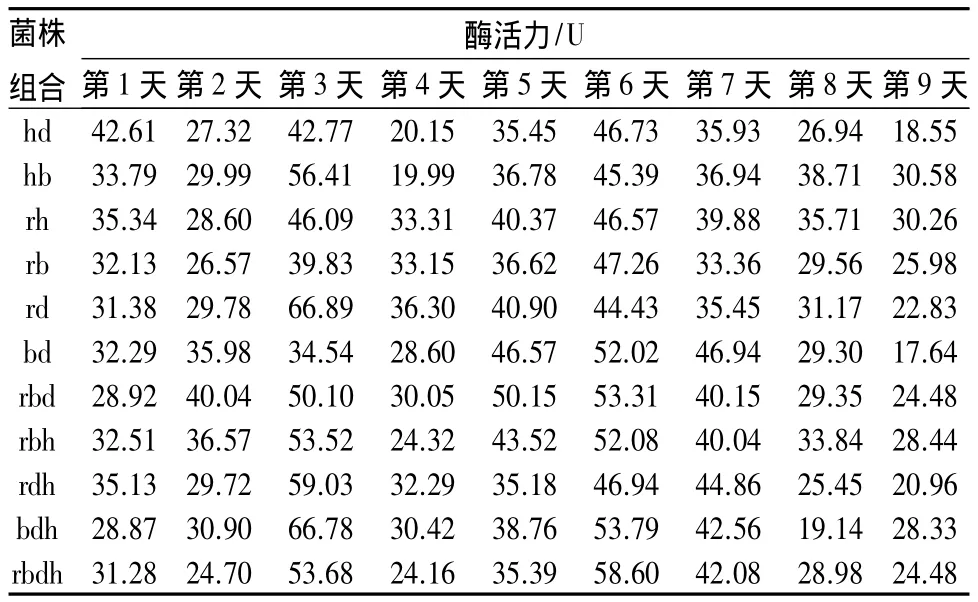
表8 混合菌组合的滤纸酶活力
3 讨论
羧甲基纤维素培养基应用刚果红染色法用于鉴别产纤维素酶的菌株,能初步判定菌株酶活力性的高低,本研究得到的4株细菌,24 h所产生的水解圈最大的为菌株d,但菌株d是哪种菌有待于进一步研究。
综合以往的研究方法,认为单纯通过单独培养的方法获得的纤维素分解单菌在功能发挥上受到很大限制。本研究筛选出的4株较好的纤维素降解细菌b、d、r、h单独发酵培养的酶活力相对没有混合菌的酶活力高,而通过各种菌株组合,最后得出酶活力最高的是rd组合和bdh组合;综合总体酶活力,bdh组合的效果最佳,其具体应用有进一步研究的价值与意义。
本研究采用松针为碳源,筛选产纤维素酶的菌株,由于不同的碳源对菌株产纤维素酶具有不同的诱导能力,而目前普遍认为纤维素酶是一种具有不同底物特异性的多组分酶系。因此,对这些菌种的发酵条件进一步优化,才会更大程度上提高混合细菌降解松针的纤维素酶活力和羧甲基纤维素酶活力。
[1]Font R,Conesa J A,Moltó J,et al.Kinetics of pyrolysis and combustion of pine needles and cones[J].Journal of Analytical and Applied Pyrolysis,2009,47(1/2):276-286.
[2]樊青青,刘艳丽,罗亚田,等.环境中纤维素降解菌群的筛选与降解活性分析[J].四川化工,2009,12(2):48-51.
[3]魏雅琴,李红玉.纤维素高产菌选育研究进展及未来趋势[J].兰州大学学报:自然科学版,2008,44(7):107-114.
[4]林远声,列璞怡.降解纤维素的真菌分离、筛选及其酶活测定[J].中山大学学报:自然科学版,2004,43(Sl.):82-85.
[5]颜霞,秦魏.降解纤维素真菌的分离筛选及其环境适应性初探[J].中国农学通报,2008,24(5):44-49.
[6]刘韫滔,禤淑霞,龙传南,等.纤维素降解菌L-06的筛选、鉴定及其产酶条件的分析[J].生物工程学报,2008,24(6):1112-1116.
[7]张宇,尹依婷,许敬亮,等.高效纤维素降解茵的筛选及其系统发育分析[J].太阳能学报,2009,30(1):103-106.
[8]Natividad Ortega,María D Busto,Manuel Perez-Mateos.Kinetics of cellulose saccharification by Trichoderma reesei cellulases[J].International Biodeterioration & Biodegradation,2001,47(1):7-14.
