棘孢木霉对青蒿生长量及土壤水解氮质量分数的影响
2014-03-06张荣沭吕曼曼朱国栋
唐 磊 赵 敏 张荣沭 韩 颂 吕曼曼 王 慧 朱国栋
(东北林业大学,哈尔滨,150040)
木霉(Trichoderma sp.)作为一种新型的生防因子[1-2],在改善土壤生态环境方面,具有提高肥料利用率、平衡土壤结构,对生态环境进行生物修复的积极作用。据文献[3]记载,棘孢木霉(T.asperellum)能有效提高植物种子的发芽成活率,且在生长量、花期以及提高作物产量方面有显著作用。然而,以往有关木霉菌促进植物生长的相关研究中,对草本植物的诱导及其种类较为单一,木本占据多数。而两者无论从生理生化、结构形态,还是发育过程等方面,都有显著差异。黄花蒿(Artemisia annua)又名青蒿,菊科艾属,1年生草本;性寒味苦,作为民间传统中药,具有退热止汗、消暑截疟的功效[4],然而,有关棘孢木霉ACCC30536 根施青蒿并促进其生长的研究少有报道。土壤中的氮、磷、钾是供给植物营养的三大元素,其中氮素营养在土壤中主要以矿质态和易水解态存在。土壤中水解氮的量,既可对土壤肥力作出有效测评,又可为农业施肥标准提供理论依据[5]。本文以黄花蒿为基础实验材料,通过根施棘孢木霉进行诱导,对土壤中水解氮的量以及青蒿生长量进行分析讨论,旨在为今后的农、林、牧业生产及生物菌肥的应用与改进提供参考。
1 材料与方法
1.1 实验材料
选择专业育苗纸筒5 块,每块60 ~70 个小纸筒,内外相连;将筛选好的青蒿种子均匀撒在上面,期间保证温度适宜、采光充足、水量供应及时。待青蒿幼苗温室内培育45 d 后,转移至东北林业大学苗圃实验基地;早晚浇水2 次,定期除草、间苗、松土。7月10日对根部进行悬浮液的诱导。实验用棘孢木霉ACCC30536(T.asperellum ACCC30536)菌株,来自中国农业微生物菌种保藏中心;供试土壤为哈尔滨市郊外的农田栽培用土。
1.2 实验方法
悬浮液的配制:将棘孢木霉的分生孢子在无菌操作台上接种至培养皿中,培养基为马铃薯葡萄糖琼脂(PDA)固体培养基,温度控制在25 ℃连续培养10 d,即可分离出大量分生孢子。将分生孢子悬浮液进行不同棘孢木霉菌量浓度梯度的稀释后,显微镜下观察棘孢木霉菌的数量,最后用纯净水配制成实验所需棘孢木霉菌量浓度,即土壤样品中5×102(T1)、5×103(T2)、5×104菌落/cm3(T3)3 个梯度。
青蒿育苗:将青蒿种子与细沙混合均匀,再均匀地撒在浇过水的装满土的纸筒上;撒种后的前3 d用透明的塑料薄膜把上方封闭好,待发出青蒿幼芽后,将薄膜撤去,期间保证棚内的温度适宜、阳光充足、适时供给充足的水量。间苗——生长过程中,定时拔除杂草,防止其阻碍青蒿苗生长,当青蒿苗长的足够茁壮以后,选择粗壮的苗留下,保证一孔一苗,拔除其他的苗。移植——将粗壮的苗移栽到地里生长30 d 左右,期间定时除草、松土、保障充足的水量,以确保苗的成活率。浇菌——7月10日开始用T1、T2、T3悬浮液进行浇菌诱导,具体分组及方案设计:实验样地分为不种植青蒿和种植青蒿2 大组,其中第1 大组(不种植青蒿)包括4 个实验小组,第1实验小组为不种植青蒿且不施用棘孢木霉菌,记作A;第2、3、4 实验小组均不种植青蒿苗,但对应施用T1、T2、T3的木霉菌,分别记作A1、A2、A3。第2 大组(种植青蒿)包括4 个实验小组,即第5 实验小组种植青蒿苗,但不施用木霉菌,记作B,让其在自然条件下生长,以形成对照;第6、7、8 实验小组均种植青蒿,并对应施用T1、T2、T3的木霉菌,分别记作B1、B2、B3。在每组中分别抽取10 株青蒿植物做编号标记处理,用于7 个不同时间点监测其生物量、生长量以及进行土壤样品的采集。
1.3 土壤采样方法
每组诱导各取10 株青蒿的土样,每株约100 g,深度为5~8 cm,取样的时间点分别是8、15、30、45、60 d,同时每组设置3 次平行实验取平均值。进行土壤水解氮质量分数检测之前,需将土样做风干处理,按不同时间点装入密封袋中,待测。
1.4 青蒿生物量检测及生长量的测量
生物量检测:诱导60 d 后,对青蒿的根、茎、叶等不同组织部位进行分离处理,先称量不同组织部位的鲜质量,干燥后再测出干质量,最后进行计算分析。生长量测定:7月10日诱导后,每间隔10 d 分别测量青蒿的主茎高和茎基粗,并计算出相邻时间点各自的差值,记录青蒿诱导后的生长变化过程。分析棘孢木霉菌对青蒿生物量和生长量产生的影响。
1.5 土壤水解氮的检测
本实验选用“碱解—扩散法”[6]测定土壤中水解氮的质量分数,并将不种植青蒿的土壤(A、A1、A2、A3)与种植青蒿的土壤(B、B1、B2、B3)进行比较,从中得出不同处理间水解氮质量分数的差异。
1.6 数据处理
用SPSS19.0 和Microsoft office excel 2003 软件对数据进行统计分析;在青蒿生长量与土壤水解氮质量分数的动态变化之间进行Pearson 相关性分析;在P=0.05、P=0.01 条件下比较差异性,对不同悬浮液量浓度诱导所产生的差异显著性进行方差分析和讨论。
2 结果与分析
2.1 不同量浓度棘孢木霉诱导对青蒿生长量的影响
表1中结果显示:7月10日开始对青蒿根施不同量浓度的棘孢木霉分生孢子悬浮液后,青蒿苗的长势明显。从表2可见:在7月20日—8月20日之间,增高的幅度明显高于其他月份,特别是至8月20日达到最大,B2组的青蒿主茎高生长量为21.41 cm,是对照组(B)的1.38 倍;而在诱导后的10 d(7月10—20日)和生长过程的后10 d(8月30日—9月10日),长势明显低于中间月份,主茎高生长量分别为16.92、17.58 cm。在诱导40 d 后,B1、B2、B3组的青蒿主茎高增长最为明显,其生长量分别为对照组(B)的1.24、1.38、1.28 倍;在木霉菌诱导50 d后,B2组的株高生长量依然保持在20.55 cm,而B1、B3两组生长速度则比较缓慢,B2组株高生长量的差值分别为B、B1、B3组的1.31、1.34、1.18 倍(见表2)。说明B2组在诱导之后,生长周期长且株高生长量差值大于其他3 个组;B2组在诱导后60 d 内的株高生长量,是对照组(B)株高生长量的1.34 倍,差异更为显著。
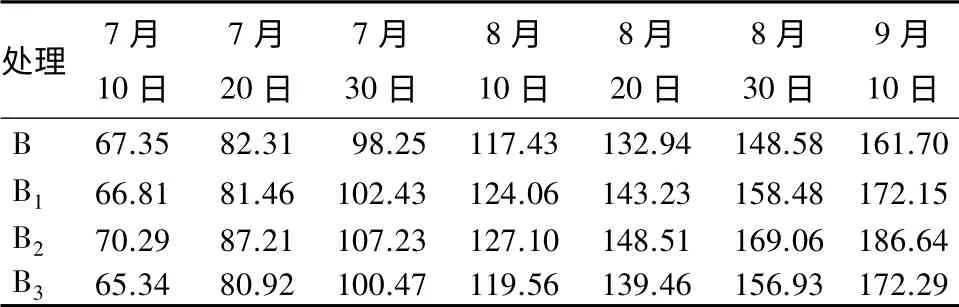
表1 不同量浓度棘孢木霉诱导后青蒿的主茎高的比较cm
从表3可以看出:7月10日开始,对青蒿根施不同量浓度的棘孢木霉分生孢子悬浮液后,茎基随着不同时间点的推移逐渐增粗。诱导组B2在7月10日至8月10日,茎基粗增长最为明显;特别在诱导20 d 后,B2组茎基粗生长量为0.84 cm,是B 组茎基的1.47 倍;8月10日至9月10日,茎基粗的增长幅度逐渐减小,平均差值维持在0.59 cm。从表4可见:B2组的规律为,茎基粗生长差值,先缓慢增高,而后逐渐减小并趋于平缓稳定;对照组(B),在自然状态下生长,波动不明显,茎基粗生长量在0.4 ~0.5 cm。诱导组B1、B3,在7月30日之后增粗的速度相近,之前时间点B1组的大于B3组的。诱导40 d 后,对B2组进行测量,计算得出其茎基粗的平均值为6.95 cm,是对照组(B)的1.05 倍(P<0.01);诱导6 0 d 后,B2组的平均茎基粗是B、B1、B3的1.06、1.07、1.04 倍(P<0.01),7月30日之后,B1、B3组差异不明显。
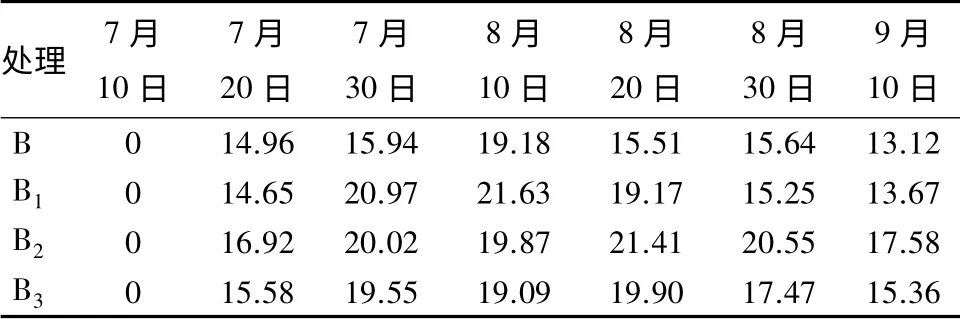
表2 不同量浓度棘孢木霉诱导后青蒿的主茎高每10 d内的生长量 cm

表3 不同量浓度棘孢木霉诱导后青蒿的茎基粗的比较 cm

表4 不同量浓度棘孢木霉诱导后青蒿的茎基粗每10 d内的生长量 cm
2.2 不同量浓度棘孢木霉诱导对青蒿生物量的影响
对黄花蒿根部施用不同量浓度的棘孢木霉分生孢子悬浮液诱导60 d 后,分别对不同组织部位进行样品的处理和收集,并称量根、茎、叶样品的鲜质量;参照Cornelissen 等[7]方法对样品进行干燥处理,称量干质量;对数据进行SPSS 分析(见表5)。由表5可见:B2组单株样品根、茎、叶鲜质量均为最高,平均值分别为130.776、414.049、223.122 g,是对照组(B)的1.26、1.45、1.42 倍,其中,单株根的质量较B1、B3增加了88.74%、58.45%;B2组的根、茎、叶干质量平均值也均为最高,分别为55.029、157.771、69.399 g,是对照组(B)的1.19、1.56、1.38 倍。在不同时间点,B 和B1组的鲜质量、干质量相近,B3组相比略高;总体生物量比较,从大到小顺序依次为B2、B3、B、B1。

表5 青蒿诱导后不同组织部位的生物量比较 g
2.3 不同量浓度棘孢木霉诱导对土壤水解氮质量分数的影响
由表6可见:对照组的水解氮质量分数最大值出现在A3组中,为216.24 mg/kg。同组内施用木霉45 d 后,相对A、A1、A2组分别提高16.64%、13.41%、9.74%(P<0.01);在诱导60 d 后,水解氮质量分数依然维持在186.55 mg/kg,是A 组的1.24 倍。可见,随着施用木霉菌量浓度的增加,与土壤相互作用,水解氮质量分数明显升高。
由表6可见:B2组在诱导30 d 后,水解氮质量分数达到最高,是同组中B、B1、B3组的1.65、1.53、1.26 倍;与A、A1、A2组相比较,分别提高19.62%、21.03%、10.4%(P<0.01)。可见,植物在生长发育过程,要吸收土壤中的氮元素;适量浓度的木霉菌与青蒿相互作用后,对土壤中水解氮质量分数产生影响,故从T1到T2再至T3的试验过程中,水解氮质量分数从总体上呈现先升高后降低的变化规律。
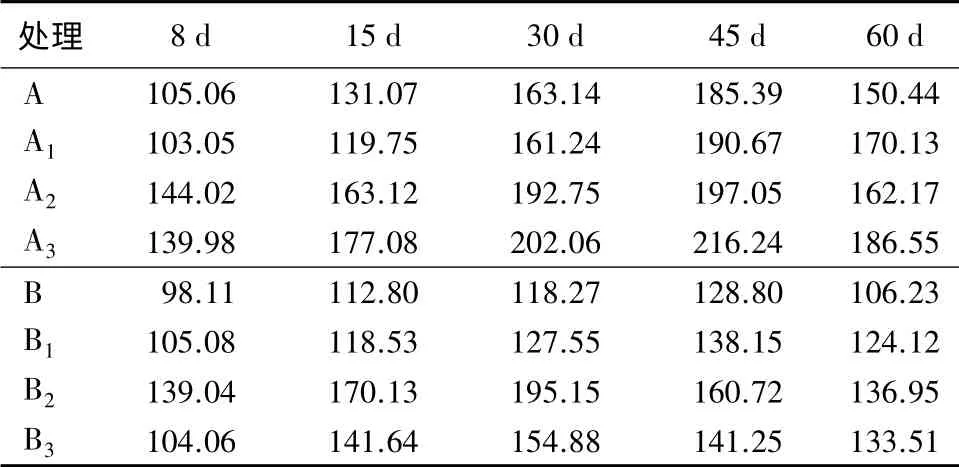
表6 不同量浓度棘孢木霉诱导后各时间点的土壤水解氮质量分数 mg·kg-1
2.4 青蒿生长量与土壤水解氮的相关性
不同量浓度木霉菌诱导青蒿后,主茎高与茎基粗呈正相关,相关系数分别为RB=0.985、RB1=0.971、RB2=0.986、RB3=0.989,P<0.01。在主茎高与种植青蒿的土壤水解氮分析中,相关性不显著(P>0.05);主茎高与B2、B3组处理呈正相关,相关系数分别为RB2=0.003、RB3=0.218;主茎高与B1、B 组处理呈负相关,相关系数分别为RB1=-0.072、RB=-0.214。在茎基粗与种植青蒿的土壤水解氮质量分数分析中,相关性不显著(P>0.05);茎基粗与B3组处理呈正相关,相关系数为RB3=0.311;茎基粗与B1、B2、B 组处理呈负相关,相关系数分别为RB=-0.014、RB1=-289、RB2=-0.029。
3 结论与讨论
以T1、T2、T3不同量浓度棘孢木霉分生孢子悬浮液根施诱导青蒿60 d,试验结果表明:棘孢木霉具有促进青蒿生长和改善土壤水解氮质量分数的作用,且最佳诱导为T2(土壤中5×103菌落/cm3)。主茎高生长量,在7月20日至8月20日之间达到生长高峰,平均值为21.41 cm,是对照组(B)的1.38倍。茎基周长在诱导20 d 后生长量达到0.84 cm,为同组最高。根、茎、叶生物量鲜质量和干质量,由高到低组别依次是B2、B3、B、B1。对照组的水解氮质量分数B3组最高,最大值为216.24 mg/kg,可以看出,棘孢木霉与土壤相互作用,能有效提高水解氮质量分数,但要控制好施用剂量。实验组中,水解氮质量分数最大值出现在T2诱导30 d 后,总体呈现先升高后下降的特点,但最大值和平均值均高于对照组。分析认为,植物的氮素营养主要依靠土壤供给,而适量的木霉量浓度与青蒿相互作用,改变了土壤中的水解氮质量分数,使青蒿在生长过程中获得充足可靠的氮源;株高与茎基周长呈正相关性,而生长量受多种土壤营养元素的影响,与土壤水解氮的动态相关性不显著,其他土壤营养元素如磷、钾等受棘孢木霉诱导而引起的相关性变化,有待于进一步讨论和分析。
[1] Sun Haiyan,Ge Xiangyang,Hao Zhikui,et al.Cellulase production by Trichoderma sp on apple pomace under solid state fermentation[J].African Journal of Biotechnology,2010,9(2):163-166.
[2] Sofo A,Tataranni G,Xiloyannis C,et al.Direct effects of Trichoderma harzianum strain T-22 on micropropagated shoots of GiSeLa6®(Prunus cerasus×Prunus canescens)rootstock[J].Environmental and Experimental Botany,2012,76:33-38.
[3] Mukherjee P,Roy M,Mandal B P,et al.Green synthesis of highly stabilized nanocrystalline silver particles by a non-pathogenic and agriculturally important fungus T.asperellum[J].Nanotechnology,2008,19(7):075103.
[4] 王鸿博,肖皖,华会明,等.黄花蒿的化学成分研究进展[J].现代药物与临床,2011,26(6):430-433.
[5] 马少杰,李正才,周本智,等.北亚热带天然次生林封山育林对土壤肥力质量的影响[J].江西农业大学学报,2011,33(2):328-334.
[6] 李金彦.土壤水解性氮的测定:碱解扩散法[J].农业科技与信息,2010(10):15.
[7] 冯丽,张景光,张志山,等.腾格里沙漠人工固沙植被中油蒿的生长及生物量分配动态[J].植物生态学报,2009,33(6):1132-1139.
