内耳注入携带IL-4基因的骨髓间充质干细胞对豚鼠免疫性内耳病基因治疗的研究△
2014-06-12郭浪谭长强刘树森江萍衡伟伟
郭浪 谭长强 刘树森 江萍 衡伟伟
骨髓间充质干细胞(bone-marrow mesenchymal stem cells, BMSCs)具有多向分化潜能及在体内可向急性损伤部位迁移的特性,已成为干细胞治疗研究的热点,也逐渐成为基因治疗的主要靶细胞之一。体外实验显示基因转染的BMSCs能较长时间表达外源基因,这使得基因修饰的BMSCs治疗疾病成为可能。利用慢病毒载体能高效感染骨髓间充质干细胞,使其成为基因治疗的载体再植入内耳的方法,与重组慢病毒载体直接注入转染内耳组织相比较,可准确了解和调控导入基因的量;通过体内该载体干细胞移植,使治疗基因更集中在病变部位,减少病毒载体的使用量从而减少不良事件的发生;而且已有研究证实BMSCs对许多自身免疫性疾病的免疫炎性病理损伤有较好的调节和治疗效果[1]。
白细胞介素4(IL-4)是Ⅱ型辅助T细胞(Th2细胞)分泌的细胞因子,它在调节体液免疫和适应性免疫中起关键作用。IL-4质粒或腺相关病毒介导的IL-4基因,经肌肉注射或关节腔内注射可使类风湿性关节炎病变得到缓解[2]。研究发现IL-4与凋亡蛋白FasL联合作为免疫性损伤治疗均可达到抗炎目的[3]。因此,本研究选择BMSCs作为IL-4基因的细胞载体,注入免疫性内耳病豚鼠之内耳,探讨其对免疫性内耳病的炎性损伤及由此所造成的听觉功能障碍的影响和治疗作用。
1 材料与方法
1.1实验动物 健康6~8周龄白毛红目豚鼠65只,雌雄不拘,体重250~300 g,耳廓反射正常,耳镜检查排除中耳疾患,所有动物均由南京青龙山动物养殖场提供。
1.2抗原 钥孔嘁血蓝蛋白(keyhole limpet hemocyani, KLH):为一种深海的软体动物体内提取的纯化蛋白(购自美国sigma公司)。
1.3免疫性内耳病动物模型制备 500 μg KLH溶解于250 μl PBS中,与等量完全弗氏佐剂混匀后,注射于豚鼠右后足垫。2周后,500 μg KLH溶解于250 μl PBS中,与等量不完全弗氏佐剂混匀,背部多点皮下注射,加强免疫。2周后,再在圆窗龛局部免疫。最后一次加强免疫两周后,依据听觉诱发电位波Ⅲ的阈值升高(超过免疫前全部动物均值2倍标准差)和血清中抗KLH特异性抗体水平升高(ELISA法,波长490 nm,A值超过免疫前全部动物均值加2倍标准差),判断为免疫性内耳病模型动物[4]。共有55只动物造模成功。
1.4BMSCs的获取、培养与标记
1.4.1取股骨 取3~4周、体重250 g左右白毛红目豚鼠,乙醚麻醉后,断颈处死,剪开大腿部皮肤,肌肉,暴露股骨,注意勿损伤血管,分离出两侧股骨,置于培养皿中的灭菌PBS液中,浸泡5分钟。
1.4.2分离、培养BMSCs 含10%胎牛血清的DMEM低糖培养基5 ml置于培养皿中,剪断股骨两端,用5 ml注射器反复吹出股骨中的骨髓组织,均匀后离心,弃上清及脂肪层,加入培养基,细胞计数,调整细胞密度接种在培养瓶中(以上操作均在超净台中进行)。
1.4.3培养与传代 待细胞密度达到80%~90%基本融合后,用0.25%的胰蛋白酶消化,1:2的比例继续传代培养。
1.4.4BMSCs获取 利用改良直接贴壁法[5,6]获得豚鼠BMSCs,置于DMEM培养基中培养、传代。传代3次后,获得纯度较高的BMSCs(图1),备慢病毒感染使用。
1.5慢病毒载体的包装和重组慢病毒载体的鉴定
1.5.1慢病毒载体的包装和标记 慢病毒载体包膜质粒pVSG,包装质粒pHELPER、载体质粒pNL-IRES2.EGFP按1:1:1的比例混匀,总量8 mg,加入高糖DMEM培养基至0.5 ml,混合均匀。经过室温孵育、更换培养液等流程,24 h后荧光显微镜观察转染情况。转染后48、72 h收集含病毒上清,4 500 r/min离心20 min收集上清,保存于-70 ℃备用(上海迪奥生物科研所提供)。
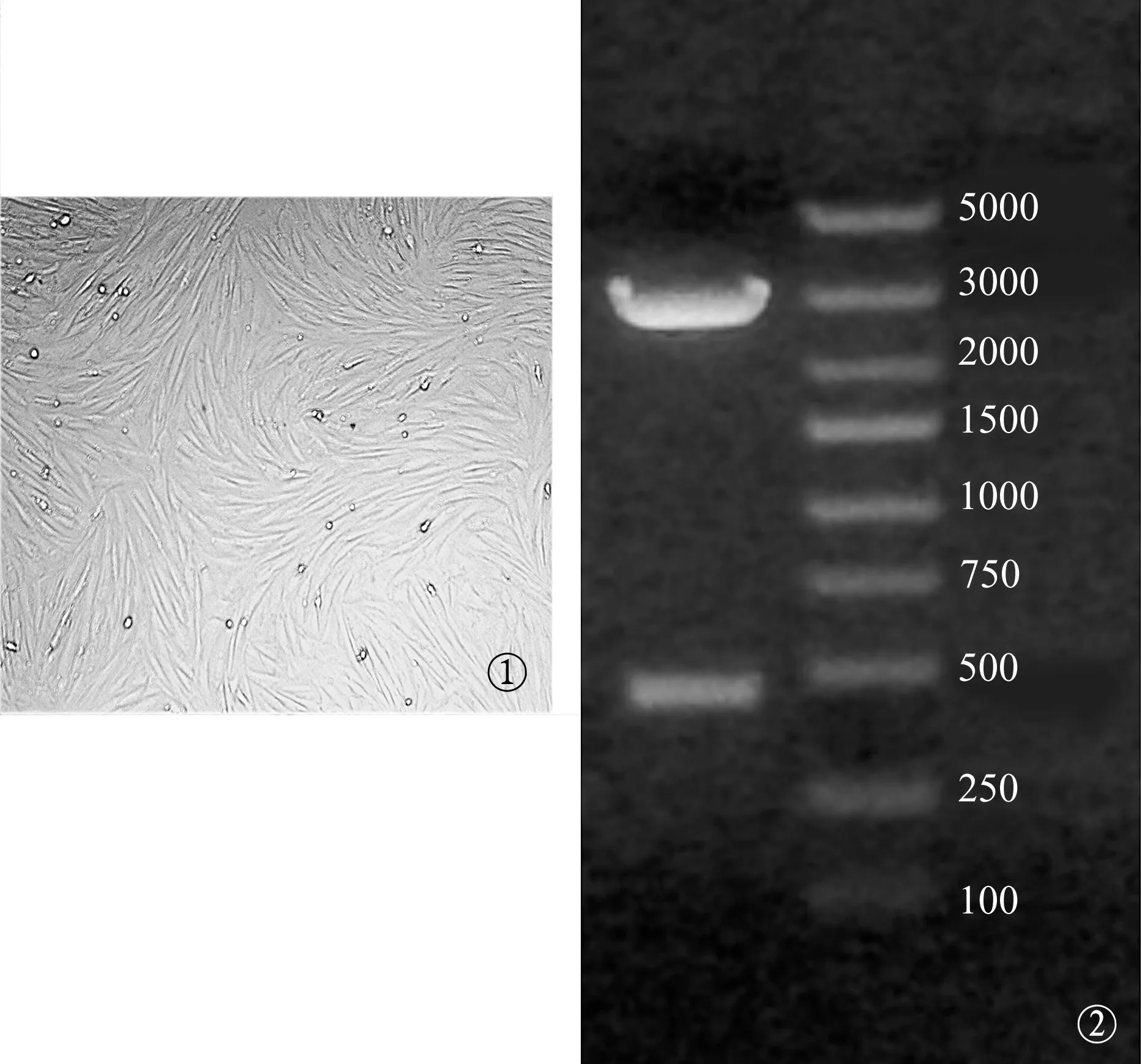
图1 倒置显微镜下见到的第三代BMSCs(×100)呈均匀一致的纺锤形,融合成旋涡状
5.2重组慢病毒pll3.7-IL-4鉴定 将pll3.7-IL-4慢病毒液2ml感染80%融合的293细胞,待单层细胞大部分变圆但尚未脱落时收集细胞,反复冻融3次,取少许提取慢病毒DNA,进行PCR鉴定(图2)。
1.6慢病毒载体感染BMSCs 体外培养的BMSCs扩增至第3代,细胞达80%融合,吸弃培养基,每个25 cm2细胞培养瓶加入1×108/ml重组IL-4慢病毒15 μl,同时加入聚凝胺至终浓度为8 mg/L,8 h后更换为低糖DMEM完全培养液继续培养,24 h后荧光显微镜观察,并复染;48 h后在荧光显微镜下观察绿色荧光蛋白的表达,阳性呈明亮的黄绿色(图3,A、B、C、D组均可见绿色荧光);当细胞融合达90%,可进行传代。以慢病毒感染BMSCs的cDNA为模板进行PCR检测慢病毒载体基因(图4)。空载BMSCs制取步骤同上,但感染BMSCs的慢病毒为未重组IL-4基因的空载体。感染成功的BMSCs备用于内耳植入。
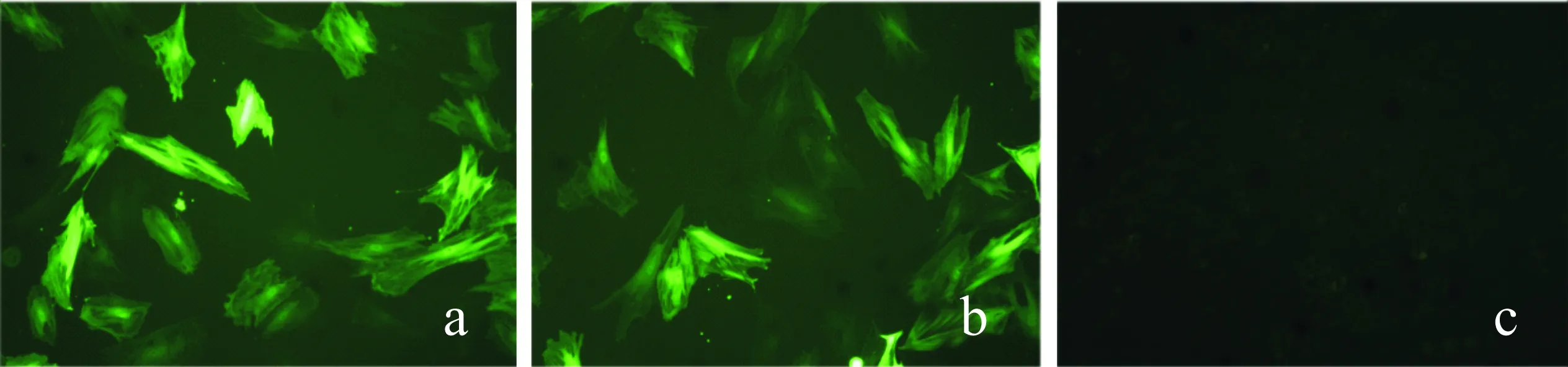
图3 慢病毒感染BMSCs 48 h后荧光显微镜下图像(×200) a、b示A、B组均可见绿色荧光,c示E组未见荧光显示
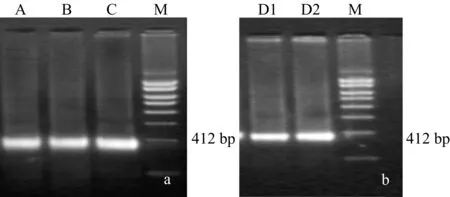
图4 RT-PCR分析结果
1.7实验分组和BMSCs的内耳移植(重组基因载体鼓阶内注射)
1.7.1分组 将造模成功的55只模型动物按配对设计分为A、B、C、D、E五组(每组11只): BMSCs载体组(A组):内耳注入重组慢病毒感染成功的IL-4基因修饰BMSCs悬液;BMSCs空载体对照组(B组):内耳注入未携带IL-4基因慢病毒空载体感染成功的BMSCs悬液;重组慢病毒IL-4基因组(C组):内耳注入重组慢病毒IL-4基因稀释液;慢病毒空载体对照组(D组):内耳注入慢病毒空载体稀释液;模拟手术对照组(E组):内耳注入PBS溶液。其中A、B为细胞植入组,C、D为慢病毒组。注入的液体量均为20 μl[(BMSCs悬液中约含BMSCs(1.5~2.0)×106,慢病毒浓缩液浓度为0.5×108pfu]。
1.7.2BMSCs及重组慢病毒内耳的注入 将上述感染成功的BMSCs(G3)用胰酶消化、离心并进行细胞计数后,制备成(1.0~2.0)×1010/L的细胞悬液;将重组慢病毒浓缩液用PBS液稀释为浓度为0.5×108pfu的液体;圆窗龛局部免疫后2周,豚鼠麻醉后,在耳廓后方作一切口,分离皮下肌肉与筋膜,显露听泡,用微型电钻打开听泡,暴露耳蜗底回,在鼓阶侧壁的骨壁钻一针尖大小的孔(不穿透内骨膜),用微推进器将小儿头皮针的针尖插入鼓阶,深度不超过1 mm,先抽掉等量的外淋巴液,依据分组,用微量注射机将BMSC细胞悬液、重组慢病毒液或PBS(1 μl/min)注入鼓阶,骨蜡封闭耳蜗底回的骨孔。抗生素冲洗中耳腔三次,骨蜡封闭听泡骨孔,逐层缝合伤口。所有操作均在无菌条件下进行。
1.8观察指标
1.8.1特异性免疫反应测试 分别于免疫前、圆窗龛局部免疫后2周、鼓阶内植入术后1周(即末次听觉功能测试后)采用酶联免疫吸附试验(ELISA)检测特异性血清中抗KLH抗体水平。心脏采血(每组各取2只动物),分离血清,经包被、封闭、孵育、洗版五次后加入3,3,5,5-四甲基联苯胺(3,3,5,5-tetramethyl benzidine, TMB)底物溶液,显色10 min后,用H2SO4终止显色,在酶标仪下测定波长为490 nm的吸光度A值。
1.8.2ABR测试 分别于免疫前、圆窗龛局部免疫后2周、鼓阶内植入术后1周,采用BioSig SystemⅢ听觉研究系统(TDT system 3)(美国TDT公司)测试ABR。
1.8.3内耳光镜观察 各组分别于圆窗龛局部免疫后2周、鼓阶内植入术后1周,ABR测试后,每次各取2只豚鼠,麻醉后断头,立即取出颞骨,打开听泡,常规脱水、透明、浸蜡、定向包埋。耳蜗中轴切片,片厚5 μm,漂片、捞片、粘片,常规HE染色,封片,光镜观察和照相。
1.8.4免疫组织化学染色
1.8.4.1内耳石蜡包埋和切片制备 各组于鼓阶内植入术后1周,听觉测试后,将剩余豚鼠麻醉、断头,取出听泡,挑开圆窗,在蜗尖钻一小孔,快速灌注数次,固定12小时,采用EDTA脱钙一周,常规脱水、透明、浸蜡、定向包埋。
1.8.4.2免疫荧光染色 每组4只(8耳)的蜡块行耳蜗中轴切片,片厚4 μm,漂片、捞片、粘片后常规脱蜡至水,在荧光显微镜下行染色显影观察和照相。
1.8.4.3酶免疫组织化学染色 每组3只(6耳)按上述方法获得耳蜗石蜡切片,用胰酶修复抗原,血清封闭、孵育、DAB染色, 树脂封片, 光学显微镜观察照相。
1.9统计学方法 用t检验对各组实验结果进行统计学比较。
2 结果
2.1特异性免疫反应试验结果 与免疫前相比,各实验组和对照组免疫后血清中抗KLH抗体水平均明显升高,差异有统计学意义(P<0.05);免疫前、免疫后的各组间对比,差异无统计学意义(P>0.05);细胞植入内耳后与免疫后结果相比,差异无统计学意义(P>0.05)(表1)。

表1 各组免疫前后和鼓阶注射后血清中针对KLH抗体水平(A值,
注:*与同组免疫前比较,P<0.05
2.2ABR检测结果 各组ABR波Ⅲ反应阈见表2,与免疫前相比,免疫后各组ABR阈值升高,差异均有统计学意义(P<0.05)。与KLH抗原免疫后相比, A、B和C组鼓阶植入IL-4基因的重组慢血毒载体后ABR平均阈值降低,差异均有统计学意义(P<0.05),A组平均阈值降低更为明显, D、E组鼓阶植入前后对比,差异无统计学意义。各组分别以其免疫后的ABR平均阈值减2倍标准差作为判断治疗后听功能改善标准,A组有9只(16耳)、B组有8只(15耳)、C组有7只(12耳)局部基因治疗后听功能改善,治疗有效率分别为72.73%(16/22)、68.18%(15/22)和54.55%(12/22),各组分别有1或2耳并发中耳腔感染不计。D、E两组内耳局部给药后听功能无明显改善。
表2 各组免疫前后及鼓阶植入重组基因载体后ABR反应阈
注:*与免疫前同侧耳比较,P<0.05;△与免疫后同侧耳比较,P<0.05
2.3内耳光镜观察结果(图5) E组免疫后耳蜗纵轴切片见鼓阶内出现积(出)血,B组内耳细胞植入1周后耳蜗纵轴切片可见鼓阶内有絮状物,D组内耳空载慢病毒注入后1周耳蜗纵轴切片见螺旋神经节内出现明显炎性细胞浸润,A组内耳局部转染细胞植入后1周耳蜗纵轴切片见螺旋神经节结构基本正常,C组内耳慢病毒IL-4注入后耳蜗纵轴切片可见除鼓阶漂浮样絮状物外,其余未见明显异常。
2.4免疫荧光组织化学试验结果
2.4.1细胞免疫荧光自显影观察 鼓阶内局部注射一周后,A组(图6a)和B组(图6b)鼓阶内有显著荧光反应的细胞团块,A组血管纹亦有荧光显色,B组前庭膜下、骨螺旋板唇部、Corti器等部位亦有荧光显示。A、B组见细胞有向前庭阶及基底膜等处迁移的改变(图6c、d),而E组(图6e)则未见明显荧光显色。
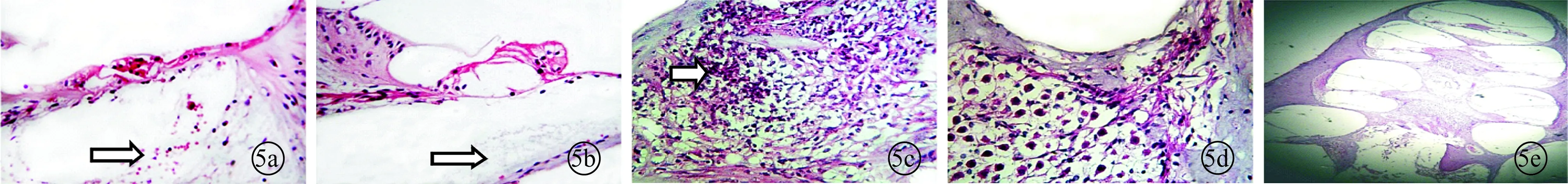
图5 各组内耳光镜观察结果 a~d分别为E、B、D、A组(×400);e为C组(×100)
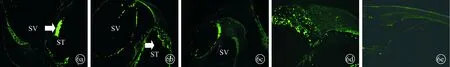
图6 A、B两组细胞免疫荧光染色观察结果(×200)
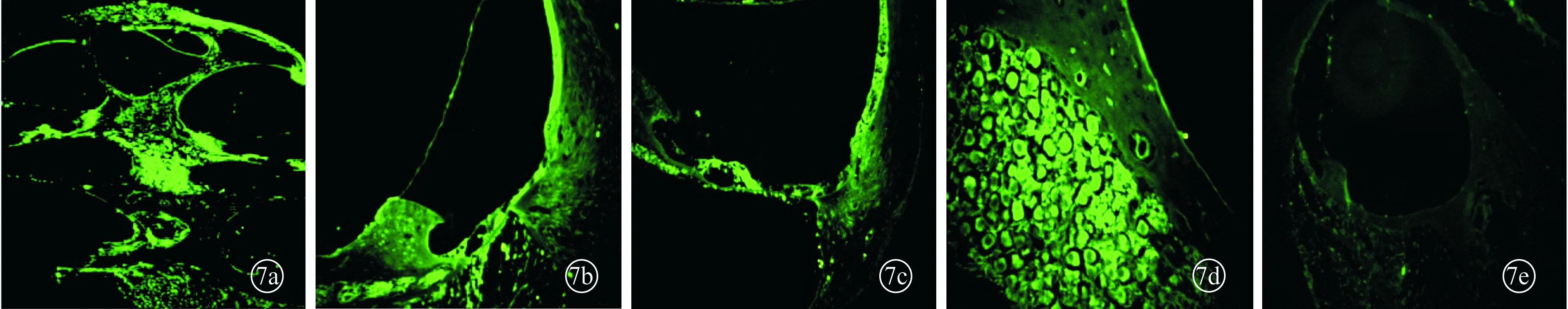
图7 C、D两组耳蜗纵轴切片慢病毒免疫荧光染色观察结果

图8 各组耳蜗纵轴切片酶免疫组织化学染色观察结果
2.4.2慢病毒免疫荧光观察结果 见图7。
2.5各组酶免疫组织化学试验结果 见图8。
3 讨论
免疫损伤相关内耳病的病因和发病机制尚不十分清楚,临床缺乏特异性诊断方法,其治疗主要是应用皮质激素或免疫抑制剂,虽然在早期有一定的疗效,但毒副作用多、且停药后易复发。而内耳局部注入药物与全身给药相比,有四大优点[7~9]:① 目的性强,药物-靶定位性好;②可避开血-迷路屏障,直接进入内耳;③ 淋巴液中药物浓度最高;④无全身副作用。本实验的前期实验已发现内耳局部注射比全身及中耳腔注射给药更能达到局部高浓度;而基因转导的细胞移植是一种传递基因到内耳的有效治疗策略。
本研究采用深海软体动物提取的纯化钥孔嘁血蓝蛋白(KLH)抗原加弗氏佐剂免疫豚鼠,成功制成了免疫源性内耳病动物模型,成功构建了IL-4基因的重组慢病毒载体(以下简称重组慢病毒载体),并将该重组载体感染从豚鼠股骨干提取并培养的BMSCs,使其感染成功,并经鼓阶注射的方法导入豚鼠内耳,结果显示,植入内耳后1周,重组慢病毒载体修饰的BMSCs可以成功转染内耳,主要分布于鼓阶,而且发现细胞在植入内耳1周时向前庭阶、Corti器、血管纹、骨螺旋板的蜗管内唇部有迁移现象;可见实验组鼓阶和前庭阶内有干细胞团块,另外在骨螺旋板的唇部、Corti器、螺旋神经节等部位亦有弱阳性酶反应显色;实验细胞空载体对照组鼓阶内有漂浮的细胞样团,而对照组无明显酶反应阳性显色;另外,结果还显示,重组慢病毒可以成功转染豚鼠内耳,绿色荧光分布广泛,主要集中于耳蜗骨壁、骨螺旋板的蜗管内唇部、螺旋韧带和血管纹、基底膜等处等部位,IL-4基因表达产物主要布于螺旋神经节、Corti器、血管纹、耳蜗骨壁以及骨螺旋板的蜗管内唇部等部位。
文中结果显示经鼓阶注入IL-4基因的重组慢病毒载体后,BMSCs载体组、BMSCs空载对照组、重组慢病毒IL-4基因组ABR反应阈平均值较免疫后有不同程度降低,且以BMSCs载体组明显,表明IL-4因子对免疫性内耳病的免疫炎性损伤有一定程度的调节和治疗作用,BMSCs具有低免疫原性免疫抑制功能,可作为一种载体将重组IL-4基因迁移至组织病变部位,有向病变部位迁移、聚集的作用,产生的IL-4基因产物可增强这一作用并在该部位缓慢并且持续产生基因产物IL-4,起到一定的治疗作用。另外,慢病毒基因组虽在一定程度上可以感染内耳,并表达一定的基因产物,但其对听损伤和内耳病理炎性损伤治疗效果不及BMSCs载体组,且其对内耳是否有毒性还存在一定的争议。
另外,本研究表明单一鼓阶内的一点注射可以使BMSCs较为广泛地分布于内耳各部位组织中,依据内耳解剖学和组织学特点,推测除了BMSCs有向病变部位迁移的可能外,可能还有三个途径使植入细胞从鼓阶分布到蜗管:①通过骨螺旋板下层中的小孔与鼓阶的外淋巴液相交通;②通过蜗神经纤维穿过的细孔与鼓阶的外淋巴液相交通;③鼓阶和前庭阶在顶回以蜗孔相交通,蜗管中的内淋巴液通过前庭膜与外淋巴液相交通。尚有待进一步研究证实。
近来有报道基因转导的细胞移植是一种传递基因到内耳的有效治疗策略,Sharifa等[10]通过研究BMSCs细胞移植入正常C57BL/6小鼠耳蜗的分布特点和形态,评估BMSCs作为在耳蜗的细胞移植的替代治疗的潜能;他还发现,当BMSCs移植入病理损伤的内耳后,BMSCs源性细胞向有损伤部位迁移的现象,表明BMSCs不仅可以参与免疫炎性病理损伤的调节和治疗,还可以作为种子细胞载体把携带目的基因的治疗因子迁移到损伤部位而发挥治疗作用;因此,使BMSCs安全有效的应用于自身免疫性内耳病还有许多工作要做。相信随着这些难题的解决,可以用它为自身免疫性疾病患者减轻药物副作用带来的痛苦,并达到有针对性和特异性的治疗目的,为BMSCS在免疫性内耳病的研究与治疗提供广阔前景。
4 参考文献
1 Scherer HU, van Pel M, Toes RE. Mesenchymal stem cells in autoimmune diseases: hype or hope[J].Arthritis Res Ther,2010,12:126.
2 Ho SH,Hahn W ,Lee HJ,et al.Protection against collagen-induced arthritis by eleetrotransfer of all expression plasmid for the interleukin-4[J].Biechem Biophys Res Commun,2004,321:759.
3 Nakamura K,Amakawa R, I'akebayashi M,et al.IL-4 producing;CD8+T cells may be an immunological hall-mark of chronic GVHD[J].Bone Marrow Fransplant,2005, 36:639.
4 张靖华,吴皓.免疫性内耳病模型的建立及地塞米松圆窗和全身给药的疗效[J].上海交通大学学报(医学版),2007,27:1.
5 Friedenstein AJ,Chailaldyan RK,Gerasimov UV.Bone marrow osteogenic stem cell:in vitro cultivation andtransplantation in diffusion chambers[J].Cell Tissue Kinet,1987,20:263.
6 Lisignoli G,Remiddi G,Cattini L,et a1.An elevated number of differentiated osteoblast colonies can be obtarined from rat bone marrow stromal cells using a gradient isolation procedure[J].Connect Tissue Res,2001,42:49.
7 Xenellis J,Papadimitriou N,Nikolopoulos T,et al.Intratympanie steroid treatment in idiopathic sudden sensorineural hearing loss:a control study[J].Otolaryngol Head Neck Surg,2006,134:940.
8 陈文博,谭长强. IL-10基因重组慢病毒载体不同途径导入内耳局部治疗自身免疫性感音神经性聋的实验研究[J].东南大学学报(医学版),2010,29:262.
9 蔡文君,谭长强.自身免疫性感音神经性聋基因治疗的实验研究[J].东南大学学报(医学版),2009,28:79.
10 Sharifa S, Nakagawa T, Ohno T, et al. The potential use of bone marrow stromal cells for cochlear cell therapy[J].Neuroreport,2007,18:351.
