差示扫描量热法表征氯化镁乙醇醇合物结构
2014-06-11岑为夏先知刘月祥毛炳权
岑为,夏先知,刘月祥,毛炳权
(中国石油化工股份有限公司北京化工研究院,北京100013)
氯化镁乙醇醇合物是制备高效球形丙烯聚合催化剂的载体[1-5]。丙烯聚合催化剂是一个复杂的多组分体系,对于各组分之间的作用关系和催化剂结构目前还没有一个统一的结论。催化剂的形态和强度均由载体的结构决定,TiCl4和给电子体均是分别负载在载体上的,载体中乙醇所占的位置及其分布会通过记忆效应来影响载钛和给电子体的位置和分布,从而影响催化剂的活性和选择性。所以,催化剂的形态、强度、活性、选择性等性质均受到载体结构影响。因此,深入认识载体的结构十分重要。
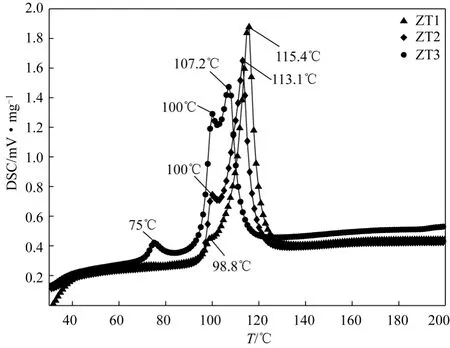
氯化镁与乙醇形成的醇合物(以下称为氯化镁醇合物)可标记为MgCl2·nEtOH,n是乙醇和氯化镁的摩尔比(以下称为醇镁比),醇镁比通常在0 本工作采用差示扫描量热法(differential scanning calorimetry,DSC)来研究醇镁比在 1.5~2.8的氯化镁醇合物的结构。那么,如果MgCl2·1.5EtOH 和 MgCl2·2.8EtOH 是稳定的组分,则会有相应熔点,而醇镁比在1.5~2.8的氯化镁醇合物的熔点则可能是由这两者的熔融峰组成。因此,采用 DSC热分析技术来表征不同醇镁比氯化镁醇合物的结构,通过熔融特征峰来推断氯化镁醇合物是否是由几种稳定的组分组成的混合物。 (1)主要化学试剂 乙醇(分析纯,北京化工厂生产),氮气(99.99%纯度,液氮经汽化后经脱水、脱氧后使用,天津化工厂生产),无水二氯化镁(工业一级,含水<1%,进口分装),己烷(工业一级,经过分子筛干燥),甲醇(HPLC级,99.9%纯度,经过分子筛干燥),苯甲酸乙酯(99%纯度,北京百灵威科技科技有限公司供应),氘代甲醇(99.8%纯度,美国剑桥氘代试剂公司供应)。 (2)主要仪器 STA 449F3 Jupiter 综合热分析仪(德国耐驰仪器公司),电感耦合等离子体质谱ICP-MS 7500CX(美国安捷伦公司),RE3000旋转蒸发器(中国上海光学仪器厂),JF-5型库仑法微量水测定仪(中国大庆日上仪器制造公司),德国Bruker Avance 300MHz 核磁共振谱仪。 首先采用文献[4]中所述的方法制备氯化镁醇合物,然后采用RE3000旋转蒸发器将所制备的氯化镁醇合物进行减压脱醇,取样不同脱醇时间点的样品,得到多种不同乙醇含量的氯化镁醇合物。减压脱醇条件为:水浴温度50℃,旋转速度为80r/min,真空度为0.5~0.9Pa。 采用 JF-5型库仑法微量水测定仪测定氯化镁醇合物中的微量水分,实验采用经过分子筛干燥后的甲醇溶解氯化镁醇合物,运用卡尔费休库仑法进行测定[10]。采用Bruker Avance 300MHz 核磁共振谱仪测定氯化镁醇合物中乙醇含量,实验取约15mg氯化镁醇合物溶解于0.5mL氘代甲醇中,然后加入25μL苯甲酸乙酯为标定物。采用电感耦合等离子体质谱(ICP-MS)测定氯化镁醇合物中镁含量。上述实验中为了防止水合,样品均在充满氮气且干燥的手套箱内制备。 采用 Netzsch STA 449F3综合热分析仪在30~200℃范围内以 5℃/min的扫描速率进行熔点和热焓测量。采用120μL的抗中压密封不锈钢坩埚制备样品,取样量均在10mg左右。为了防止水合,样品在充满氮气且干燥的手套箱内制备。 图1 含有不同微量水分氯化镁醇合物的DSC图 图1所示ZT1、ZT2和ZT3三个氯化镁醇合物的DSC图。ZT1、ZT2和ZT3的乙醇含量相近,均在56%左右,并且它们均含有微量的水分,通过卡尔费休库仑法测得ZT1、ZT2和ZT3的水含量分别是0.06%、0.35%、2.06%。 从它们的DSC图可看出,随着氯化镁醇合物中水分的增加,从ZT1、ZT2到ZT3的熔融峰发生了明显的变化。首先是主峰峰值从115.4℃逐渐降低至107.2℃,其次是与主峰相邻的小的熔融峰的峰值略有增加,从98.8℃增加至100℃,并且小峰的峰高增加明显,至ZT3时已形成在100℃和107.2℃的双峰特征,这说明随着水含量的增加,100℃的小峰所代表的与水分关联的组分含量明显增多。不过小峰和主峰的熔融温度区间存在较大的重叠,无法通过熔融焓的变化来区分它们含量的变化。另外,随着水分增加,ZT3中在小于90℃还出现了一个更小的熔融峰。 从这些DSC数据变化情况可以看出,氯化镁醇合物中微量的水分对熔点的影响较大,在 100℃左右的熔融峰是ZT1、ZT2和ZT3氯化镁醇合物中微量水分存在的特征峰。从ZT3、ZT2至ZT1随着水含量减少,该峰强度逐渐减小,可以推断如果完全没有水分,该峰可能会消失。那么在考虑水分存在的情况下,通过DSC曲线判断这3个氯化镁醇合物至少存在两种组分;一是与微量水分关联的组分,称为A组分,其熔点在100℃;另一个是纯粹的氯化镁醇合物组分B,熔点趋近115.4℃。并且随着A组分的增多,氯化镁醇合物组分B的熔点在逐渐降低。 另外可看出,由于氯化镁醇合物结构对水分非常敏感,易与空气中的水分发生水合,因此在测试过程中保证干燥的制样环境是很有必要的。 将ZT2进行减压脱醇,得到8个不同乙醇含量的氯化镁醇合物,它们的DSC曲线如图2所示。这些氯化镁醇合物的醇镁摩尔比n值在图2中列出。图2显示随着乙醇含量的降低,它们的熔融峰发生了明显的变化:一是在 98~113℃温度区间的熔融峰在逐渐减小并消失;二是在143~156℃的熔融峰在出现后渐渐增加。表1列出了这两个温度区间熔融峰的熔化焓值,随着醇镁比从2.64降低至1.52,在 98~113℃温度区间的熔融峰的熔化焓值从178.8J/g降低至 0,而在 143~156℃的熔融峰的熔化焓值从0增加至122.5J/g。很明显可看出,随着乙醇含量减少,产生这两个温度区间熔融峰的组分含量在交替变化,产生 98~113℃区间的熔融峰的醇合物组分在逐渐减少,而具有143~156℃的熔融峰的醇合物组分在逐渐增加。 图2 不同乙醇含量氯化镁醇合物的DSC图 首先看这几个氯化镁醇合物在 98~113℃温度区间的熔融峰。从图2可看出,当n从2.64降低至1.55时,在99℃左右的熔融峰始终存在。从2.1节氯化镁醇合物中水分对熔点的影响研究可知,在100℃左右的熔融峰是 ZT1、ZT2和 ZT3醇合物中微量水分存在的特征峰。对这些脱醇后的氯化镁醇合物的水分进行了测试,结果列在表1中。表1结果表明脱醇后,水分并没有被脱除掉,反而水分略有增加,这可能是由于在脱醇试验过程中频繁的取样使得样品水合了部分空气中的水分造成的。因此,可见脱醇后这几种氯化镁醇合物在99℃的熔融峰亦是由于微量水分与氯化镁醇合物结合后形成的A组分产生的。 表1 不同醇镁比氯化镁醇合物的熔化焓及水含量 再看ZT2中由氯化镁醇合物组分B所产生的在113.1℃的熔融峰经过脱醇后的变化情况。当 n从2.64降至2.39时,熔融峰值从113.1℃降低至111℃,而且相比于A组分在99℃形成的小的熔融峰,该峰是一个主要的熔融峰。当n=1.97和1.87时,该峰高度和熔点进一步降低,形成了在99℃和106.6℃的双峰特征形式。另外到n=1.7和1.55时,只剩下了99℃的熔融峰。由此看出,随着乙醇含量的降低,在 98~113℃区间由氯化镁醇合物所产生的熔融峰值在逐渐减小。从表1可知,当醇镁比从2.64降至1.52时,水分始终存在并未被脱掉,水分含量保持稳定,这说明当醇含量降低时,相比于产生该区间熔融峰的氯化镁醇合物在减少,而与水分相关的A组分在相对增加,所以这组DSC曲线在98~113℃的变化情况与ZT1、ZT2和ZT3所具有的熔融峰的变化情况是相似的,也是随着A组分的相对增加,氯化镁醇合物B所产生的熔融峰的峰值在减小。所以由于水分的影响,虽然氯化镁醇合物的熔融峰值在降低,实际上应始终是由同一种组分所产生的。因此,在ZT2的脱醇过程中,在98~113℃区间的熔融峰是由氯化镁醇合物组分B和其与微量水分形成的组分A共同产生的。 另外,通过 98~113℃温度区间的熔融峰的变化趋势可看出,在脱醇过程中,相比较于组分A,主峰所代表的氯化镁醇合物组分B先在逐渐减少,至n=1.74时,B组分的熔融峰首先消失,而与之相伴的由于微量水分引起,由组分 A所产生的在100℃的熔融峰则始终存在,最后至 n=1.52时,A组分的熔融峰才消失。这说明在脱醇过程中,最先减少或转化掉的是B组分,A组分则在进一步的脱醇过程中消失。 其次,看143~156℃温度区间的熔融峰,n=2.64和2.49时,该温度区间并没有出现熔融峰,但这并不代表产生这种熔融峰的组分不存在,可能由于含量太少,无法在DSC曲线上体现出来。进一步脱醇后,当n=2.39时,在143℃出现一个小的熔融峰,其焓值仅占总焓值的 8.3%。而当 n降低至 1.56~1.97时,在155℃附近出现一个稳定的熔融峰,其熔化焓值随着醇含量的降低在逐渐增加,这说明产生该熔融峰的组分在逐渐增加。当n降低至1.52时,熔融峰降低到148.4℃,这可能是由于在A组分和B组分消失后,水分与新组分结合造成的。由此可知,在脱醇过程中出现了一种新的氯化镁醇合物组分C,其熔点在155℃附近。 Sozzani等[7]通过核磁研究推断醇镁比在1.45~2.73的氯化镁醇合物是由 MgCl2·1.5EtOH 和MgCl2·2.8EtOH 两种稳定的组分组成的混合物。通过DSC曲线分析,在醇镁比 n=1.52~2.64的区间内亦发现两种稳定的氯化镁醇合物组分 B和组分C。组分B在ZT1中得到最多的体现,醇镁比值趋近于2.8。而组分C在n=1.56的醇合物中得到最多的体现,醇镁比值趋近于 1.5。因此结合文献[7]结论可推断,组分 B 的氯化镁醇合物是MgCl2·2.8EtOH,组分 C 的氯化镁醇合物是MgCl2·1.5EtOH。组分 B MgCl2·2.8EtOH 的熔点在115℃附近,组分C MgCl2·1.5EtOH的熔点在155℃附近。因此,醇镁比在1.52~2.64的氯化镁醇合物是由MgCl2· 2.8EtOH和MgCl2·1.5EtOH组分混合组成的。 (1)经过DSC热分析表征,发现氯化镁乙醇醇合物中存在两种稳定组分,它们分别是MgCl2·2.8EtOH 和 MgCl2·1.5EtOH。醇镁比在 1.5~2.8的氯化镁醇合物是由 MgCl2·2.8EtOH 和MgCl2·1.5EtOH混合组成的。 (2)MgCl2·2.8EtOH 的熔点在 115℃附近,MgCl2·1.5EtOH的熔点在155℃附近。 (3)氯化镁醇合物的熔点对水分很敏感,微量的水分会使醇合物熔点降低。并且 MgCl2·2.8EtOH与微量水分相结合后会在 100℃附近形成一个特征峰。 (4)在对醇镁比为 2.64且含有微量水分的氯化镁醇合物进行连续脱醇的过程中,首先减少的组分是 MgCl2·2.8EtOH,其次是 MgCl2·2.8EtOH 与微量水分形成的组分,并且在脱醇过程中不断形成MgCl2·1.5EtOH组分,而且水分没有被脱除掉。 [1]毛炳权,杨菊秀,李珠兰,等. 烯烃聚合用的球形催化剂:中国,93102795.0[P]. 1994-09-07. [2]杜宏斌,夏先知,王新生,等. 用于烯烃聚合或共聚合的球形催化剂组分及其催化剂:中国,1330086A[P]. 2002-01-09. [3]杨元一,杜宏斌,李振虎,等. 用于烯烃聚合反应的球形催化剂组分及其催化剂:中国,1718595A[P]. 2006-01-11. [4]杨元一,李振虎,杜宏斌,等. 一种卤化镁/醇加合物及其制备方法和应用:中国,1580136A[P]. 2005-02-16. [5]刘强,王霞,宋赛楠,等. 球形氯化镁载体[J]. 化工进展,2012,31(s2):131-133. [6]Bart J C J,Roovers W. Magnesium chloride-ethanol adducts[J].Journal of Materials Science,1995,30(11):2809-2820. [7]Sozzani P,Bracco S,Comotti A,et al. Stoichiometric compounds of magnesium dichloride with ethanol for the supported Ziegler-Natta catalysis:First recognition and multidimensional MAS NMR study[J].Journal of American Chemical Society,2003,125(42):12881-12893. [8]Malizia F,Fait A,Cruciani G. Crystal structures of Ziegler-Natta catalyst supports[J]. Chemistry-A European Journal,2011,17(49):13892-13897. [9]Valle G,Baruzzi G,Paganetto G,et al. The crystal structure of MgCl2·6C2H5OH[J]. Inorganica Chimica Acta,1989,156(2):157-158. [10]杨林娜,关秀兰. 卡尔费休库仑法测定氯化镁中水含量[J]. 石油化工,2003,32(s1):899-900.1 实验部分
1.1 试剂与仪器
1.2 氯化镁醇合物制备
1.3 氯化镁醇合物中成分含量测定
1.4 氯化镁醇合物熔点测试试验和条件
2 结果与讨论
2.1 氯化镁醇合物中水分对熔点的影响
2.2 低醇含量氯化镁醇合物DSC数据分析


3 结 论
