重组人血管内皮抑制素注射液联合冷冻消融治疗肺腺癌A549移植瘤的实验研究
2014-06-09马春华郭志
马春华,郭志
·实验研究Experimental research·
重组人血管内皮抑制素注射液联合冷冻消融治疗肺腺癌A549移植瘤的实验研究
马春华,郭志
目的探讨重组人血管内皮抑素注射液(商品名:恩度)联合冷冻消融对肺腺癌A549移植瘤的抑制作用及机制。方法建立肺腺癌A549裸鼠皮下移植瘤模型24只,待肿瘤最大直径达1 cm时,随机分为对照组、血管内皮抑素组、冷冻消融组和血管内皮抑素联合冷冻消融组(联合治疗组)。治疗后第21天处死裸鼠,取肿瘤组织,测量肿瘤体积,采用末端标记法(TUNEL)原位检测周边冷冻损伤区带细胞凋亡,免疫组化SP法检测肿瘤组织微血管密度(MVD)、血管内皮生长因子(VEGF)表达水平。结果治疗后第21天,对照组、血管内皮抑素组、冷冻消融组和联合治疗组的肿瘤生长速率分别为236.68%± 51.23%、220.02%±30.61%、159.46%±29.33%和103.34%±25.50%,组间差异有统计学意义(P<0.01);肿瘤细胞凋亡率分别为21.67%±2.34%、22.17%±1.47%、38.33%±1.37%和49.17%±1.72%,组间差异有统计学意义(P<0.01)。联合治疗组的MVD、VEGF表达水平均明显低于其他各组(P<0.01)。MVD与VEGF之间呈正相关关系(r=0.925,P<0.01)。结论血管内皮抑素可明显提高冷冻消融对肺腺癌A549移植瘤的抑制效果,其机制可能与血管内皮抑素通过下调VEGF表达水平,从而抑制肿瘤新生血管形成,协同冷冻消融促进肿瘤细胞凋亡有关。
肺腺癌;细胞系A549;移植瘤;重组人血管内皮抑制素;冷冻消融
重组人血管内皮抑素注射液(商品名:恩度)是我国学者自主开发研制的一种新型靶向治疗药物,具有强烈的抗肿瘤血管生成作用[1],与化疗联合治疗中晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的疗效确切[2],已被NCCN非小细胞肺癌临床实践指南中国版收入。氩氦冷冻消融治疗作为一种肿瘤微创治疗技术,具有安全、有效、微创、不良反应轻等特点。目前已用于前列腺癌、肺癌、肝癌等多种实体瘤的治疗,疗效已在临床逐渐得到证实[3-5]。重组人血管内皮抑素联合冷冻消融治疗中晚期NSCLC的实验研究报道较少。本研究通过建立人肺腺癌A549移植瘤裸鼠模型,观察重组人血管内皮抑素联合冷冻消融对肿瘤的抑制作用,并进一步探讨其机制,为临床治疗中晚期NSCLC提供参考。
1 材料与方法
1.1 实验材料
肺腺癌A549细胞系购自中国医学科学院基础医学研究所。5~6周龄BALB/c nu雌性裸小鼠24只,购自北京大学医学部实验动物科学部,许可证号SCXK(京)2006-0008,饲养于天津市脑血管与神经变性重点实验室动物实验中心(SPF级)。恩度由烟台麦得津生物工程股份有限公司惠赠。免疫组化试剂盒大鼠抗小鼠CD34单克隆抗体购自Abcam公司;小鼠抗人VEGF单克隆抗体购自北京中杉金桥公司;TUNEL原位免疫组化试剂盒购自美国Roche公司。氩氦冷冻系统及1.7 mm冷冻刀头购自美国Endocare公司。
1.2 实验方法
1.2.1 细胞培养肺腺癌A549细胞接种于含10%胎牛血清的McCoy’5A培养基中,置于37℃、5% CO2绝对湿度培养箱中培养。细胞为贴壁生长,0.125%的胰蛋白酶消化传代,48~72 h换液1次。1.2.2肺腺癌A549裸鼠移植瘤模型的建立及实验方法①将处于对数生长的A549细胞加适量PBS液配成2×107/m l细胞悬液。②A549细胞的植入:在裸鼠6周龄时,体重约20 g,于每只裸鼠右侧后腋窝皮下注射0.2m l细胞悬液,约7 d左右成瘤。③动物分组和治疗方法:待皮下肿块长至直径约1 cm左右时,随机分为对照组、血管内皮抑素组、冷冻消融组和血管内皮抑素联合冷冻消融组(联合治疗组),每组6只。对照组肿瘤进行穿刺但不行冷冻消融,穿刺后2 h以等体积的0.9%生理盐水腹腔注射,共14 d;血管内皮抑素组肿瘤进行穿刺但不行冷冻消融,穿刺后2 h以血管内皮抑素每天20 mg/ kg腹腔注射,共14 d;冷冻消融组肿瘤进行冷冻消融,冷冻消融后2 h以等体积的0.9%生理盐水腹腔注射,共14 d;联合治疗组肿瘤进行冷冻消融,冷冻消融后2 h以血管内皮抑素每天20 mg/kg腹腔注射,共14 d。治疗后第21天用水合氯醛处死裸鼠,取出肿瘤组织,分别用4%多聚甲醛溶液固定。④冷冻消融方法:裸鼠用10%水合氯醛腹腔注射麻醉,3.5 mg/kg,固定后皮肤消毒,1.7 mm氩氦刀冷冻刀头插入肿瘤中央。采用双循环冷冻方法,温度降低至-120℃,冷冻10 s,复温至0℃,重复上述冻融循环。
1.2.3 观察肿瘤生长情况治疗期间每2 d用游标卡尺测量肿瘤最长径(L)和垂直方向的最大横径(W)。计算肿瘤体积V(mm3)=LW2/2,不同时间所测体积V与治疗前肿瘤体积V0之比为肿瘤生长速率,用f表示。
1.2.4 TUNEL法原位检测冷冻损伤区细胞凋亡制备肿瘤组织石蜡切片,每片加25~50μl辣根过氧化酶抗体,DAB显色后苏木精对比复染,脱水、透明、固封。阳性表达为细胞核为棕色。判定方法为每张切片在400倍显微镜下取5个不同视野,分别计数每一高倍视野下阳性表达细胞所占癌细胞的比例,取平均值作为最终值并进行统计分析。
1.2.5 SP法检测肿瘤组织MVD计数制备肿瘤组织石蜡切片,一抗为大鼠抗小鼠CD34单克隆抗体,二抗为生物素化山羊抗大鼠IgG。DAB显色后苏木精对比复染,脱水、透明、固封。阳性表达为细胞基质棕黄色条索状着色。每张组织切片肿瘤组织低倍镜(×40)下选择血管高密度区,再转到高倍镜(× 200)下精确计数微血管数量,取5个视野区微血管数量的平均值作为最终值,并进行统计分析。
1.2.6 SP法检测肿瘤组织VEGF表达水平制备肿瘤组织石蜡切片,一抗为小鼠抗人VEGF单克隆抗体,二抗为生物素化山羊抗小鼠IgG。DAB显色后苏木精对比复染,脱水、透明、固封。光学显微镜下(×200)观察,VEGF的表达位于细胞质内,呈清晰棕黄色棕色颗粒或团块。判定方法为每张切片在400倍高倍显微镜下取5个不同视野,分别计数每一高倍视野下阳性表达细胞所占癌细胞的比例,取平均值进行统计分析。
1.3 统计学处理
采用SPSS17.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,各组间差异比较采用ANOVA方差分析,并用LSD法行组内两两比较,用Spearman相关系数考察指标间的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 冷冻消融对肺腺癌A549移植瘤的抑瘤作用观察
冷冻消融后冷冻中心区肿瘤细胞完全坏死崩解,核碎裂,呈凝固性坏死。坏死区周边出现明显的损伤区,其中可见部分肿瘤细胞皱缩,核浓集,染色质固缩,呈典型的凋亡细胞特征。损伤区外围可见形态正常的肿瘤细胞。对照组、血管内皮抑素组、冷冻消融组和联合治疗组肿瘤生长速率f分别为236.68%±51.23%、220.02%±30.61%、159.46%± 29.33%和103.34%±25.50%,组间差异有统计学意义(P<0.01,表1)。
表1 治疗前后各组肿瘤体积、肿瘤生长率及肿瘤细胞凋亡率比较(n=6,±s)
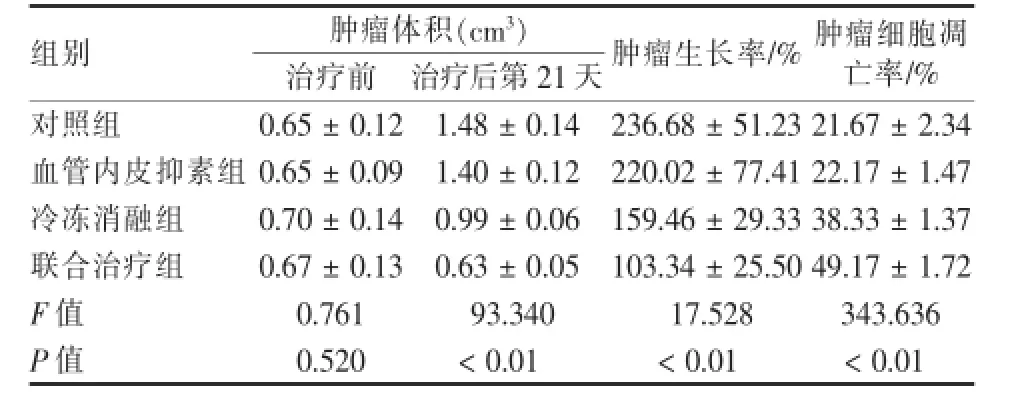
表1 治疗前后各组肿瘤体积、肿瘤生长率及肿瘤细胞凋亡率比较(n=6,±s)
组别肿瘤体积(cm3)肿瘤生长率/%肿瘤细胞凋亡率/%治疗前治疗后第21天对照组0.65±0.12 1.48±0.14 236.68±51.23 21.67±2.34血管内皮抑素组0.65±0.09 1.40±0.12 220.02±77.41 22.17±1.47冷冻消融组0.70±0.14 0.99±0.06 159.46±29.33 38.33±1.37联合治疗组0.67±0.13 0.63±0.05 103.34±25.50 49.17±1.72 F值0.761 93.340 17.528 343.636 P值0.520<0.01<0.01<0.01
2.2 冷冻损伤区细胞凋亡
冷冻消融后冷冻损伤区肿瘤组织TUNEL法染色结果显示,凋亡细胞主要集中分布在坏死区周围损伤区,光学显微镜下细胞核呈棕黄色,核固缩,染色质靠核膜周边呈蚕豆或新月形浓染,对照组及血管内皮抑素组肿瘤组织中少量凋亡细胞散在分布。对照组、血管内皮抑素组、冷冻消融组和联合治疗组肿瘤细胞凋亡率分别为21.67%±2.34%、22.17%± 1.47%、38.33%±1.37%和49.17%±1.72%,组间差异有统计学意义(P<0.01,表1)。
2.3 肿瘤组织MVD、VEGF表达水平
冷冻消融后冷冻损伤区周围肿瘤组织中VEGF阳性细胞较多,呈弥散或灶状分布,MVD分布亦明显增多。光学显微镜下肿瘤微血管细胞基质着棕黄色,呈条索状,VEGF阳性细胞胞质内着清晰棕黄色或棕色,呈颗粒状或团块状。联合治疗组肿瘤组织MVD明显低于其他各组(P<0.01);肿瘤组织VEGF表达水平亦明显低于其他各组(P<0.01)。经Spearman等级相关分析,VEGF表达强度与MVD间有显著正相关性,r=0.906,P<0.01。见表2。

表2 各组肿瘤组织中MVD和VEGF表达水平比较
3 讨论
内皮抑素(endostatin)是1997年O’Reilly等从培养的小鼠内皮细胞瘤上清液中分离纯化获得的一种内源性血管生成抑制剂,能特异性抑制血管内皮细胞生长,进而抑制肿瘤血管生成,达到抑制肿瘤生长和转移的作用。人重组血管内皮抑素(恩度)是由我国学者通过改变血管内皮抑素的氨基酸序列,自主创新研发的一种新型人血管内皮抑制素,具有良好的抗肿瘤血管生成作用,单药的客观有效率仅为3%~5%,而与化疗联合治疗晚期NSCLC却能取得良好的临床效果,具有疗效协同作用[2]。冷冻消融是近年来新发展的微创治疗技术,通过快速冷冻使肿瘤细胞内形成冰晶,局部肿瘤组织内的毛细血管和小血管痉挛,损伤肿瘤血管,导致局部血液循环障碍,血栓形成,使肿瘤组织缺血缺氧,最终肿瘤细胞发生凝固性坏死。冷冻消融导致肿瘤细胞坏死后产生特异性抗原,刺激机体产生特异性抗体,通过抗体对肿瘤的免疫反应消灭残留的癌细胞。冷冻消融亦可以诱导肿瘤细胞凋亡。有研究报道,冷冻消融能迅速降低患者肿瘤负荷,有效控制肿瘤进展,提高患者的生存质量[3-6],但远期疗效有待进一步观察。
人重组血管内皮抑素(恩度)单药治疗对肿瘤的控制作用较低,其联合化疗治疗晚期NSCLC具有确切的疗效协同作用。人重组血管内皮抑素(恩度)联合冷冻消融是否具有疗效协同作用,本研究对空白对照组、血管内皮抑素组、冷冻消融组和联合治疗组进行比较,以期通过局部肿瘤控制率的提高,改善近期疗效。结果显示冷冻消融后肿瘤细胞大部分发生凝固性坏死,冷冻损伤区可见散在肿瘤细胞凋亡,联合治疗组肿瘤生长速率明显低于其他三组(P<0.01),提示联合治疗可明显提高肿瘤控制率,具有疗效协同作用。
冷冻消融后残存肿瘤的复发及转移是影响远期疗效的重要因素。Kimura等[7]研究报道,RM-9前列腺癌细胞小鼠模型冷冻消融治疗后,残存肿瘤组织内MVD明显升高。Ueda等[8]认为MVD可作为判断肿瘤复发和预后的可靠指标。本研究结果表明,冷冻消融后冷冻损伤区肿瘤组织MVD明显升高,且MVD较多的区域,VEGF表达水平随之升高,二者呈正相关关系。提示冷冻消融后肿瘤组织MVD升高与VEGF表达水平上调有关。VEGF是目前公认的肿瘤微血管形成的主要促成因子,是用以衡量肿瘤新生血管程度的常用标志。血管内皮抑素能阻止VEGF与内皮细胞结合,直接阻断VEGF的作用;通过抑制血管内皮的活化、增殖、迁移,减少肿瘤血管的生成;使肿瘤血管暂时“正常化”,使得肿瘤细胞进入休眠状态,诱导其凋亡,增强肿瘤细胞对物理、化学损伤的敏感性[9-10]。本研究结果表明联合治疗组残存肿瘤组织内MVD及VEGF表达水平明显减低,我们推测血管内皮抑素通过下调肿瘤细胞内VEGF表达水平,抑制肿瘤血管内皮的活化、增殖、迁移,从而抑制肿瘤新生血管的形成,进而抑制残存肿瘤组织复发。联合治疗组肿瘤细胞凋亡率明显高于其他三组,可能与血管内皮抑素通过使肿瘤血管暂时“正常化”,诱导肿瘤细胞进入休眠状态,进而协同冷冻消融促进肿瘤细胞凋亡有关。
综上所述,通过肺腺癌A549裸鼠皮下移植瘤模型的实验结果显示,血管内皮抑素联合冷冻消融具有明显的疗效协同作用,其机制可能与血管内皮抑素下调残存肿瘤细胞内VEGF的表达水平,进而抑制肿瘤新生血管的形成,诱导肿瘤细胞凋亡有关。此结果为临床治疗提供了实验依据,具有一定的临床指导作用。
[1]Folkman J.Antiangiogenesis in Cancer therapy—endostatin and itsmechanisms of action[J].Exp Cell Res,2006,312:594-607.
[2]王金万,孙燕,刘永煜,等.重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究[J].中国肺癌杂志,2005,8:283-290.
[3]郭志,王海涛,邢文阁,等.冷冻消融治疗T3N0M0期前列腺癌的初步临床观察[J].中华医学杂志,2010,90:2815-2819.
[4]陈波,许健,曹建民,等.氩氦刀冷冻治疗肺癌及疗效评估[J].介入放射学杂志,2009,18:510-514.
[5]黄斌,周石.TACE联合氩氦刀冷冻术治疗巨块型肝细胞癌的临床研究[J].介入放射学杂志,2011,20:28-31.
[6]邢文阁,Guo Z,王海涛,等.42例直肠超声引导经皮氩氦冷冻治疗中晚期前列腺癌[J].中华放射学杂志,2008,42:807-811.
[7]Kimura M,Rabbani Z,Mouraviev V,et al.Morphology of hypoxia following cryoablation in a prostate Cancer murine model:its relationship to necrosis,apoptosis and,microvessel density[J].Cryobiology,2010,61:148-154.
[8]Ueda M,Terai Y,Kumagai K,et al.Correlation between tumor angiogenesis and expression of thymidine phosphorylase,and patient outcome in uterine cervical carcinoma[J].Hum Pathol,1999,30:1389-1394.
[9]Lee CG,Heijn M,di Tomaso E,et al.Anti-vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions[J].Cancer Res,2000,60: 5565-5570.
[10]Mauceri HJ,Hanna NN,Beckett MA,et al.Combined effects of angiostatin and ionizing radiation in antitumour therapy[J]. Nature,1998,394:287-291.
Endostar combined with cryoablation for subcutaneous xenografted tumor model of lung adenocarcinoma cell line A549 in BALB/c nude m ice:an experimental study
MA Chun-hua,GUO Zhi.Department of Tumor Intervention,Tianjin Huanhu Hospital,Tianjin Cerebral Vascular and Neural Degenerative Disease Key Laboratory,Tianjin 300060,China
GUO Zhi,E-mail:cjr.guozhi@vip.163.com
ObjectiveTo investigate the inhibitory effect of Endostar combined with cryoablation on lung adenocarcinoma cell line A549 in BALB/c nude mice,and to discuss its interaction mechanisms. M ethods The lung adenocarcinoma A549model in BALB/c nudemice were established.When the largest diameter of tumor reached 1.0 cm,a total of 24 mice were randomly and equally divided into 4 groups: control group,Endostar group,cryoablation group and cryoablation plus Endostar group.The largest diameter and the vertical diameter of the tumorsweremeasured at different points of time after treatment.At the 21st day,the mice were sacrificed and the tumors were removed and the rate of tumor cell apoptosis,the microvessel density(MVD)and the expression level of vascular endothelial growth factor(VEGF)were determined by using immunohistochemistry method.The results were statistically analyzed.Resu lts The tumor growth velocity of the control group,Endostar group,cryoablation group and cryoablation plus Endostar group was(236.68±51.23)%,(220.02±30.61)%,(159.46±29.33)%and(103.34±25.50)%,respectively(P<0.01).The rate of apoptosis of the four groups was(21.67±2.34)%,(22.17±1.47)%,(38.33±1.37)%and(49.17±1.72)%,respectively(P<0.01).The MVD and the expression levels of VEGF of the cryoablation plus Endostar group were significantly lower than those of the other three groups(P<0.01).Statistical analysisrevealed that a positive correlation existed between the express of VEGF and MVD.ConclusionEndostar can obviously enhance the therapeutic efficacy of cryoablation on lung adenocarcinoma A549 in BALB/c nude mice.The underlying mechanismsmay be the Endostar-inhibited angiogenesis through down-regulating the expression of VEGF,and the cooperative effect of Endostar and cryoablation on the promotion of tumor cell apoptosis.(JIntervent Radiol,2014,23:241-244)
lung adenocarcinoma;cell line A549;xenografted tumor;recombinanthuman endostatin;cryoablation
R734.2
B
1008-794X(2014)-03-0241-04
2013-08-05)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.03.015
300060天津市环湖医院肿瘤介入科,天津市脑血管与神经变性重点实验室(马春华);天津医科大学附属天津肿瘤医院肿瘤介入治疗科,天津市肿瘤防治重点实验室(郭志)
郭志E-mail:cjr.guozhi@vip.163.com
