不同微创介入治疗原发性肝癌对机体T细胞免疫功能的影响
2014-06-09韩聚强范公忍任永强郭汉斌李国安夏长虹王帅龚丽娟曹建彪
韩聚强,范公忍,任永强,郭汉斌,李国安,夏长虹,王帅,龚丽娟,曹建彪
·肿瘤介入Tumor intervention·
不同微创介入治疗原发性肝癌对机体T细胞免疫功能的影响
韩聚强,范公忍,任永强,郭汉斌,李国安,夏长虹,王帅,龚丽娟,曹建彪
目的探讨微创介入治疗肝癌对机体T细胞免疫功能的影响。方法肝动脉栓塞化疗(TACE)治疗肝癌31例,射频消融(RFA)治疗肝癌19例,根据肿瘤直径大小分为小肝癌组(直径≤5 cm)和大肝癌组(直径>5 cm)。分别于术前及术后1、7 d留置外周血,用流式细胞术检测CD3、CD4、CD8及CD4/CD8比值的变化。结果小肝癌组,TACE与RFA治疗术后1 d外周血T细胞亚群无明显变化,但术后7 d时,RFA治疗组外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值较治疗前相比明显增高,而TACE组外周血T细胞亚群CD4及CD4/CD8比值较治疗前明显下降。大肝癌组,无论TACE还是RFA治疗,术后1 d外周血T细胞亚群指标较治疗前明显下降(P<0.05),而7 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值较治疗前显著增高,其中RFA组T细胞亚群较TACE组恢复更为显著。结论不同微创治疗方式治疗肝癌后对机体T细胞免疫系统影响不同,与肿瘤大小密切相关。
肝细胞癌;肝动脉栓塞化疗术;射频消融治疗术;免疫功能
近年诸多研究证实,肝动脉栓塞化疗(TACE)治疗乙型肝炎相关肝癌术后会出现乙型肝炎病毒(HBV)反弹[1]。我们前期工作也已证实,TACE及射频消融(RFA)治疗均可导致HBV反弹,其中肿瘤直径大小为单独影响因素。综上推测,上述现象可能与微创介入治疗术后机体免疫功能改变有关[2]。基于此,我们将肝脏肿瘤直径大小分作为分层分析依据,进一步观察了TACE治疗31例和RFA治疗19例后对机体T细胞免疫功能的影响。
1 材料与方法
1.1 材料
1.1.1 一般资料2012年6月至于12月在北京军区总医院肝病科住院接受治疗的HBV相关肝癌患者50例,所有患者均行肝穿活检病理证实为肝细胞性肝癌。其中男45例,女5例,年龄28~72岁,平均年龄55岁。肝功能Child-Pugh分级A级41例,B级9例。治疗前接受核苷类抗病毒治疗39例(规范服药疗程均在3个月以上),未接受治疗11例。所有患者根据肿瘤直径大小划分为小肝癌(直径≤5 cm)和大肝癌(直径>5 cm)组。
1.1.2 主要试剂及仪器淋巴细胞分离液(Ficollhypque液):天津TBD生物技术发展中心;IgGr1-FITC/IgGr2a-PE、CD3-FITC/CD4-PE、CD3-FITC/ CD8-PE和FACS Lysing Solution溶血素:BD公司生产;流式细胞仪(FCM)Calibur:BD公司生产。
1.2 方法
1.2.1 TACE(31例)采用Seldinger改良技术,经皮右股动脉穿刺将导管选择性插入肝固有动脉或超选择性插入到肿瘤供血靶动脉后,造影观察肿块大小、部位及血供情况。化疗方案采用吡柔比星(20~40 mg),奥沙利铂(50~100 mg)、5-氟尿嘧啶(500 mg)。以适当速度注入上述药物与液态碘化油的混合物,再注入明胶海绵颗粒进行栓塞,将靶动脉闭塞。
1.2.2 RFA(19例)患者术前禁食、肌注盐酸哌替啶25mg、盐酸异丙嗪25 mg,于常规腹部B超引导下将RFA电极准确刺入肿瘤部位,张开多个子电极呈伞形锁定肿瘤。RFA仪在计算机控制下发出射频脉冲,使肿瘤组织产生局部高温(70℃~95℃)。
1.2.3 FCM检测CD3、CD4、CD8及CD4/CD8比值分别于术前及术后1、7 d抽取患者血样,用淋巴细胞分离液密度梯度离心法分离外周血中有核细胞,外周血中有核细胞染色标记30 min,溶血10 min,300 g离心5 min,弃上清液,PBS洗2次,随后上机检测,并采用Cellquest软件进行样品测定分析。
1.3 统计学分析
采用Excel 2007建立数据库,采用SPSS15.0统计软件,计量资料以±s表示,采用t检验进行统计学分析,检测水准α=0.05。
2 结果
2.1 一般临床资料比较
根据肿瘤直径大小将所检测样本进行分层,RFA组和TACE治疗组中肝癌大小患者之间性别构成、年龄、血清AFP水平、肝功能Child-Pugh分级、包膜完整性及肿瘤病理学分级差异均无统计学意义(P>0.05)。
2.2 不同微创介入治疗原发性肝癌后肝功能损伤的比较
不管RFA还是TACE治疗,大肝癌治疗后近期肝功能的损伤明显高于小肝癌组。纵向比较发现,无论大肝癌还是小肝癌组,TACE对肝脏功能的近期损伤明显高于RFA组。见表1、表2。
表1 RFA治疗原发性肝癌前后肝功能损伤变化(±s)

表1 RFA治疗原发性肝癌前后肝功能损伤变化(±s)
注:a各组术后与治疗前相比,P<0.05;b各组术后与治疗前相比,P<0.01
组别ALT/(u/L)TBIL/(μmol/L)ALB/(g/L)AST/(u/L)肿瘤直径≤5 cm(9例)术前43.15±4.42 26.18±6.45 32.49±8.23 46.28±3.62术后1 d 48.49±5.21a25.43±7.29 33.14±5.45 45.23±6.32术后7 d 42.26±6.38 24.96±7.42 31.99±6.45 45.75±8.14肿瘤直径>5 cm(10例)术前60.12±10.35 36.58±7.24 31.25±7.33 66.48±8.39术后1 d 98.34±9.21b45.43±8.34b29.44±6.87 74.38±10.12b术后7 d 69.18±8.48a39.77±6.49a30.92±7.18 55.78±9.36a
2.3 不同微创介入治疗后外周血细胞免疫功能的比较
2.3.1 RFA治疗原发性肝癌前后外周血T细胞亚群的变化小肝癌组,RFA治疗1 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值均无明显变化,而7 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值均较治疗前相比明显增高(P<0.05)。大肝癌组,RFA治疗1 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值较治疗前明显下降(P<0.05),而7 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值与治疗前比较明显增高(P<0.01)。见表3。
表2 TACE治疗原发性肝癌前后肝功能损伤变化(±s)
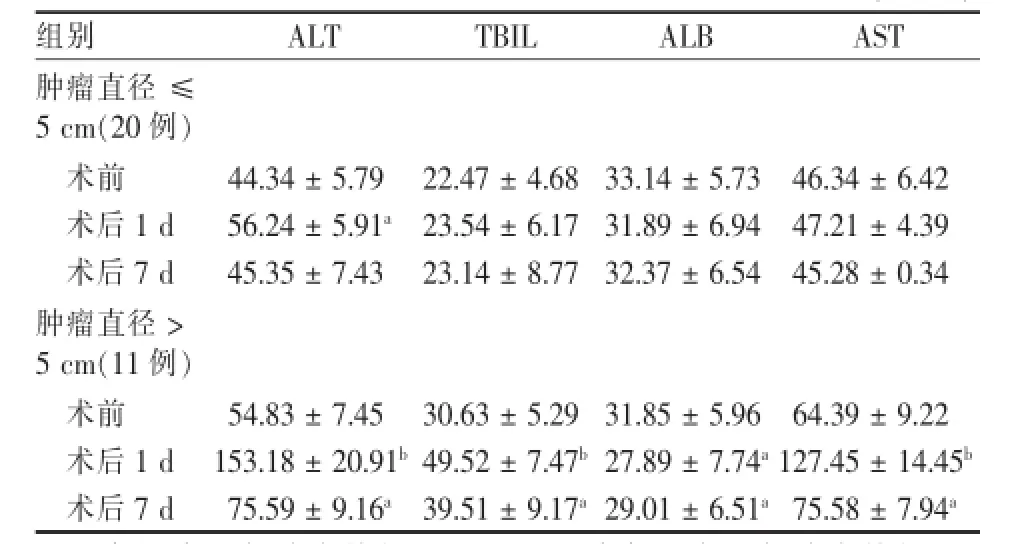
表2 TACE治疗原发性肝癌前后肝功能损伤变化(±s)
注:a各组术后与治疗前相比,P<0.05;b各组术后与治疗前相比,P<0.01
组别ALT TBIL ALB AST肿瘤直径≤5 cm(20例)术前44.34±5.79 22.47±4.68 33.14±5.73 46.34±6.42术后1 d 56.24±5.91a23.54±6.17 31.89±6.94 47.21±4.39术后7 d 45.35±7.43 23.14±8.77 32.37±6.54 45.28±0.34肿瘤直径>5 cm(11例)术前54.83±7.45 30.63±5.29 31.85±5.96 64.39±9.22术后1 d 153.18±20.91b49.52±7.47b27.89±7.74a127.45±14.45b术后7 d 75.59±9.16a39.51±9.17a29.01±6.51a75.58±7.94a
表3 RFA治疗原发性肝癌前后外周血T细胞亚群变化(±s)
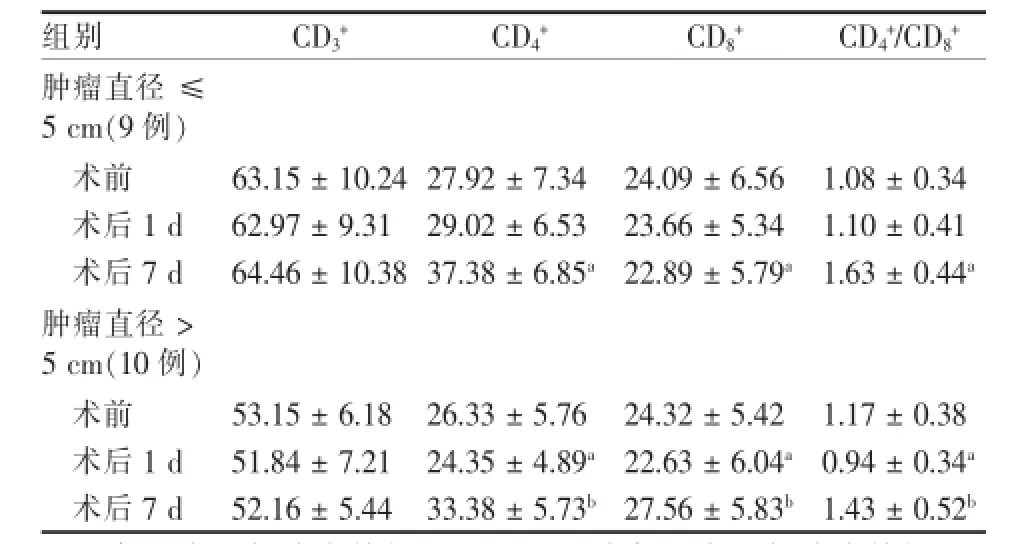
表3 RFA治疗原发性肝癌前后外周血T细胞亚群变化(±s)
注:a各组术后与治疗前相比,P<0.05;b各组术后与治疗前相比,P<0.01
组别CD3+CD4+CD8+CD4+/CD8+肿瘤直径≤5 cm(9例)术前63.15±10.24 27.92±7.34 24.09±6.56 1.08±0.34术后1 d 62.97±9.31 29.02±6.53 23.66±5.34 1.10±0.41术后7 d 64.46±10.38 37.38±6.85a22.89±5.79a1.63±0.44a肿瘤直径>5 cm(10例)术前53.15±6.18 26.33±5.76 24.32±5.42 1.17±0.38术后1 d 51.84±7.21 24.35±4.89a22.63±6.04a0.94±0.34a术后7 d 52.16±5.44 33.38±5.73b27.56±5.83b1.43±0.52b
2.3.2 TACE治疗原发性肝癌前后外周血T细胞亚群的变化小肝癌组,TACE治疗1 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值均无明显变化,而7 d后外周血T细胞亚群CD4及CD4/ CD8比值较治疗前相比明显下降(P<0.05)。大肝癌组,TACE治疗1 d后外周血T细胞亚群CD3、CD4及CD4/CD8比值较治疗前明显下降(P<0.01),但7 d后外周血T细胞亚群CD3、CD4、CD8及CD4/CD8比值较治疗1 d后有所升高,但较治疗前仍有所下降(P<0.05)。见表4。
2.4 不同微创介入治疗肝癌后外周血CD4/CD8比值的变化
以CD4/CD8细胞比值为中心的免疫调节是机体维持免疫平衡的关键环节。我们以肿瘤直径大小进行分层分析,结果发现:①小肝癌组,经TACE治疗后CD4/CD8细胞比值呈轻微下降趋势,而RFA治疗后CD4/CD8细胞比值呈明显上升的趋势。在治疗后第7天,RFA治疗组CD4/CD8细胞比值显著高于TACE治疗组(P<0.05)。见图1。②直径大于5 cm的肝癌,两种微创介入治疗后CD4/CD8细胞比值均呈先下降再逐渐升高的趋势,但在治疗后第7天,RFA治疗后CD4/CD8细胞比值恢复上升趋势同样显著高于TACE治疗组(P<0.05)。见图2。
表4 TACE治疗原发性肝癌前后外周血T细胞亚群变化(±s)

表4 TACE治疗原发性肝癌前后外周血T细胞亚群变化(±s)
注:a各组术后与治疗前相比,P<0.05;b各组术后与治疗前相比,P<0.01
组别CD3+CD4+CD8+CD4+/CD8+肿瘤直径≤5 cm(20例)术前64.24±8.34 29.12±6.54 29.33±5.86 1.07±0.42术后1 d 63.97±5.91 28.54±7.32 28.65±4.89 1.03±0.39术后7 d 64.35±6.83 27.38±6.77a28.89±6.87 0.98±0.34a肿瘤直径>5 cm(11例)术前54.32±7.15 26.12±4.54 23.41±7.24 1.20±0.35术后1 d 43.97±5.91b19.44±7.32b23.19±3.67 0.87±0.29b术后7 d 46.35±6.83a22.38±6.77a22.15±3.23a1.03±0.42a
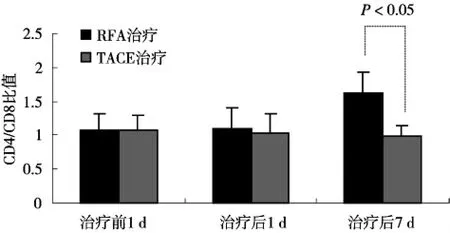
图1 不同微创治疗小肝癌后外周血CD4/CD8比值的变化

图2 不同微创治疗大肝癌后外周血CD4/CD8比值的变化
3 讨论
机体免疫功能与肿瘤的发生、发展及转归关系密切,其中T细胞免疫在机体抗肿瘤的免疫调节中重要作用[3]。临床上通过测定CD4、CD8等T细胞数值以及CD4/CD8细胞比值来判断机体维持免疫平衡状态:当CD4细胞下降、CD4/CD8比值下降或CD8上升时,机体免疫功能下降;相反,当CD4细胞上升、CD4/CD8比值上升或CD8下降时,则提示机体免疫功能好转或恢复。
介入治疗是近年兴起治疗肝癌的有效微创方法,包括TACE、RFA等,其对于小肝癌或早期肝癌的疗效相当显著[4],但介入治疗对机体免疫功能的影响目前观点不一。比如TACE,单纯从治疗本身分析,肝癌供血动脉栓塞后,肿瘤细胞发生坏死,因此其释放的肿瘤抑制因子减少,从而减弱了对机体免疫功能的抑制[5]。但有临床研究表明,肝动脉栓塞化疗后机体的免疫功能显著降低[6-7]。究其原因,大部分肝癌患者就诊时已到中晚期,多为巨块型肝癌,或存在血管受压移位、变异,很难做到主要载瘤动脉的栓塞,因此栓塞化疗的同时,部分正常肝组织受损明显,而目前已证实,肝脏是机体最大的免疫器官,因此过分的栓塞化疗可能是导致机体免疫功能下降的主要原因。这一点在我们的研究结果中也得到很好的体现。相反,目前多项研究提示RFA治疗能够增强机体细胞免疫功能[8-9],具体机制目前尚不明了,分析原因可能如下:①RFA治疗后引起部分或全部肿瘤变性坏死,一定程度上减轻了肿瘤负荷,消除了体内肿瘤免疫抑制因子来源,解除了对宿主免疫抑制作用。②RFA治疗后,变性坏死的肿瘤细胞暴露其表面肿瘤抗原决定簇,增强了免疫原性,刺激产生特异性和非特异性抗肿瘤免疫,从而改善机体的免疫功能。③加温是一种物理性的损伤因素,可引起非特异性炎性反应,同样可以刺激机体免疫系统。④高温热疗可以促进肿瘤组织合成一种热休克蛋白,其在细胞内形成复合物,从而被T淋巴细胞识别,产生特异性免疫反应。⑤RFA治疗产物高温可导致机体内P53蛋白稳定性增加,同时启动细胞凋亡基因或自噬基因表达增强,进一步减轻了瘤负荷[10]。
随着微创介入治疗技术的成熟,目前临床上也逐渐扩大了TACE或RFA治疗肝癌的适应证,由原来的小肝癌向大肝癌、单一介入技术到多种介入技术及微创介入治疗与全身靶向治疗的联合[11]。理论上,上述联合具有很好的依据。此外,在治疗过程中除了关注对肿瘤的毁损效果外,人们也越来越注意到各种影响因素对微创治疗疗效的影响以及微创治疗本身对全身免疫系统的影响。本研究中,我们将肿瘤大小作为影响因素进行了分层分析,结果发现肿瘤大小在评估微创介入治疗对机体免疫系统的影响极大。鉴于此次研究的样本量相对较少,我们目前仍在继续扩大样本量,进一步探讨微创介入对机体免疫功能的影响及分子机制,为将来微创介入治疗方案的优化组合提供理论依据。
[1]Ikeda M.Reactivation of hepatitis B virus in patients receiving chemotherapy[J].Jpn JClin Oncol,2013,43:8-16.
[2]Perrillo RP.Reactivated hepatitis B due tomedical interventions: the clinical spectrum expands[J].Antivir Ther,2011,16:947-949.
[3]王志利,张跃伟,徐丹凤.射频消融治疗肝癌后机体免疫功能变化的研究进展[J].当代医学,2012,18:24-25.
[4]Nishikawa H,Inuzuka T,Takeda H,et al.Comparison of percutaneous radiofrequency thermal ablation and surgical resection for small hepatocellular carcinoma[J].BMC Gastroenterol,2011,11:143.
[5]郑伟生,陈强,叶韵斌,等.沙利度胺对原发性肝癌介入治疗后机体免疫功能的影响[J].肿瘤基础与临床,2007,20: 145-147.
[6]Akizuki S,Magara T,Tanaka T.Diminution of the number of gamma delta T lymphocytes in hepatocellular carcinoma patients treated with transcatheter arterial embolization[J].Nihon Rinsho Meneki Gakkai Kaishi,1998,21:108-117.
[7]李虎子,郭志,王海涛,等.肝细胞癌患者TACE后外周血调节性T细胞水平对预后的影响[J].介入放射学杂志,2012,21:998-1001.
[8]王艳滨,吴后男,严昆,等.肝细胞癌射频治疗前后淋巴细胞亚群及T细胞功能的变化[J].中国介入影像与治疗学,2006,3:115-121.
[9]Wang YB,Xu WG,Liu HL,et al.Effects of radiofrequency ablation on lymphocyte subsets and type1/type2 T cell subpopulation in patientswith hepatocellular carcinoma[J].Chin JCancer,2009,21:310-317.
[10]Han J,Xu X,Qin H,et al.The molecular mechanism and potential role of heat shock-induced p53 protein accumulation[J].Mol Cell Biochem,2013,378:161-169.
[11]杨茂,郭志,司同国,等.动脉化疗栓塞联合CIK细胞过继免疫治疗对中晚期肝癌患者免疫功能的影响[J].介入放射学杂志,2011,20:116-119.
The influence of different m icro-injury interventional treatments on the T lymphocyte immune function in patients w ith primary hepatocellular carcinoma
HAN Ju-qiang,FAN Gong-ren,REN Yong-qiang,GUO Han-bin,LIGuo-an,XIA Chang-hong,WANG Shuai,GONG Li-juan,CAO Jian-biao. Institute of Liver Disease,General Hospital of Beijing Military Region,Beijing 100700,China
HAN Ju-qiang,E-mail:hanjq@hotmail.com
ObjectiveTo investigate the influence of differentmicro-injury interventional treatments on the T lymphocyte immune function in patientswith primary hepatocellular carcinoma(HCC).M ethods A total of 50 patients with pathologically-proved HCC were enrolled in this study.Transcatheter arterial chemoembolization(TACE)was carried out in 31 patients,while radiofrequency ablation(RFA)was performed in 19 patients.According to the tumor’s diameter,the patients were divided into small HCC group(≤5 cm)and larger HCC group(>5 cm).Peripheral blood was taken before and one,seven days after the treatment to determine CD3,CD4,CD8 as well as the ratio of CD4/CD8 using flow cytometry assay.The results were analyzed.ResultsOne day after either TACE or RFA treatment in small HCC group,T lymphocytes in peripheral blood,including CD3,CD4,CD8 as well as the ratio of CD4/CD8,were kept at the same levels as before.However,seven days after the treatment T lymphocytes(including CD3,CD4,CD8 as well as the ratio of CD4/CD8)were significantly increased in RFA group,while T lymphocytes were obviously decreases in TACE group.One day after either TACE or RFA treatment in larger HCC group,T lymphocytes showed a remarkable decrease in both groups(P<0.05),while seven days after the treatment T lymphocytes and the ratio of CD4/CD8 increased significantly,especially in RFA group.ConclusionThe differentmicro-injury interventional treatments carry different influences on the T lymphocyte immune function in patients with primary hepatocellular carcinoma,which may be related to the size of tumor.(J Intervent Radiol,2014,23:218-221)
hepatocellularcarcinoma;transcatheter arterial chemoembolization;radiofrequency ablation;immunological function
R735.7
A
1008-794X(2014)-03-0218-04
2013-08-20)
(本文编辑:俞瑞纲)
国家自然科学基金(30972594);王宝恩肝纤维化基金(2010-14)
10.3969/j.issn.1008-794X.2014.03.009
100700北京北京军区总医院全军肝病中心
韩聚强E-mail:hanjq73@hotmail.com
