经脾与经肝种植VX2瘤株建立兔肝转移瘤模型的影像学比较
2014-06-09史博李智岗王永中吴勇超郝晓光谷铁树
史博,李智岗,王永中,吴勇超,郝晓光,谷铁树
·实验研究Experimental research·
经脾与经肝种植VX2瘤株建立兔肝转移瘤模型的影像学比较
史博,李智岗,王永中,吴勇超,郝晓光,谷铁树
目的通过经肝及经脾种植VX2瘤株建立兔肝转移瘤模型,分别观察模型建立情况、CT扫描肝内病变数目及强化情况、CT灌注扫描肝内病变与周围正常肝组织灌注参数(BF值、BV值)差值的比较以及数字减影血管造影(DSA)肝内病变数目及染色情况,探讨更为合理实用的方法和更接近人肝转移瘤模型的建立方法。方法将50只大白兔随机分为两组,每组25只。A组暴露肝脏,注入VX2细胞悬液1ml;B组暴露脾脏,注入VX2细胞悬液1ml。术后第14天行CT灌注扫描,第15天行DSA。分别观察CT扫描表现(肝内病变数目及强化特点)、血管造影表现(肝内病变数目及染色情况)及CT灌注扫描参数[肝内病变处与周围正常肝组织血流量(BF)和血容量(BV)差值]变化。结果A组25只、B组21只动物成功建模。两组均有20只动物完成CT灌注扫描及DSA,A组中16只为单个病灶,4只为2个以上病灶,19只可见强化,1只未见强化;B组3只为单个病灶,17只为2个以上病灶,19只可见强化,1只未见强化。A组肝内病变部位与周围正常肝组织BF值和BV值差值分别为(264.58±59.132)ml/min和(19.541±4.030 0)m l/100 g,B组分别为(199.60±32.237)m l/m in和(15.869±2.891 3)m l/100 g,组间差异均有统计学意义(P<0.05)。DSA显示,A组中13只为单个病灶,6只为2个以上病灶,1只未见明显病灶,19只可见肿瘤染色,1只未见明显肿瘤染色;B组中1只为单个病灶,19只为2个以上病灶,全部可见肿瘤染色。结论经肝种植VX2细胞悬液建模的成功率为100%,高于经脾种植VX2细胞悬液(84%)法,后者肝内病变多为多个病灶,大部分有强化,多为环形染色,更接近人肝转移瘤的影像表现。
肝转移瘤;VX2瘤株;动物模型
肝脏是恶性肿瘤最易发生转移的器官之一,在西方国家肝转移瘤的发病率是原发性肝癌的20倍,在我国两者的发病率大致相当,但随着我国乙型肝炎的有效预防,肝转移瘤比例还将增加[1],其治疗也越来越为临床医师重视。制备适合的肝转移瘤动物模型非常重要,可供临床和基础研究,为改进和发展肝转移瘤的治疗以及探索新的治疗方法提供良好基础。目前,通过种植VX2瘤株建立兔肝转移瘤模型已有应用,但种植方法较多,通常主要有两种,一种是直接将VX2瘤株种植于兔肝脏,另一种是种植于脾脏,随之发生肝转移。两种方法均可成功建立动物模型,但究竟哪种方法建立的模型更符合人类肝转移瘤特点,尚无定论。本文通过影像学表现比较两种建模方法的优劣,为临床和基础研究提供数据。
1 材料与方法
50只普通级新西兰大白兔,雌雄不限,体重2.8~3.5 kg,随机分为两组,每组25只。A组麻醉后仰卧位固定,于剑突下腹部正中纵行逐层切开腹壁,暴露肝脏,用1m l注射器斜向穿入肝组织,缓慢注入浓度1×107/m l的VX2细胞悬液1 ml。B组麻醉后仰卧位固定,沿左侧肋弓下缘逐层切开腹壁,暴露脾脏(有时需翻转胃及肠管),牵拉出脾脏,用1 ml注射器斜向穿入脾脏组织,缓慢注入浓度1× 107/ml VX2细胞悬液1m l。接种瘤株后第14天行CT灌注扫描,第15天行数字减影血管造影(DSA)。分别观察CT扫描表现(肝内病变数目及强化特点)、血管造影表现(肝内病变数目及染色情况)及CT灌注扫描参数[肝内病变处与周围正常肝组织血流量(BF)和血容量(BV)差值]的比较。
1.1 CT灌注扫描
80 kV,200 mA,层厚2.5 mm,延时5 s,总共扫描时间12 s,灌注扫描间隔时间1 s,共扫描5次,共采集192幅图,对比剂(碘佛醇注射液350)注射速度为1m l/s,注射总量为4m l。将图像及数据用CT机软件包中的肝脏肿瘤灌注模式进行后处理,设定腹主动脉为流入动脉,门静脉为流入静脉,分别选取肝内病灶强化最明显的部位和病灶周围正常肝组织为兴趣区,以扫描时间为横坐标,密度强度为纵坐标,得到时间-密度曲线(time-density curve,TDC)及相对应的伪彩图,软件自动计算出兴趣区的灌注参数。
1.2 DSA造影
动物麻醉后仰卧位固定,暴露并穿刺右侧股动脉,在透视监视下将Stride微导管分别选入腹主动脉(造影速率2 m l/s,总量4 ml,采集速率3帧/s,采集时间20 s)、腹腔干(造影速率1.5 ml/s,总量4 m l,采集速率3帧/s,采集时间20 s)、脾动脉(造影速率1 ml/s,总量3 m l,采集速率3帧/s,采集时间20 s)及肝固有动脉(造影速率0.5 ml/s,总量2 m l,采集速率3帧/s,采集时间20 s)造影(兔腹腔干及分支解剖与人大致相同),观察肝脏及脾脏病变血管造影表现。
2 结果
A组25只新西兰大白兔经解剖病理证实建模全部成功,其中2只在CT灌注扫描后死亡(未行血管造影),2只未能测出CT灌注扫描BV值及BF值,1只在行血管造影前麻醉后死亡;共有20只完成CT灌注扫描及血管造影,并完成所有观察指标。B组25只新西兰大白兔中,2只在接种VX2细胞悬液后10 d死亡,2只在接种后12 d死亡,死亡后解剖发现4只均出现腹腔转移,有大量腹水,肝脏均未见明显转移病灶,有21只成功建立模型,其中1只在CT灌注扫描后死亡(未行血管造影);共有20只成功完成CT灌注扫描及血管造影,并完成所有观察指标。
A组肝内病变部位与周围正常肝组织BF值差值为(264.58±59.132)m l/min,B组为(199.60± 32.237)ml/min,组间差异有统计学意义(P=0.01)。A组肝内病变部位与周围正常肝组织BV值差值为(19.541±4.030 0)m l/100 g,B组为(15.869± 2.891 3)m l/100 g,组间差异有统计学意义(P= 0.003),见图1。
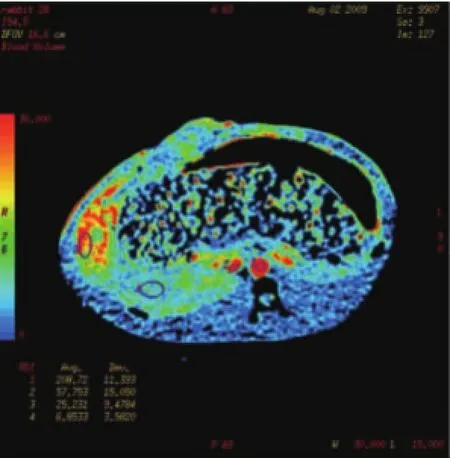
图1 CT灌注扫描相对应的伪彩图
A组20只成功完成CT灌注扫描及血管造影的动物中,16只为单个病灶,4只为2个以上病灶,19只可见强化(其中4只为环形强化),1只未见强化;B组20只中,3只为单个病灶,17只为2个以上病灶,19只可见强化(其中13只为环形强化),1只未见强化。见图2。
两组血管造影表现为肝动脉稍增粗,肿瘤血管多较纤细,排列紊乱,肿瘤染色为环形、结节状及片状,门静脉通畅,均未见门静脉瘤栓及动静脉瘘。A组20只成功完成CT灌注扫描及血管造影的动物中,13只为单个病灶,6只为2个以上病灶,1只未见明显病灶,19只可见肿瘤染色(其中5只为环形染色,5只为结节状染色,9只为片状染色),1只未见明显肿瘤染色;B组中,1只为单个病灶,19只为2个以上病灶,全部可见肿瘤染色(12只为环形染色,6只为结节状染色,2只为片状染色)。见图3、4。

图2 兔肝内肿瘤环形强化

图3 兔脾脏肿瘤染色
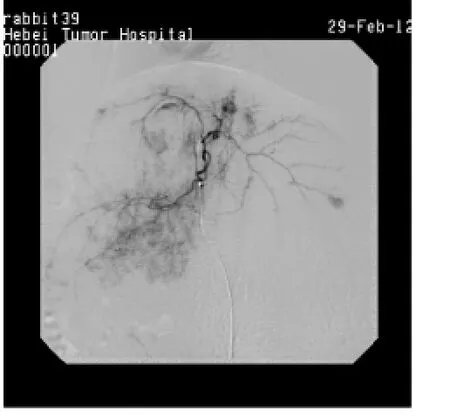
图4 兔肝内多发转移瘤灶
3 讨论
用兔接种VX2瘤株建立肝脏肿瘤模型的方法已有较多应用,国内外学者有经皮穿刺接种或开腹直视下接种组织块或细胞悬液,接种于肝脏或脾脏,都能成功建立模型(成功率均在50%以上)[2],但这种模型更接近于人类哪种肝肿瘤,尚无定论,相关的研究报道也很少。我们通过预实验发现,根据现有的条件、设备,采用开腹直视下在肝脏或脾脏接种细胞悬液的方法,操作简便,模型建立周期较短,且成功率高(80%以上)。由于VX2肿瘤细胞株起源于Shope病毒诱发的兔乳头状瘤[3],其病理类型为鳞癌。采用在肝脏接种VX2细胞悬液方法建立的肝肿瘤模型,从病理上看应该为肝转移瘤,但从其产生途径及生长方式上来看,似乎更接近于原发性肝癌;在脾脏接种方法建立的肝肿瘤模型,从病理、产生途径及生长方式上都应该更接近于肝转移瘤。本实验通过模型建立情况、CT灌注扫描以及DSA造影表现等方面观察,得出以下结论。
3.1 肝转移瘤模型的建立
应用VX2瘤株建立肝转移瘤模型的方法有很多,根据现有的技术和设备条件,本实验选择开腹直视下接种细胞悬液方法。细胞悬液的浓度与模型建立是否成功关系密切,种植的VX2活细胞数≥1×105则成功率可达90~100%,而≤1×104则成瘤率为0;成瘤时间也与接种的细胞数有关,接种细胞少(≥1×105)则成瘤时间长,反之(≥1×106)成瘤时间相对较短[4]。为了保证两组模型能够成功建立,本实验制备待接种的细胞悬液活细胞数为1×107/ml,并且两组细胞悬液量的选择均为1 ml。结果A组模型建立成功率为100%,B组为84%,前者明显高于后者。B组中有3只在接种后不到2周死亡,经解剖发现脾脏已完全为肿瘤组织,与周围组织粘连,腹腔内可见多发转移病灶,并且有大量腹水,肝脏并未发现转移病灶。考虑原因是脾脏血供丰富,肿瘤生长较快,兔脾脏较小,在腹腔内位置相对不固定,周围被腹膜及肠系膜包裹,容易直接侵犯周围组织,还未出现肝脏转移时,动物已死于广泛的腹腔转移。根据王晓东等[3]的研究,模型建立成功后进行下一步实验的时间不宜太晚,本实验选择接种后14 d开始进行下一步实验。
3.2 CT灌注扫描
CT灌注扫描是一种新的功能成像,是基于核医学计算血流量的原理而发展起来的一种新兴技术,除了能显示靶器官的解剖形态学改变,还能通过测量微循环的血流量来评估该组织的生理或病理状态,尤其在评价肝脏占位性病变时有较大优势[5-6]。CT灌注扫描通过软件获得所选兴趣区的时间密度曲线(TDC),计算出组织BF、BV、对比剂平均通过时间(MTT)、肝动脉灌注指数(HAI)及表面通透性(PS)等参数值,同时可形成彩色灌注图像,从而更加全面、直观地了解兴趣区的血流灌注特点及血管生长特性[7]。本实验于接种细胞悬液后14 d行CT灌注扫描,选取肝内病变及周围正常肝组织为兴趣区,根据软件得出2个兴趣区的BF、BV值。A组有2只兔在完成CT灌注扫描后,软件未能得出兴趣区的BF、BV值。考虑原因可能在于实验动物是在深度麻醉下进行CT灌注扫描,麻醉后呼吸幅度较大,呼吸方式为腹式呼吸,在扫描过程中未能有效屏蔽呼吸,这样得出的图像及数据对计算CT灌注参数有影响。由于存在个体差异,本实验选择的观察指标为病变区与周围正常组织BF、BV的差值。兴趣区的选择对数据有一定的影响,因此为避免呼吸影响,尽量选择兼顾所有的层面(包含腹主动脉、门静脉、肝脏内病变及病变周围正常组织);选择病变周围正常肝组织兴趣区时尽量避免包含大血管及病灶周围的异常强化区;选择病变兴趣区时避免包含成形肿瘤血管。A组病变区与正常组织的BF差值的平均值为(264.58±59.132)ml/min,B组为(199.60±32.237)m l/min,组间差异有统计学意义(P=0.001);A组病变区与正常组织的BV差值的平均值为(19.541±4.0300)m l/100 g,B组为(15.869±2.891 3)ml/100 g,组间差异有统计学意义(P=0.003)。由此可见,两组模型肝脏内病变的灌注存在明显差异,说明应用同样的瘤株、同样的活细胞数,接种肝脏和脾脏所建立的肝转移瘤模型肝脏内病变的血流灌注特点存在差异。
3.3 CT扫描表现
在肝脏病变的诊疗中CT扫描已成为常规检查方法之一。过去的普通CT机由于扫描速度慢,对肝脏的病变的诊断受到了一定的影响[7]。而螺旋CT1次屏气即可完成全肝扫描,结合高压注射器,已普遍应用于肝转移瘤的诊断[8]。肝转移瘤具有多发、大小不等及弥漫分布的特点,并且以内部不明显增强,边缘环形增强为主要增强特征[9-10]。本实验中,A组20只中,16只为单个病灶,4只为多个病灶,19只可见动脉期强化,其中4只为环形强化;B组20只中,3只为单个病灶,17只为多个病灶,19只可见动脉期强化,其中13只为环形强化。由此可见,B组肝内病变以多发、动脉期环形强化为特点,这恰恰与人肝转移瘤的CT表现特点相似。因此,B组的肝转移瘤模型更接近于人肝转移瘤。
3.4 DSA造影表现
DSA造影是利用计算机处理数字化影像信息,以消除骨骼和软组织影的减影技术,是新一代血管造影的成像技术,已成为全身血管疾病及肿瘤检查的重要标准之一。血供丰富的肝转移瘤常与肝细胞癌有相似的造影表现,乏血供的肝转移瘤造影表现为肿瘤血管纤细、僵直或包绕,实质期肿瘤染色淡薄或不显影,门静脉期表现为圆形充盈缺损[5]。VX2瘤株相对恶性程度较高,发展较快,因此模型建成后,应尽量缩短血管造影与CT灌注扫描之间的时间,以提高两种检查方法之间的对比性,为避免CT灌注扫描后对比剂存留对血管造影表现的影响以及过量对比剂对动物肾脏的损害,本实验选择于CT灌注扫描后1 d行血管造影。两组模型腹主动脉及腹腔干的造影表现大致相同,腹腔干于第12胸椎至第1腰椎从腹主动脉发出,沿脊柱向上走行,发出脾动脉及肝总动脉,肝总动脉发出肝固有动脉,肝固有动脉稍增粗,肝内肿瘤血管多较纤细,排列紊乱,肝内病灶染色可为环形、结节状及片状,门静脉通畅,显影较早,均未见门静脉瘤栓及动静脉瘘。兔门静脉显影较早考虑是因为兔胃肠道较发达,血管更丰富,血流量相对更大,更多的血液会较快的流入门静脉。两组肝内病变的血管造影表现存在一定差异,A组肝内病变多为单个病灶,大部分有强化,多为片状染色;B组肝内病变多为多个病灶,大部分有强化,多为环形染色。两组共有6只兔CT扫描仅发现单个病变,而血管造影却发现多个病灶,原因在于DSA造影可以更好的检出微小病变。由此可见,B组血管造影表现以多发、环形染色为特点,更接近于人肝转移瘤少血供(血供丰富的肝转移瘤与原发肝癌相似,不具有转移瘤的典型表现)肝转移瘤特点。
总之,经肝种植建立的模型成功率高,并且操作相对简便(兔脾脏细小,在腹腔内位置不固定,增加手术操作难度),但经脾种植建立的模型的CT及血管造影表现更接近于人类肝转移瘤,并且通过CT灌注扫描参数的比较,其血流灌注特点明显不同于经肝种植建立的模型,因此建议在今后的工作中,尽量把经脾种植VX2瘤株建立的肝肿瘤模型作为肝转移瘤模型研究,由此得出的数据、结论才能更好的为人肝转移瘤的研究提供参考。
[1]周大勇,王建华,钱晟,等.肝动脉化疗栓塞术对富血供肝转移瘤的疗效分析[J].介入放射学杂志,2007,16:165-167.
[2]曹玮,王执民,张洪新,等.兔VX2肝癌模型的移植方式及生长特性的研究[J].实用放射学杂志,2003,19:97-99.
[3]王晓东,任军,杨仁杰,等.VX2活细胞数与兔肝癌模型成功率及成瘤时间的关系[J].现代肿瘤医学,2005,13:589-591.
[4]李智岗,时高峰,黄景香,等.应用DSA,CT和经肠系膜上动脉门静脉灌注成像研究肝转移瘤的血液供应[J].中华放射学杂志,2008,42:949-953.
[5]刘新献,龙清云,胡金香,等.TACE联合血管内皮抑素治疗兔VX2肝癌CT灌注与肿瘤血管生成的分析[J].介入放射学杂志,2010,19:893-897.
[6]杨丽,时高峰,许茜,等.螺旋增强双期扫描诊断肝转移瘤的价值[J].中国医学影像学杂志,2006,14:447-449.
[7]李国文,梁赵玉,于小平,等.肝转移瘤血供对肝动脉化疗栓塞的近期疗效影响[J].介入放射学杂志,2010,19:493-496.
[8]范义,刘静华,胡卫东,等.兔VX2肝癌模型制作方法的改进[J].中华临床医师杂志:电子版,2008,2:1038-1044.
[9]Sadahiro S,Suzuki T,Ishikawa K,et al.Pharmacokinetics of 5-fluorouracil following hepatic intra-arterial infusion in a VX2 hepatic metastasismodel[J].Jpn JClin Oncol,2003,33:377-381.
[10]Dzodic R,Gomez-Abuin G,Rougier P,et al.Pharmacokinetic advantage of intra-arterial hepatic oxaliplatin administration: comparative results with cisplatin using a rabbit VX2 tumor model[J].Anticancer Drugs,2004,15:647-650.
[11]马宁,张金玲,赵明,等.兔VX2肝癌模型在肝动脉化疗栓塞术中的研究现状[J].黑龙江医学,2010,34:100-103.
Rabbit models of liver metastases estab lished by im p lanting VX2tumor into the sp leen or the liver: comparison of radiographicmanifestations
SHIBo,LIZhi-gang,WANG Yong-zhong,WU Yong-chao, HAO Xiao-guang,GU Tie-shu.Department of Radiology,Forth Hospital of Hebei Medical University,Shijiazhuang,Hebei Province 050011,China
LIZhi-gang
ObjectiveTo establish the livermetastasismodel in rabbits by implanting VX2tumor into the liver or spleen,to analyze the model establishment condition,the number and enhancement of hepatic lesions on CT scanning,the number and stain of the lesions on digital subtraction angiography,and to compare the parameters(BF and BV)between pathological tissue and normal tissue of liverwith CT perfusion scanning,and to discuss the reasonable and practicalmethod which can establish themodelmore similar to the human livermetastases.M ethods Fifty white rabbitswere random ly and equally divided into two groups. For the rabbits of group A(n=25),oneml of tumor cell suspension was directly injected into the liver,while for the rabbits of group B,one m l of tumor cell suspension was injected into the sp leen.The rabbits were examined by CT perfusion scanning and DSA at14 and 15 days after the inoculation.CTmanifestations,including the number and enhancement characteristics of hepatic lesions,and DSA manifestations,including the number and stain of the lesions,were analyzed.The parameters of CT perfusion scanning were determined,and BF,BV values between pathological tissue and normal tissue of liver were compared. Results Liver metastasis model was successfully established in 25 rabbits of group A and in 21 rabbits of group B.Twenty rabbits in each group were successfully examined byCT perfusion scan and DSA.In group A,single lesion was seen in 16 rabbits,two ormore lesions in 4 rabbits.Enhancementwas detected in 19 lesions and one lesion showed no enhancement.In group B,single lesion was seen in 3 rabbits,two ormore lesions in 17 rabbits.Enhancementwas detected in 19 lesions and one lesion showed no enhancement.In group A,the difference in BF between pathological tissue and normal tissue of liver was(264.58±59.132)m l/min,while that in group B was(199.60±32.237)m l/min.The difference between the two groups was statistically significant(P<0.05).In group A,the difference in BV between pathological tissue and normal tissue of liverwas(19.541±4.030 0)m l/100 g,while that in group B was(15.869±2.891 3)ml/100 g.The difference between the two groupswas statistically significant(P<0.05).DSA showed that in group A single lesion was seen in 13 rabbits,two ormore lesions in 6 rabbits and no obvious lesion could be found in one rabbit.Tumor stain was found in 19 rabbits,no obvious tumor stain could be seen in one rabbit.In group B,single lesion was seen in one rabbit,two ormore lesions in 19 rabbits,and tumor stain could be detected in all lesions.ConclusionThe success rate of model establishment by injecting tumor cell suspension directly into the liver was 100%,which is higher than that by injecting tumor cell suspension into the spleen(84%).The rabbitmodel established by injecting tumor cell suspension into the spleen usually hasmultip le lesions in the liver with ring-shaped enhancement,which ismore similar to the human livermetastases.(JIntervent Radiol,2014,23:236-240)
livermetastasis;VX2tumor;animalmodel
R735.7
B
1008-794X(2014)-03-0236-05
2013-07-19)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.03.014
050011石家庄河北医科大学第四医院放射科
李智岗
