索拉非尼治疗中晚期肝细胞癌安全性和预后因素分析
2014-06-09郑家平邵国良罗君陈玉堂姚征曾晖郝伟远
郑家平,邵国良,罗君,陈玉堂,姚征,曾晖,郝伟远
·肿瘤介入Tumor intervention·
索拉非尼治疗中晚期肝细胞癌安全性和预后因素分析
郑家平,邵国良,罗君,陈玉堂,姚征,曾晖,郝伟远
目的探讨索拉非尼治疗中晚期肝细胞癌(HCC)的安全性及影响预后的因素。方法2006年2月—2012年12月,89例中晚期HCC患者接受索拉非尼靶向治疗。采用单因素和多因素分析患者各项临床病理学参数与其预后的关系,并观察索拉非尼相关不良反应。结果74例患者可作疗效评价,死亡45例,存活27例,失访2例。疾病控制率(DCR)85.14%。中位肿瘤进展时间(mTTP)6.53个月(95%CI: 4.79~8.26个月),中位总生存时间(mOS)9.93个月(95%CI:8.13~11.74个月)。单因素分析发现,PS评分、Child-Pugh分级、BCLC分期、肿瘤血管侵犯及不同的治疗模式对预后的影响有统计学意义。进一步多因素分析发现,Child-Pugh分级和治疗模式是患者预后的独立影响因素(P<0.05)。服用索拉非尼主要不良反应为手足皮肤反应、消化道不良反应、乏力、骨髓抑制等。结论肝功能良好的HCC患者采用TACE术后序贯索拉非尼治疗可获得较长的生存时间和疾病稳定状态。口服索拉非尼不良反应大多可以耐受。
癌,肝细胞;索拉非尼;治疗
肝细胞肝癌(HCC)是常见的恶性肿瘤。索拉非尼具有抑制肿瘤新生血管形成和抑制肿瘤细胞增殖的双重作用[1]。在HCC药物治疗中是唯一被临床证实能够延长晚期HCC患者总生存期(overall survival,OS),且安全性较好的药物[2-3]。中位OS和中位肿瘤进展时间(to tumor progress,TTP)可延长1~3个月。最近亚太多中心亚组研究显示,无论患者基线如何,索拉非尼治疗晚期HCC均安全有效,能显著延长OS和TTP[4]。本研究旨在进一步探索索拉非尼治疗中晚期HCC患者的安全性及影响预后的因素。
1 材料与方法
1.1 临床资料
1.1.1 入选条件①年龄≥18岁;②组织学或临床诊断为HCC[5];③PS评分0~2;④未接受全身化疗;⑤预计生存期≥12周;⑥实验室检查,白细胞计数≥3×109/L,血小板计数≥60×109/ L,血红蛋白≥85 g/L;总胆红素≤1.5倍正常上限,丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)≤5倍正常上限;血清肌酐水平≤1.5倍正常上限;凝血酶原时间较正常延长≤6 s(表1)。

表1 入组患者临床资料
1.1.2 排除标准①中枢神经系统转移;②严重的基础疾病,包括心脏病、感染及肾功能不全等;③难以控制的高血压;④30 d内有大手术或消化道出血史。
1.2 方法
1.2.1 治疗方法2006年2月—2012年12月,共有89例中晚期HCC患者入组,其中男76例,女13例。我们的研究按照患者意愿分为3组,①单药组(n=10):患者只接受索拉非尼单药治疗,未接受其他系统和(或)介入治疗。②序贯组(n=39):TACE术后,病灶稳定(stable disease,SD),序贯接受索拉非尼,口服索拉非尼时间为TACE术后3~7 d。TACE方法[6]:均采用Seldinger技术,经皮股动脉穿刺置入4~5 F肝管(RH导管,美国Cook公司或日本Terumo公司),必要时使用3 F微导管(日本ASAHI公司或美国Cook公司)技术超选择至肿瘤供血动脉,注入化疗药物(铂类、吡喃阿霉素、羟基喜树碱等)和超液态碘油(5~20 ml,视病灶大小、数目等情况进行相应调整)的混悬液。TACE次数视病情可重复多次进行,间隔时间4~6周。③补救组(n=40):TACE术后,疾病进展(progress disease,PD)后联合索拉非尼。
索拉非尼的初始剂量为400 mg/次,2次/d。出现不良反应时,应根据药品说明书进行剂量调整。停药指征为患者出现不能耐受的不良反应或死亡,或患者要求停止治疗。在治疗期间,患者每4~6周回访,记录用药情况及不良反应。
1.2.2 疗效评价完成2个周期治疗后采用mRECIST[7]对疗效进行评估,分为完全缓解(CR)、部分缓解(PR)、SD和PD。以CR+PR计算有效率(RR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。TTP定义为自索拉非尼口服开始至疾病进展的时间。不良反应按CTCAE 3.0标准判定[8]。
1.3 统计学方法
采用SPSS16.0软件进行统计学分析。选取10个可能影响预后的临床病理学参数进行单因素和多因素分析(Cox比例风险模型)。生存率采用Kaplan-Meier Log-rank test进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤近期疗效和生存随访
截止到2013年3月,74例患者可作疗效评价,死亡45例,存活27例,失访2例。DCR(CR+PR+ SD)(0+8+55)85.14%。15例未能获得疗效评估,其中4例口服索拉非尼2周后放弃治疗;1例失访;10例出现无法耐受不良反应,放弃治疗。mTTP 6.53个月(95%CI:4.79~8.26个月),mOS 9.93个月(95%CI:8.13~11.74个月)。
2.2 生存分析
将表1中影响OS的10个因素分别行单因素分析,以P<0.05为检验水准,筛选出与OS显著相关的6个因素,PS评分(P=0.000)、Child-Pugh分级(P=0.000)、BCLC分期(P=0.000)、肿瘤血管侵犯(P=0.024)、治疗模式(P=0.032),余变量差异无统计学意义(P>0.05)。多因素回归模型分析,得到2个独立影响因子:Child-Pugh分级(P=0.021)、治疗模式(P=0.045)(表2)。最后对2个独立因子进行生存率分析,结果显示:良好的肝功能分级和TACE序贯索拉非尼显著延长mOS(图1、2,表3、4)。

表2 影响OS的有统计学意义的因素
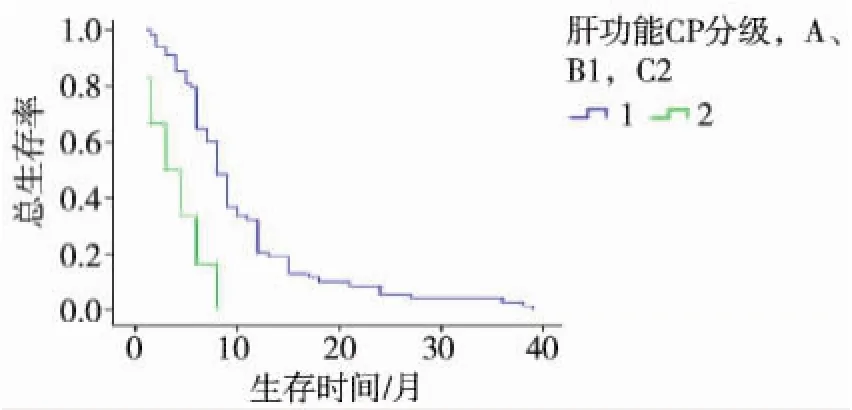
图1 不同肝功能CP分级患者生存曲线
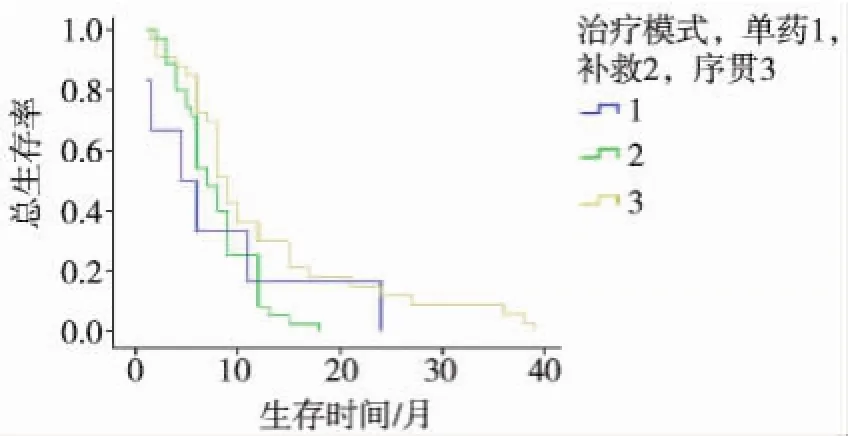
图2 不同治疗模式患者的生存曲线

表3 不同肝功能分级患者生存率

表4 不同治疗模式患者的生存率
2.3 不良反应
服用索拉非尼主要不良反应为手、足和皮肤反应,消化道不良反应,乏力和骨髓抑制等(表5)。
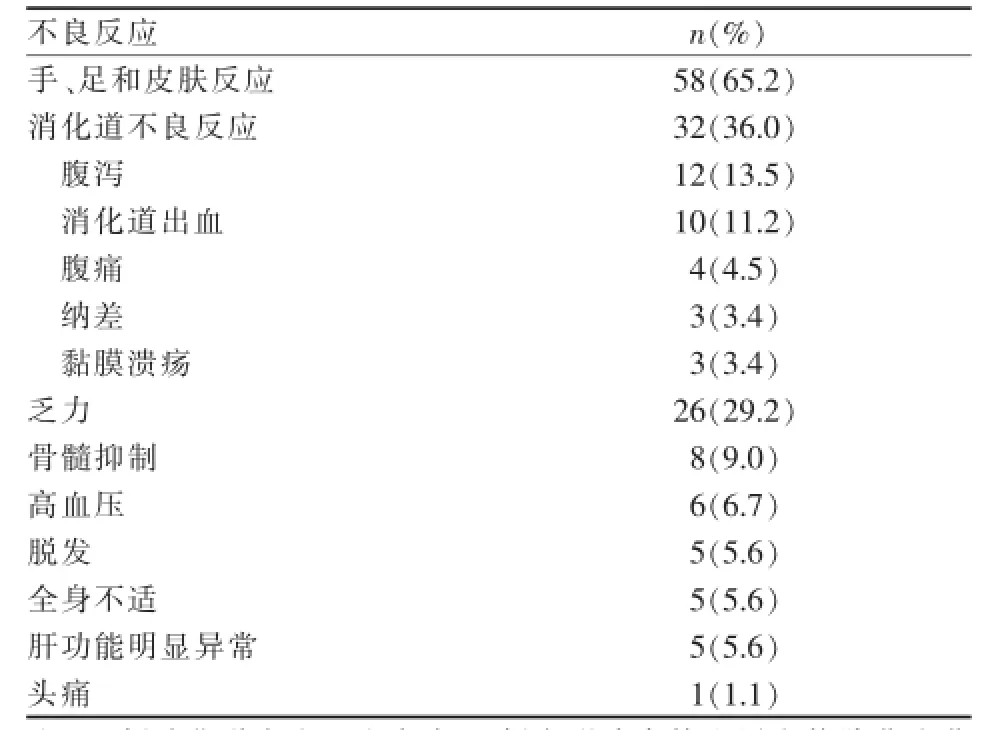
表5 索拉非尼治疗89例中晚期HCC患者的不良反应
3 讨论
本研究表明良好的肝功能、采用TACE术后序贯联合索拉非尼的治疗模式是提高中晚期HCC患者OS的关键。
索拉非尼具有抑制肿瘤新生血管形成和抑制肿瘤细胞增殖的双重作用,一方面通过抑制Raf/ MEK/ERK信号传导通路直接抑制肿瘤生长;另一方面通过抑制数种与新生血管生成有关受体的活性,包括血管内皮生长因子受体1(VEGFR1),VEGFR2,VEGFR3,和血小板衍生的生长因子受体β(PDGFR-β),阻断肿瘤新生血管生成[2]。索拉非尼无论单药还是联合TACE均能延长HCC患者OS[1-2,6,8-9]。但需探索,预测索拉非尼疗效的血清学和基于组织学的分子生物学标志物[10]。
多项研究认为,良好的肝功能或低PS评分或无血管侵犯可能是预测索拉非尼疗效的影响因子[10-13]。本研究结论基本符合上述观点。我们的研究显示CP评分A/B与C比较,mOS得到明显延长(10.456个月比4.0个月),一般认为,良好的肝功能储备无疑有助于提高患者对索拉非尼的耐受性及增加同步接受其他抗肿瘤治疗的机会。本研究观察到的现象与Tsukui等[12]和Pinter等[13]报道一致:CP评分对患者OS具有独立影响作用。另外,我们发现,单因素分析无血管侵犯可明显延长患者OS(P= 0.024),但多因素分析未能显示具有统计学差异,这与Iavarone等[11]及Tsukui等[12]的研究不一致。因此需要进一步扩大样本量加以验证。此外,Sansonno等[10]认为序贯治疗模式相对比安慰剂而言,明显延长HCC患者TTP。我们的研究表明序贯治疗明显优于单药模式和补救模式,能明显延长mOS(P<0.05),提示TACE仍是中晚期HCC首选微创治疗,序贯联合索拉非尼可能是目前最佳治疗方案,而不是待TACE术后患者PD后采用索拉非尼进行补救,因此有理由相信,对于中晚期HCC,TACE联合索拉非尼的时间越早越好。
口服索拉非尼不良事件发生率高,最常见仍是手、足和皮肤反应和消化道不良反应。本组有10例患者出现不能耐受严重不良反应,致使治疗中断。瑞士研究显示,50例HCC患者接受TACE联合索拉非尼序贯治疗,其中出现3级以上严重不良事件32起,直接导致9例住院治疗,死亡4例,临床试验随之被迫中止[14]。临床上一旦出现3级以上不良反应,一般采取调整药物剂量或暂停服药,结果可能影响疗效[14-15],因此必须提高索拉非尼相关不良事件的处理能力。
本研究亦有许多不足之处:①作为回顾性的临床随访研究,可信度降低;②总体变量较多,病例数仍偏少;③我们的研究将PS评分0~1和2之间进行分层分析,由于PS评分2的患者均为2009年之前纳入研究的患者,样本量少(n=7),造成了统计学的偏移,降低了研究结果的可信度。后续我们将拟对PS评分0与1之间进行分层分析。
[1]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised,doubleblind,placebo-controlled trial[J].LancetOncol,2009,10:25-34.
[2]Lovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl JMed,2008,359:378-390.
[3]Zhu AX.Development of sorafenib and othermolecularly targeted agents in hepatocellular carcinoma[J].Cancer,2008,112:250-259.
[4]Cheng AL,Guan Z,Chen Z,et al.Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma according to baseline status:subset analyses of the phaseⅢSorafenib Asia-Pacific trial[J].Eur JCancer,2012,48:1452-1465.
[5]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16:929-946.
[6]Llovet JM,Bruix J.Systematic review of randomized trials for unresectable hepatocellular carcinoma:Chemoembolization improves survival[J].Hepatology,2003,37:429-442.
[7]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur JCancer,2009,45:228-247.
[8]Sergio A,Cristofori C,Cardin R,et al.Transcatheter arterial chemoembolization(TACE)in hepatocellular carcinoma(HCC): the role of angiogenesis and invasiveness[J].Am JGastroenterol,2008,103:914-921.
[9]魏照光,陆骊工,邵培坚,等.肝动脉化疗栓塞联合索拉非尼治疗中晚期肝细胞癌的临床疗效观察[J].中华放射学杂志,2012,46:252-256.
[10]Sansonno D,Lauletta G,Russi S,et al.Transarterial chemoembolization plus sorafenib:a sequential therapeutic scheme for HCV-related intermediate-stage hepatocellular carcinoma:a randomized clinical trial[J].Oncologist,2012,17:359-366.
[11]Iavarone M,Cabibbo G,Piscaglia F,et al.Field-practice study of sorafenib therapy for hepatocellular carcinoma:a prospective multicenter study in Italy[J].Hepatology,2011,54:2055-2063.
[12]Tsukui Y,Mochizuki H,Hoshino Y,et al.Factors contributing to the overall survival in patients with hepatocellular carcinoma treated by sorafenib[J].Hepatogastroenterology,2012,59: 2536-2539.
[13]Pinter M,Sieghart W,Hucke F,et al.Prognostic factors in patients with advanced hepatocellular carcinoma treated with sorafenib[J].Aliment Pharmacol Ther,2011,34:949-959.
[14]Sieghart W,Pinter M,Reisegger M,et al.Conventional transarterial chemoembolisation in combination with sorafenib for patients with hepatocellular carcinoma:a pilot study[J].Eur Radiol,2012,22:1214-1223.
[15]Kudo M,Imanaka K,Chida N,et al.PhaseⅢstudy of sorafenib after transarterial chemoembolisation in Japanese and Korean patients with unresectable hepatocellular carcinoma[J]. Eur JCancer,2011,47:2117-2127.
Sorafenib f or the treatment of intermediate-advanced hepatocellular carcinomas:its safety and prognostic factors
ZHENG Jia-ping,SHAO Guo-liang,LUO Jun,CHEN Yu-tang,YAO Zheng,ZENG Hui,HAO Wei-yuan.Department of Interventional Radiology,Zhejiang Provincial Cancer Hospital,Hangzhou,Zhejiang Province 310022,China
SHAOGuo-liang,E-mail:1438238471@qq.com
ObjectiveTo discuss the safety and prognostic factorsof sorafenib in treating intermediateadvanced hepatocellular carcinoma(HCC).M ethods From February 2006 to December 2012,eighty-nine patients with pathologically-or clinically-confirmed HCC were treated with sorafenib targeted therapy.Ten factors,including gender,age,PS score,Child-Pugh,BCLC stage,AFP,vascular invasion,metastasis,therapy model,and regular oral sorafenib,were evaluated by using univariate analysis and multivariate analysis.The adverse events thatwere related to sorafenib targeted therapy were recorded.Resu lts Followup made in March 2013 showed that 27 patients survived,45 patients died,and 2 patients were lost in touch.The disease control rate(DCR)was 85.14%,mTTP 6.53months(95%CI:4.79-8.26),mOS 9.93 months(95%CI:8.13-11.74).Univariate analysis indicated that low PSscore,low Child-Pugh(CP)score,early BCLC stage,non-vascular invasion,and sequential therapy model were significantly associated with longer overall survival(OS)(P<0.05).Multivariate analysis showed that CP score and therapy model were the independent prognostic factors(P<0.05).The adverse events related to oral sorafenib included mainly hand-foot skin reaction,adverse effect of gastrointestinal tract,fatigue,marrow suppression,etc.ConclusionThe sufficient liver function and TACE with postoperative sequential oral sorafenib can prolong survival time aswell as disease-stable duration.The sorafenib-related adverse events can be well tolerated by the patients.(J Intervent Radiol,2014,23:222-225)
carcinoma,hepatocellular;sorafenib;therapy
R735.7
A
1008-794X(2014)-03-0222-04
2013-05-08)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.03.010
浙江省卫生高层次创新人才培养工程基金
310022杭州浙江省肿瘤医院介入科
邵国良E-mail:1438238471@qq.com
