具有空心结构的Ni/SiO2催化剂上间二硝基苯加氢制间苯二胺*
2014-06-09杜芳林
盖 超,杜芳林
(青岛科技大学 材料科学与工程学院,山东 青岛 266042)
间苯二胺是一种重要的有机合成原料和中间体。由于具有较强的耦和能力,被广泛应用于制造偶氮染料、恶嗪染料、活性染料和硫化染料,同时还用于石油添加剂和橡胶老化剂等[1-3]。工业上普遍采用化学还原法,即采用硫化碱、铁粉[4-7]等在酸性介质中将间二硝基苯还原制得间苯二胺。此工艺虽简单,但产生难以处理的有毒铁泥和废水,环境污染严重。电解还原法虽有报道[5,8],但其产率低且电流效率低,难以实现工业化。相比之下,催化加氢还原法是一种相对比较先进的生产工艺,具有产品质量好、三废少及后处理容易等优点,因而具有广阔的应用发展前景。目前研究的间二硝基苯加氢催化剂主要是Raney Ni[9-11]和贵金属[12-14](如Pt、Pd等),前者制备时会造成环境污染,而后者价格昂贵。负载型镍基催化剂由于具有活性高、环境友好的优点,广泛用于多种加氢反应中。近年来,研究者对具有介孔和空心结构的Ni/SiO2催化剂制备和性能有较多关注[15-19],而其在间二硝基苯催化加氢中的应用较少。
作者以乙酸镍为镍源,二氧化硅为模板,通过牺牲模板/界面反应法,在水热条件下合成了具有介孔结构的碱式硅酸镍空心微球前驱体,经氢气还原后制备了具有空心结构的Ni/SiO2催化剂,通过XRD、TEM、SEM、BET等方法对催化剂进行了表征。再将其应用于间二硝基苯催化加氢制备间苯二胺的反应中,考察了催化剂结构、反应时间、反应温度、反应压力对该反应的影响。
1 实验部分
1.1 催化剂的制备
采用水热法一步制备Ni3Si2O5(OH)4空心微球。典型过程如下:0.996 g Ni(Ac)2·4H2O溶于50 mL去离子水,加入0.12 g SiO2(Stöber方法制备),超声分散后,移入高压釜中,453 K下水热反应12 h。冷却至室温,离心分离,沉淀物分别用去离子水、无水乙醇洗涤3次,373 K下干燥后得到Ni3Si2O5(OH)4前驱体。
将Ni3Si2O5(OH)4前驱体平铺于瓷舟中,放入管式炉中,在823 K下通入氢气还原3 h,冷却至室温后,得到黑色粉末,收集样品备用。
1.2 催化剂的表征
采用日本理学(Rigaku)株式会社D/Max 2500PC型X-射线衍射仪(XRD)分析样品的组成,Cu靶Kα射线,管电流100 mA,管电压40 kV,λ =0.154 178 nm;采用日本电子公司(JEOL)JEM-2100EX型透射电子显微镜(TEM)观察样品的表面微观结构和形貌,操作电压160 kV,取少量试样分散在无水乙醇中,经超声分散15 min后,使试样充分分散,用直径为3 mm覆盖碳膜的圆形小铜网在分散溶液中取样,用滤纸吸干,放入电镜中进行观察;采用日本电子公司(JEOL)JSM-6700F型扫描电子显微镜(SEM)观测样品形貌,操作电压10 kV,测试距离约为10 cm,取少量试样用导电胶粘在铜基体上,在JFC-1600型自动镀膜机进行铂金镀膜后进行观察;采用美国Micromeritic公司生产的ASAP2020型比表面积及孔径分析仪对样品的比表面积和孔径分布进行测量,通过BJH原理计算BET比表面积和粒径分布。
1.3 催化剂的评价
间二硝基苯加氢反应在1 000 mL CJ-1型不锈钢高压釜(威海新元化工机械厂)中进行。将7.5 g间二硝基苯、0.6 g Ni/SiO2催化剂、300 mL无水乙醇同时加入到高压釜中,密封后用N2吹扫反应釜内空气3次,再用H2吹扫N23次后,开启加热和搅拌,在(1.5~3)MPa,353~393 K,搅拌速率为500 r/min条件下进行加氢反应。在反应进行的过程中,每隔0.5 h取1次样。采用日本岛津GC-2014型气相色谱仪对其进行分析,Rtx-1毛细管柱,氢火焰离子检测器,柱温为533 K。根据色谱峰的面积计算间二硝基苯的转化率和间苯二胺的选择性。
2 结果与讨论
2.1 合成产物的组分分析
为了研究还原前、后产物的成分组成,进行了XRD分析,见图1。

2θ/(°)a-还原前;b-还原后图1 Ni3Si2O5(OH)4还原、前后的XRD图
由图1a可知,还原前为Ni3Si2O5(OH)4,各衍射峰(002)、(110)、(004)、(200)、(202)、(060)与JCPDS(49-1859)相一致,证明所得产物为碱式硅酸镍。由图1b可知,还原后的产物为Ni/SiO2。各衍射峰(111)、(200)和(220)与JCPDS(04-0850)金属Ni相吻合,并且24°处存在一个宽泛的峰,是非晶态SiO2的特征峰。由此可以证明,还原后的产物是Ni/SiO2。
2.2 还原前、后产物的形貌变化
Ni3Si2O5(OH)4还原前、后的SEM和TEM图见图2。
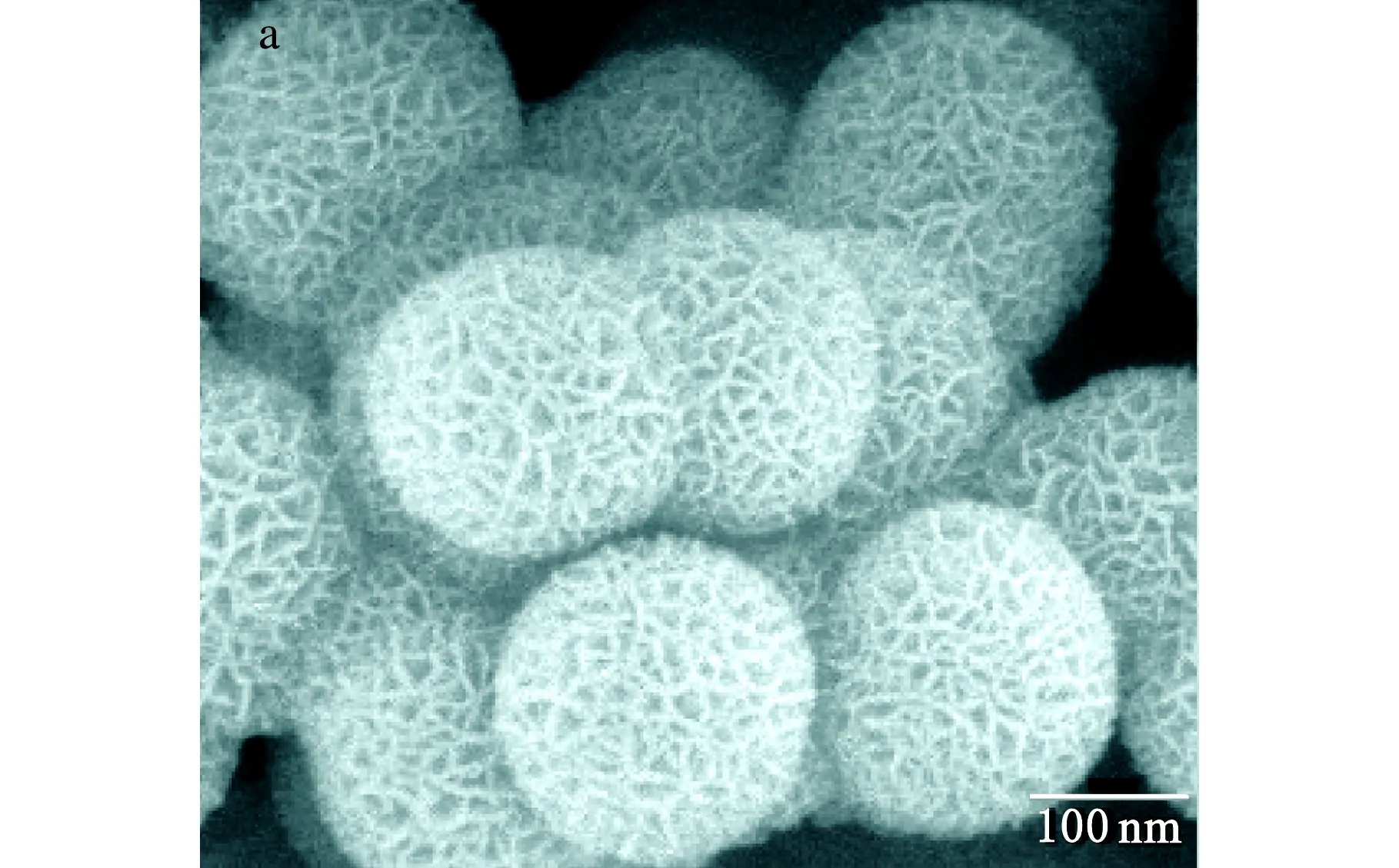



a、b-Ni3Si2O5(OH)4;c、d-Ni/SiO2图2 Ni3Si2O5(OH)4还原前、后的SEM(a,c)和TEM(b,d)图
为了研究823 K下氢气还原后产物的结构是否遭到破坏,对还原前、后的产物进行了SEM和TEM分析。由水热法制备的Ni3Si2O5(OH)4的SEM和TEM照片(图2a和2b)可知,还原前的产物为直径约500 nm的空心微球,表面由针状的纳米线构成,经氢气还原后,由图2c和2d可知,还原后的产物也是直径约500 nm的空心微球,表面微结构与还原前的Ni3Si2O5(OH)4前驱体相同,表明在823K下氢气还原不会破坏产物的形貌和结构,具有形貌的遗传性。前驱体Ni3Si2O5(OH)4空心微球在还原过程中,硅酸盐中的镍离子在原位置逐渐被还原成金属镍,镍之间存在着磁相互作用,从而在还原过程中保持了原有的空心介孔结构,因而其直径和表面结构与还原前相比基本没变。
2.3 还原前、后产物的BET分析
Ni3Si2O5(OH)4还原前、后的N2吸附-脱附和孔径分布曲线见图3。
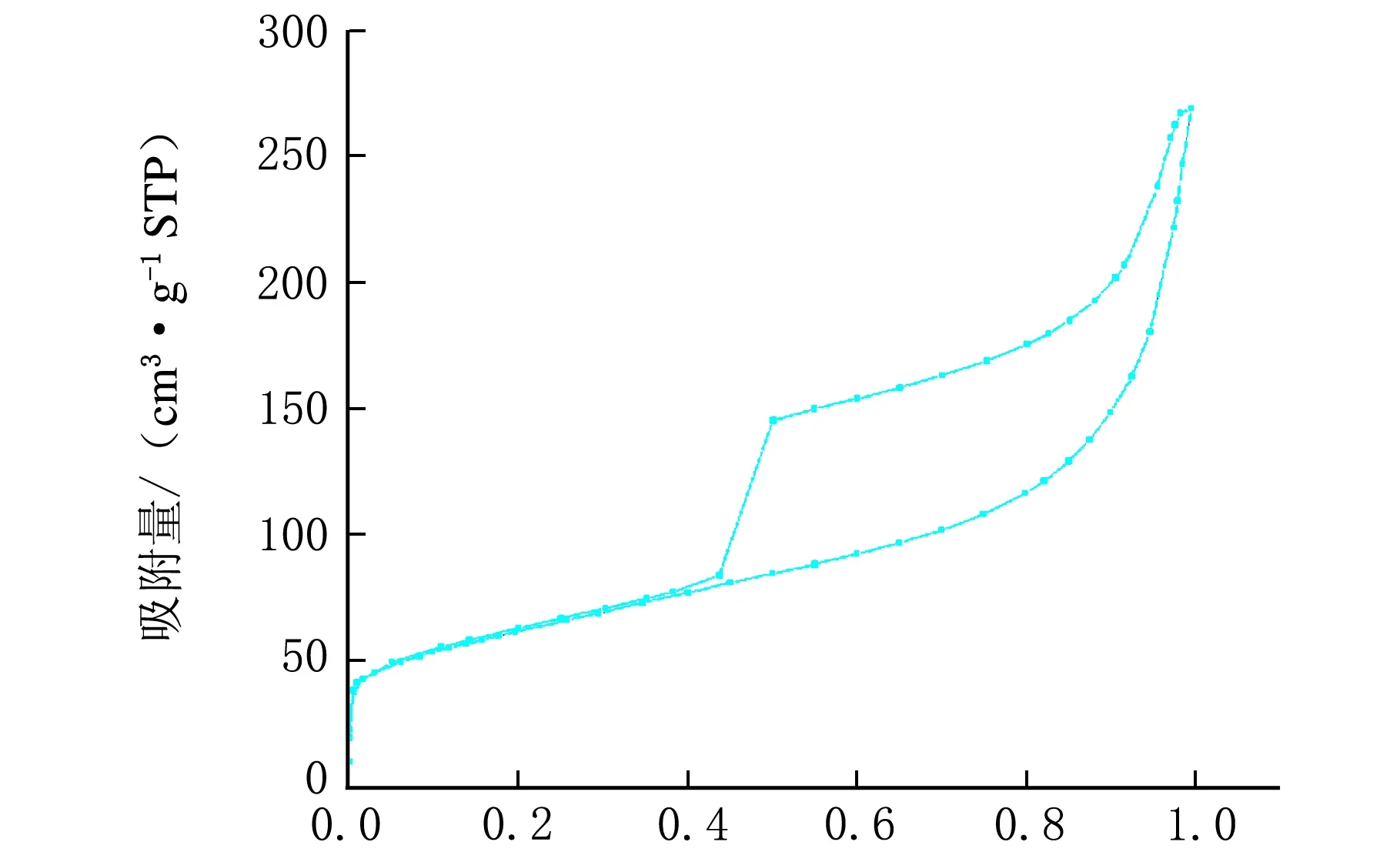
p/p0a-还原前

孔径/nmb-还原前
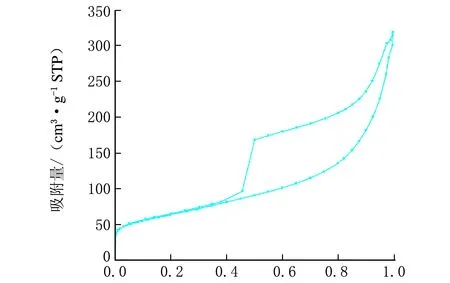
p/p0c-还原后
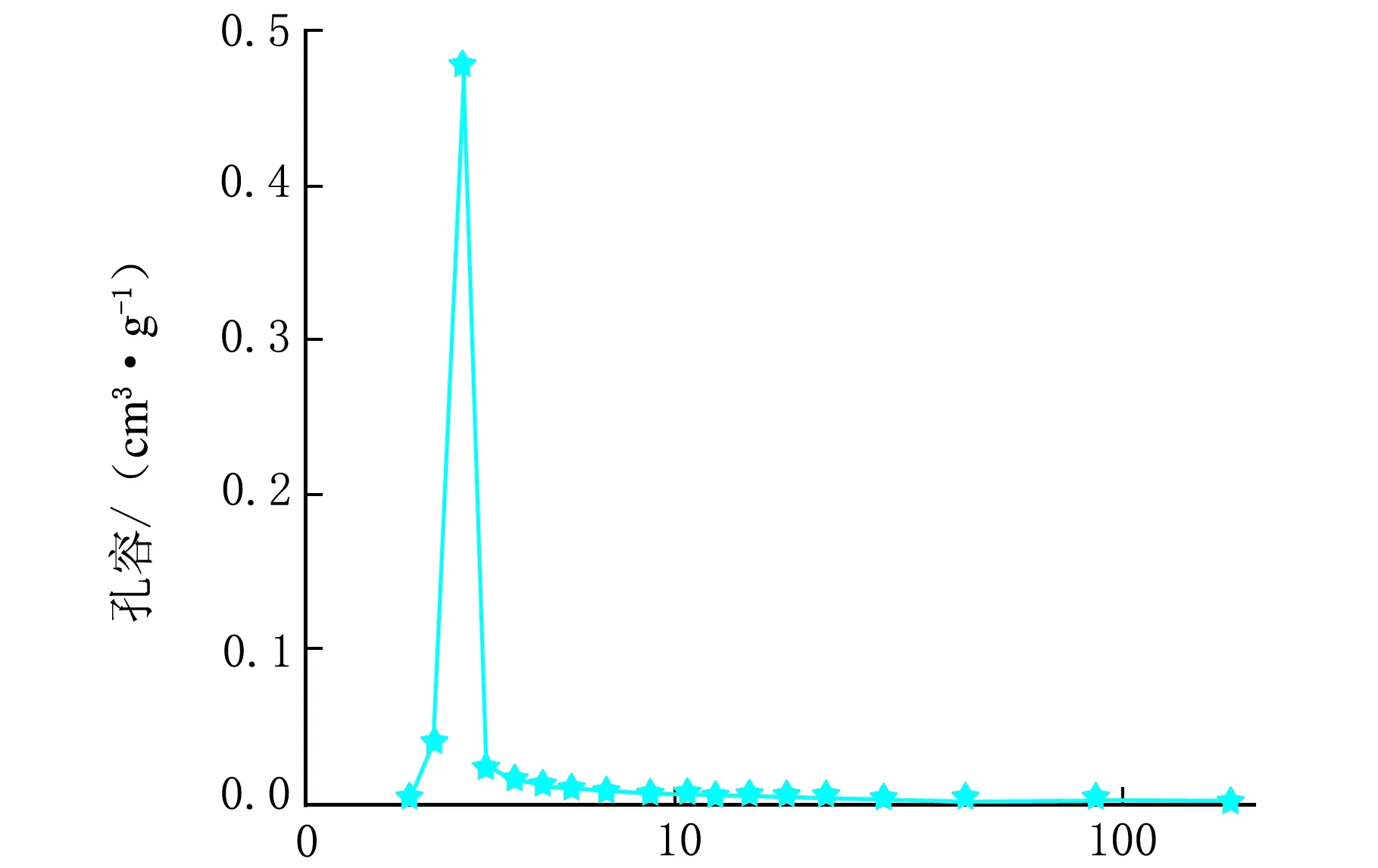
孔径/nmd-还原后图3 Ni3Si2O5(OH)4还原前、后的N2吸附-脱附和孔径分布曲线
从图3可以看出其曲线符合朗缪尔Ⅳ型,是典型的介孔物质。经计算,还原前、后Ni3Si2O5(OH)4和Ni/SiO2微球的BET比表面积分别为214.2 m2/g和222.8 m2/g,孔容分别为0.42 m3/g和0.49 m3/g,介孔大小分别为7.8 nm和8.9 nm,还原前、后其比面积、孔容积和介孔尺寸略有改变,合成的Ni/SiO2催化剂具有相对比较大的比表面积,催化剂微球的壳层有许多内外相通的介孔。这样的介孔结构为球壳外部到球壳内部空间提供了一个有效的传输路径,有利于催化过程中物质传输,提高催化反应的选择性。
2.4 催化剂结构对催化性能的影响
具有不同结构的催化剂对间二硝基苯加氢反应的催化活性测试曲线见图4。催化剂a为具有核壳结构的SiO2/Ni3Si2O5(OH)4还原后的产物,在水热法制备前驱体过程中,控制相对较短的反应时间(如6 h),作为牺牲模板的SiO2核没有被完全消耗掉,形成了内部为SiO2核、外部为Ni3Si2O5(OH)4壳的核壳结构,在氢气气氛下,壳层Ni3Si2O5(OH)4被还原为Ni/SiO2,SiO2核不发生变化。催化剂b为空心Ni3Si2O5(OH)4还原后的产物。

反应时间/h图4 不同结构催化剂的催化活性
由图4转化率曲线可知,2种催化剂上间二硝基苯的转化率随着时间的延长而升高,催化剂b的活性略高于催化剂a,随加氢反应的进行,两者的差距变小,反应时间达3.5 h后,2种催化剂对间二硝基苯的转化率基本相同,都能达到100%。不同结构的催化剂对间苯二胺的选择性影响见图5。催化剂a为核壳结构SiO2/Ni3Si2O5(OH)4还原后的产物,催化剂b为空心Ni3Si2O5(OH)4还原后的产物。由图5曲线的变化趋势可以看出,加氢反应时间小于2.5 h,催化剂a的选择性明显高于催化剂b,随着时间的延长虽然选择性差距逐渐缩小,但催化剂a的选择性仍高于催化剂b。反应时间达3.5 h后,选择性仍有略微差距。此时,催化剂a对间苯二胺的选择性可以达到94%,催化剂b对间苯二胺的选择性达到93%。催化反应的一般规律是,活性越高,选择性越低。3.5 h前,因b的活性比a高(图4),导致b的选择性比a低。
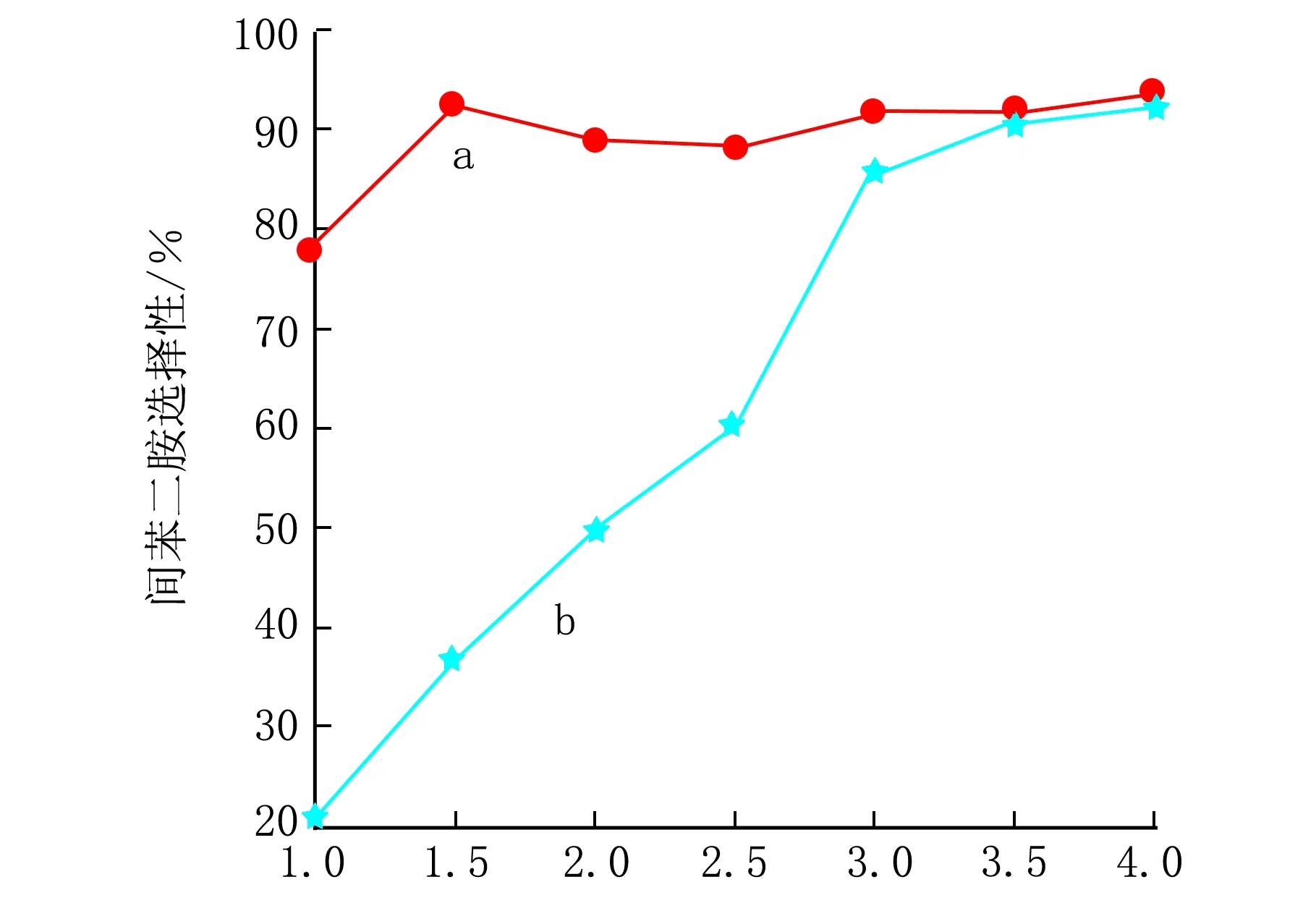
反应时间/h图5 不同结构的催化剂对间苯二胺的选择性影响
2.5 反应温度对催化性能的影响
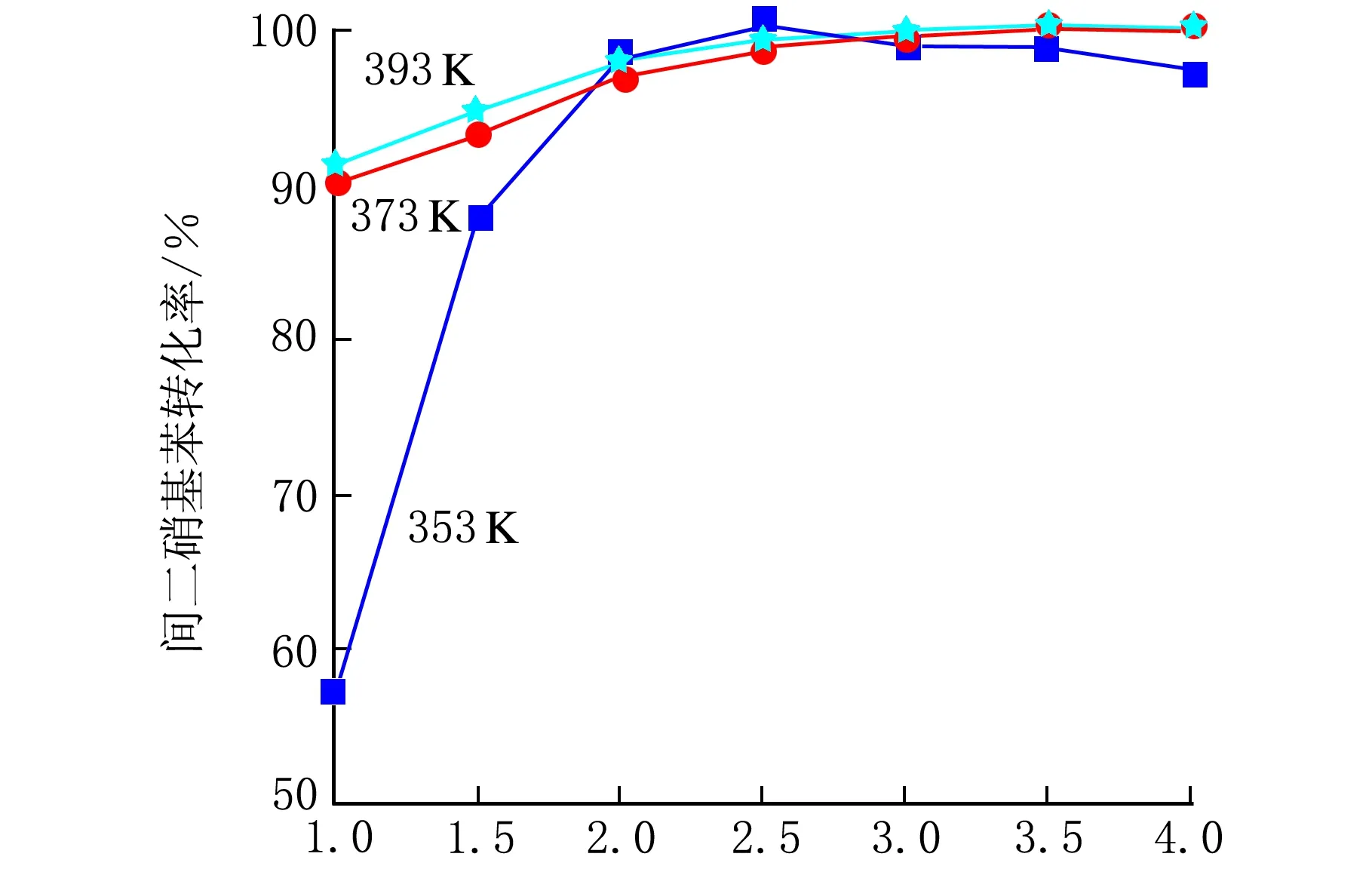
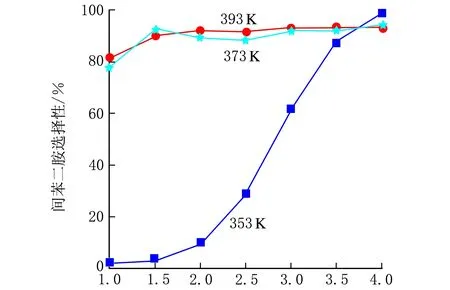
考察了反应温度对间二硝基苯催化加氢反应性能的影响,使用的催化剂是具有空心结构的Ni/SiO2催化剂。不同反应温度下间二硝基苯的转化率及转化为间苯二胺的选择性随反应时间的变化趋势见图6。
反应时间/ha-间二硝基苯的转化率
反应时间/hb-间苯二胺的选择性图6 反应温度对催化性能的影响
由图6a可见,反应未达到2 h,相同时间下,间二硝基苯的转化率随着温度的升高而升高。随着反应时间的延长,转化率增加趋势变缓,各反应温度下间二硝基苯的转化率基本相等,都接近100%。由选择性曲线可看出,反应3.5 h以前,393 K和373 K反应温度下的间二硝基苯转化为间苯二胺的选择性均明显高于353 K。反应4 h后,353 K下的选择性是98%,而其它两者达到93%。综合产率考虑,所以,反应温度应选择373 K。
2.6 反应压力对催化性能的影响
不同反应压力下,间二硝基苯的转化率及转化为间苯二胺的选择性随反应时间的变化趋势见图7,使用的催化剂是具有空心结构的Ni/SiO2催化剂,由图7a可知,在相同的反应时间下,间二硝基苯的转化率随着氢气压力的升高而增大,在反应时间较短的情况下,氢气压力对间二硝基苯的转化率影响很大,随着氢气压力的提高,间二硝基苯的转化率明显提高,随着反应的进行,氢气压力对间二硝基苯转化率的影响变小,当反应4 h后,间二硝基苯的转化率依次为100%、98%、95%。这是因为随着氢气压力的增加,氢气在液相中的溶解度增加,提高了间二硝基苯的加氢反应速度。由生成间苯二胺的选择性变化曲线可看出,氢气压力对间苯二胺的生成影响显著,尤其是反应时间较短时。不同氢气压力下,随着反应的进行,生成间苯二胺的选择性均明显提高。在反应时间小于3 h,氢气压力为2 MPa,生成间苯二胺的选择性明显高于3 MPa和1.5 MPa,而随着反应时间的延长,氢气压力对间苯二胺选择性的影响变小,在反应时间为4 h,在所考察的氢气压力下,生成间苯二胺的选择性均超过80%。综合考虑,反应压力应选择3 MPa。氢气压力变化引起间二硝基苯加氢转化为间苯二胺选择性变化的主要原因是,间二硝基苯加氢生成间苯二胺的过程比较复杂,有许多中间产物生成,在反应时间较短(如1.5 h),虽然从间二硝基苯转化率曲线可知超过60%的反应物已消耗掉,但生成目标产物的量却很低,这些中间产物在加氢过程中能够稳定存在,气相色谱分析也表明了这些中间产物的存在。氢气压力的不同,影响了反应物转化为中间产物、中间产物转化为目标产物的转化速率,导致选择性有不同的变化趋势。

反应时间/ha-间二硝基苯的转化率
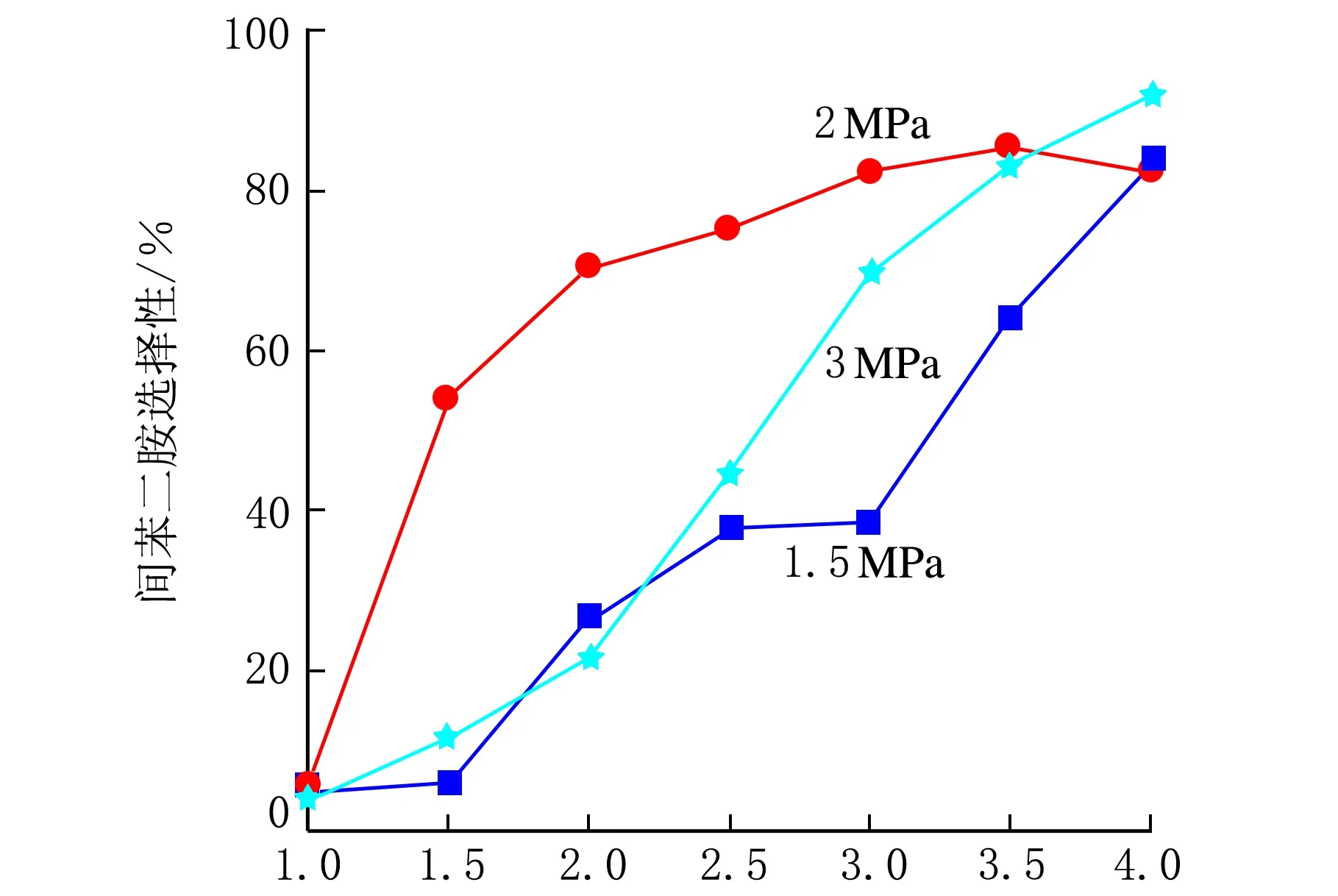
反应时间/hb-间苯二胺的选择性图7 反应压力对催化性能的影响
3 结 论
采用水热法一步合成了Ni3Si2O5(OH)4空心微球,在823 K、氢气气氛下还原,制备了具有空心结构的Ni/SiO2催化剂。通过考察催化剂结构、反应时间、反应温度、反应压力对间二硝基苯催化加氢制备间苯二胺的影响,从而确定最优的反应条件。在反应温度为373 K、反应压力为3 MPa,反应时间为4 h,间二硝基苯的转化率为100%,生成间苯二胺的选择性约为94%。
[ 参 考 文 献 ]
[1] 徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1998:3-335.
[2] 魏文德.有机化工原料大全(下卷)[M].北京:化学工业出版社,1999:800-808.
[3] 姚少华,武学军,李宏勤.混合二硝基苯催化加氢合成苯二胺[J].天津化工,2002,2:21-22.
[4] 贾志刚,李方实.液相催化加氢法制取芳胺的研究进展[J].化工时刊,2004,18(1):1-4.
[5] 侯洁,郭方,王越,等.改性骨架钌催化加氢间二硝基苯制备间硝基苯胺[J].精细化工,2006,23(11):1065-1067.
[6] Khilnani V L,Chandalia S B.Selective hydrogenation Ⅱm-dinitrobenzene tom-nitroaniline using palladium on carbon as catalyst[J].Org Process Res Dev,2001,5:263-266.
[7] 赵磊,陈吉祥,张继炎.负载型镍基催化剂催化加氢合成间苯二胺反应工艺及稳定性的研究[J].石油化工,2005,34(2):160-163.
[8] 刘欣,王金霞,顾登平,等.电化学法制备对氨基苯甲酸[J].精细化工,2006,23(9):921-925.
[9] 赵纯洁,夏少武.骨架镍催化剂的研究进展[J].齐鲁石油化工,2002,30(1):43-47.
[10] 黄乃华,李志斌.催化加氢制备2,3,4-三氟苯胺[J].辽宁化工,1996,4:53.
[11] 沈琴,刘仲能,侯闽渤,等.改性Raney Ni 催化剂用于加氢合成间苯二甲胺[J].精细化工,2000,17(9):544-546.
[12] Chaudhari R V,Jaganathan R,Kolhe D S,et al.Kinetic modeling of hydrogenation of butynediol using 0.2% Pd/C catalyst in a slurry reactor[J].Appl Catal,1987,29(1):141-159.
[13] Torres G C,Jablonski E L,Baronetti G T,et al.Effect of the carbon pre-treatment on the properties and performance for nitrobenzene hydrogenation of Pt/C catalysts[J].Appl Catal A,1997,161(1):213-226.
[14] 赵松林,刘新梅,周娅芬,等.负载型含钌催化剂催化间二硝基苯选择加氢反应[J].石油化工,2004,33:941-943.
[15] Guo Zhi-yan,Du Fang-lin,Li Gui-cun,et al.Controlled synthesis of mesoporous SiO2/Ni3Si2O5(OH)4core-shell microspheres with tunable chamber structures via a self-template method[J].Chem Commun,2008,25:2911-2913.
[16] Wang Yong-qiang,Wang Guo-zhong,Wang Hong-qiang,et al.One-pot synthesis of nanotube-based hierarchical copper silicate hollow spheres[J].Chem Commun,2008(48):6555-6557.
[17] Jin Pu,Chen Qiang-wang,Hao Li-qing,et al.Synthesis and catalytic properties of nickel-silica composite hollow nanospheres[J].Phys Chem B,2004,108:6311-6314.
[18] Jiang P,Bertone J F,Colvin V L.A Lost-wax approach to monodisperse colloids and their crystals[J].Science,2001,291(5503):453-457.
[19] Chen Da-wei,Guo Zhi-yan,Du Fang-lin,et al.Controlled synthesis and catalytic properties of mesoporous nickel-silica core-shell microspheres with tunable chamber structures[J].Mater Res Bull,2012,47:2344-2348.
