高纯度草酸的绿色生产工艺
2014-06-07乔丽燕杜小利肖建雄侯晓伟
乔丽燕,黄 洁,杜小利,闫 东,肖建雄,侯晓伟
(1. 西北大学 陕西省物理无机化学重点实验室,陕西 西安 710069;2. 西安迈克森新材料有限公司,陕西 西安,710077)
高纯度草酸的绿色生产工艺
乔丽燕1,黄 洁1,杜小利1,闫 东1,肖建雄1,侯晓伟2
(1. 西北大学 陕西省物理无机化学重点实验室,陕西 西安 710069;2. 西安迈克森新材料有限公司,陕西 西安,710077)
以多糖为原料,通过硫酸水解、硝酸氧化制得草酸粗品,再通过重结晶提纯草酸,母液用磷酸三丁酯萃取处理后循环利用。利用DSC和HPLC方法分析了草酸粗品用水重结晶处理后的纯度。实验结果表明,水对负载草酸的磷酸三丁酯的最大反萃取量为83.70 g/L,磷酸三丁酯对母液的最大萃取量为134.07 g/L。硫酸催化水解多糖适宜的水解条件为:V(多糖)∶V(H2SO4)=1∶1、70~80 ℃、水解时间4 h,在此条件下,水解液中的葡萄糖约为183.70 g(基于200 mL多糖)。水解液氧化制草酸适宜的氧化条件为:V(多糖)∶V(H2SO4)=1∶1、V(多糖)∶V(HNO3)=1∶2.89、70 ℃,反应时间6 h,在此条件下,反应生成草酸62.43 g(基于200 mL多糖)。
稀土金属;草酸;多糖;硝酸氧化法;萃取分离
伴随稀土工业的发展,稀土在各领域的应用呈快速增长趋势[1-2]。分离提纯稀土的方法有溶剂萃取法[3]和沉淀分离法[4],其中较为有效的分离方法为草酸盐沉淀法。采用该方法一般可有效地分离除钍和碱土金属以外与稀土共存的所有元素,因此,草酸的需求也呈增长趋势。世界草酸的生产主要集中于亚洲[5],我国的草酸年产量约占世界草酸总量的50%以上,年出口量约占总产量的25%~30%,主要出口地区为美国、日本和欧盟等国家。我国加入WTO 后,草酸产品的出口量将大幅增加,为草酸厂的扩能或新建提供了前提条件[6]。
国内工业生产草酸的主要方法有煤制气合成法[7-8]、黄磷尾气合成法[9]及甲酸钠法[10-11]。煤制气合成法主要分两步:煤制乙二醇和乙二醇氧化成草酸,该方法以煤为原料,缺点是煤资源缺乏、生产工艺复杂及生产难度较大。黄磷尾气合成法可有效地实现二次能源的再度利用,降低对环境的污染,但该方法的生产工艺复杂、费用较高。目前工业上生产草酸的工艺技术均存在不同程度的污染环境问题[12-13],因此需研究设计新的生产工艺和技术。多糖氧化法可使用多种农产品原料,工艺简单,投资少,因此有很好的发展前景。
本工作以多糖为原料,通过硫酸水解、硝酸氧化制得草酸粗品,再通过重结晶提纯草酸,母液用磷酸三丁酯萃取处理后循环利用。利用DSC和HPLC表征方法分析了草酸提纯后的纯度。
1 实验部分
1.1 原料与仪器
多糖:工业级,济南晟旺化工有限公司;母液:生产草酸时产生的废液;硫酸、硝酸:AR,洛阳昊华化学试剂有限公司;磷酸三丁酯:AR,天津市恒兴化学试剂制造有限公司。
安捷伦 1200型高效液相色谱仪:安捷伦科技公司;Micro-DSC Ⅲ型示差扫描量热仪:法国Setaram公司。
1.2 实验原理
以多糖为原料,经硫酸水解制得中间产物葡萄糖;再在硝酸和催化剂的作用下将葡萄糖氧化制得草酸粗品;用水重结晶提纯草酸粗品得到高纯度草酸[14-17]。反应产生的废液(即母液)利用磷酸三丁酯萃取处理后,循环利用[18]。反应中产生的氮化物气体用母液吸收[19]。
1.3 实验方法
1.3.1 母液的处理
母液的主要成分为硫酸和草酸,还含有少量糖或硝酸,为解决母液的膨胀问题需对母液进行处理以除去未结晶的草酸,得到较纯净的硫酸。
采用磷酸三丁酯萃取母液去除草酸[20-22],萃取温度20~30 ℃。负载了草酸的磷酸三丁酯用水反萃取再生,反萃取温度20~30 ℃。由于母液中含有未完全反应的糖,使萃取及反萃取实验结果不稳定,因此对不含糖母液进行了萃取及反萃取。
1.3.2 多糖水解
硫酸催化水解多糖:取200 mL多糖于烧杯中,按不同比例加入98%(w)硫酸和一定量的水(水量的确定以达到10 mol/L的酸度为标准),加热搅拌进行水解反应[23-24]。
母液水解多糖:取200 mL多糖于烧杯中,按1∶1(体积比)的量加入已去除草酸的母液,70~80℃下加热水解4 h。当母液中的硫酸浓度不符合水解所需条件时,需在水解前对母液做合适的处理,使母液的酸度维持在10 mol/L。
1.3.3 水解液氧化制草酸
硫酸用量对草酸产率的影响:由于硫酸用量不同对氧化反应有一定的影响,为确定合适的硫酸用量,取200 mL多糖,加入不同量的硫酸,不加催化剂,滴加65%~68%(w)的硝酸,80 ℃下加热氧化7 h,硝酸滴加完成后,90 ℃下加热除去氮氧化物[25]。以生成的草酸的量来确定最佳的硫酸用量。
硝酸用量对草酸产率的影响:取200 mL多糖,加入催化剂,再以一定的比例滴加硝酸,70℃下加热氧化6 h,硝酸滴加完成后,90 ℃下加热除去氮氧化物。以生成的草酸量来确定最佳的硝酸用量。
1.3.4 草酸粗品的提纯和分析
用水对草酸粗品进行重结晶提纯[16,18],分别取草酸粗品、1次重结晶草酸、2次重结晶草酸、3次重结晶草酸、4次重结晶草酸、5次重结晶草酸试样。用高效液相色谱仪测定[23]试样中草酸和单糖的含量。分析条件:Agilent SB-C18(4.6 mm× 250 mm×5 μm) 色谱柱,流动相为0.5%(w)的高氯酸,流量0.5 mL/min,内标物为0.5%(w)的酒石酸,检测波长分别为 220,285 nm,柱温 28 ℃,进样量 20 μL。用示差扫描量热仪测定草酸粗品和重结晶4次后试样的DSC曲线。
2 结果与讨论
2.1 母液的处理
2.1.1 萃取可行性的实验结果
磷酸三丁酯平行萃取的实验结果见表1。由表1可见,萃取后萃余相中的草酸浓度相对母液中的草酸浓度均降低,平均每次萃取量为51.42 g/L;用水反萃取负载草酸的磷酸三丁酯后,水中草酸浓度均增大,平均每次反萃取量为83.70 g/L。因此,用磷酸三丁酯萃取母液和用水反萃取负载草酸的磷酸三丁酯均为可行路线。

表1 磷酸三丁酯平行萃取的实验结果Table 1 Extraction experiments with tributyl phosphate
2.1.2 磷酸三丁酯的最大萃取能力
每次萃取时,油相重复使用磷酸三丁酯,但母液均为新鲜加入,油相经多次重复使用后达到饱和。磷酸三丁酯的最大萃取量见表2。

表2 磷酸三丁酯的最大萃取量Table 2 Maximum extraction of tributyl phosphate
由表2可看出,萃取4次后,油相达到饱和状态,磷酸三丁酯的最大萃取量为前4次萃取量之和(134.07 g/L)。萃取到第5次后,由于油相已达饱和,开始出现反萃取现象。因此,磷酸三丁酯对母液的最大萃取量为134.07 g/L,萃取次数为4次。
2.1.3 不含糖母液的处理结果
不含糖母液中草酸含量100 g/L,硫酸含量6.12 g/L。每次萃取时,油相重复使用磷酸三丁酯,但母液为新鲜加入。不含糖母液的萃取结果见表3。由表3可见,2组平行实验的萃取结果相近,第1组3次萃取量之和为118.69 g/L;第2组3次萃取量之和为122.40 g/L,平均萃取量为120.55 g/L。实验结果表明,磷酸三丁酯对不含糖母液的最大萃取量为120.55 g/L。

表3 不含糖母液的萃取结果Table 3 Extraction results of mother liquor without saccharide
2.2 多糖的水解
2.2.1 硫酸催化水解多糖
多糖水解以硫酸为催化剂,硫酸用量的不同影响水解程度、水解时间及后续的氧化过程。考察了水解条件对多糖水解反应的影响,实验结果见表4。由表4可看出,加热水解比不加热水解的效果好;在反应时间和加热温度相同的条件下,当V(多糖)∶V(H2SO4)=1∶1时,水解效果最好;加热水解4 h产生的葡萄糖量最大。实验结果表明,适宜的水解条件为:V(多糖)∶V(H2SO4)=1∶1、70~80℃、水解4 h,在此条件下,水解液中的葡萄糖约为
183.70 g(葡萄糖产量基于200 mL多糖,下同)。
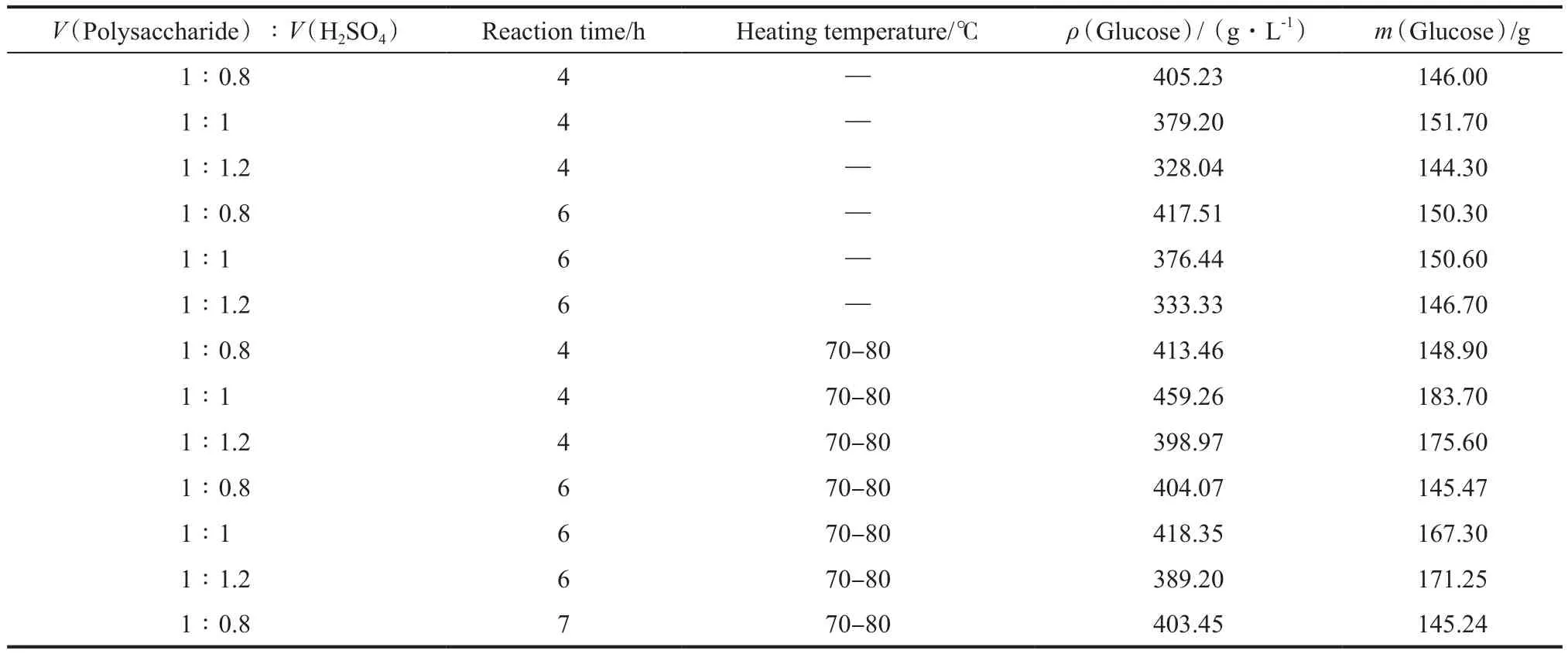
表4 水解条件对多糖水解反应的影响Table 4 Infuences of conditions on the polysaccharide hydrolysis
2.2.2 母液水解多糖
用母液代替硫酸,在适宜的条件下进行多糖水解的反应,实验结果见表5。从表5可看出,利用母液水解得到的水解液中葡萄糖为192.90 g,高于硫酸水解多糖得到的葡萄糖量(183.70 g)。
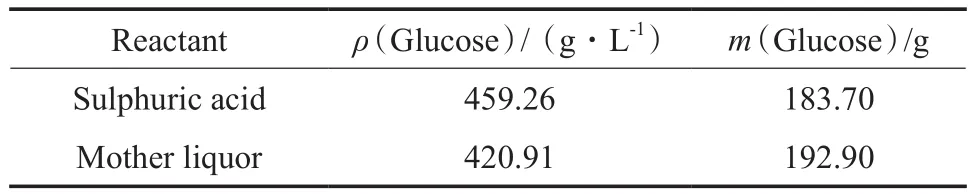
表5 母液水解多糖Table 5 Polysaccharide hydrolysis with the mother liquor
2.3 水解液氧化制草酸
2.3.1 硫酸用量的影响
利用水解液氧化制草酸时,原料多糖均过量,反应结束后溶液均为深红色。硫酸用量对草酸产量的影响见表6。由表6可见,当V(多糖)∶V(H2SO4)=1∶1时,生成的草酸量最多,为55.23 g(草酸产量基于200 mL多糖,下同)。因此,适宜的硫酸用量为V(多糖)∶V(H2SO4)=1∶1。
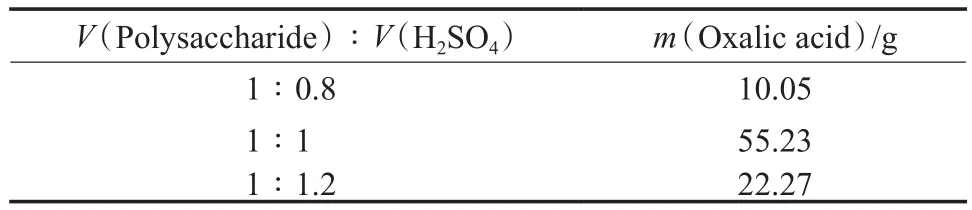
表6 硫酸用量对草酸产量的影响Table 6 Infuence of sulphuric acid dosage on the oxalic acid yield
2.3.2 硝酸用量的影响
硝酸用量对草酸产量的影响见表7。由表7可见,反应时间相同时,不同的硝酸用量产生的草酸量不同。当V(多糖)∶V(硝酸)=1∶2.89时,生成的草酸量最多(62.46 g);当硝酸用量相同时,反应时间6 h与7 h生成的草酸量基本相同。
因此,水解液氧化制草酸适宜的条件为:V(多糖)∶V(H2SO4)=1∶1,V(多糖)∶V(硝酸)= 1∶2.89,70 ℃,反应时间6 h。在此条件下,可生成草酸62.43 g。
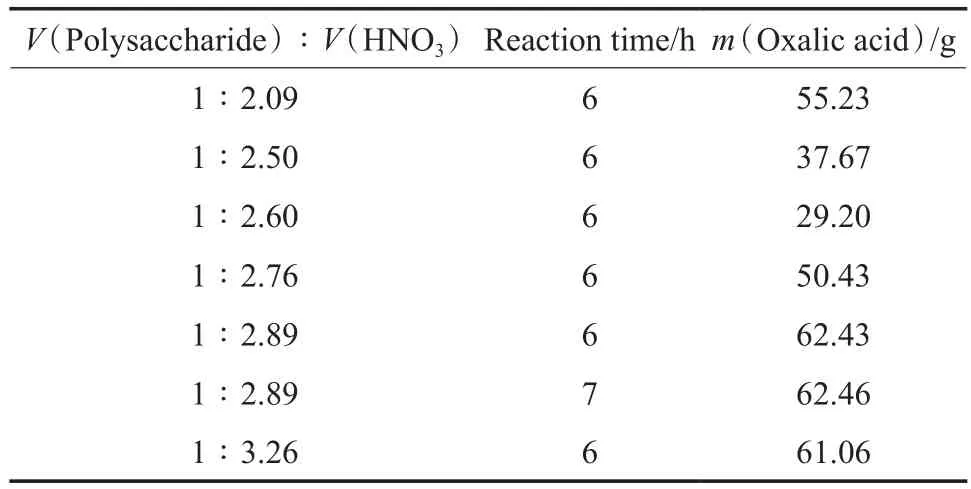
表7 硝酸用量对草酸产量的影响Table 7 Infuence of nitric acid dosage on the oxalic acid yield
2.4 粗品草酸的提纯
2.4.1 HPLC的表征结果
草酸的HPLC表征结果显示,重结晶5次的试样中,杂质含量很低,杂质的峰面积比只有0.687%,符合纯度要求。因此,采用水重结晶处理草酸粗品的方法可行,重结晶次数为5次。
2.4.2 DSC表征结果
草酸试样的DSC曲线见图1。从图1可看出,重结晶4次后试样的纯度均很高,基本无杂质。因此,确定重结晶的次数为5次。

图1 草酸试样的DSC曲线Fig.1 DSC curves of oxalic acid and glucose.a Crude oxalic acid;b Purifed oxalic acid;c Glucose
3 结论
1)对母液的处理可用磷酸三丁酯萃取,再用水反萃取负载草酸的磷酸三丁酯。水对负载草酸的磷酸三丁酯的最大反萃取量为83.70 g/L。磷酸三丁酯对母液的最大萃取量为134.07 g/L,萃取次数为4次。磷酸三丁酯对不含糖母液的最大萃取量为120.55 g/L。
2)硫酸催化水解多糖适宜的水解条件为:V(多糖)∶V(H2SO4)=1∶1、70~80 ℃、水解4 h,在此条件下,水解液中的葡萄糖约为183.70 g。
3)利用母液水解得到的水解液中葡萄糖量高于硫酸水解多糖得到的葡萄糖量。水解液氧化制草酸适宜的条件为:V(多糖)∶V(H2SO4)=1∶1,V(多糖)∶V(硝酸)=1∶2.89,70 ℃,反应时间6 h。在此条件下,可生成草酸62.43 g。
[1] 黄小卫,李红卫,王彩凤,等. 我国稀土工业发展现状及进展[J]. 稀有金属,2007,31(3):279 - 288.
[2] 赵增祺. 快速发展的中国稀土功能材料[J]. 稀土信息,2006(3):12 - 15.
[3] 李建宁,黄小卫,朱兆武,等. P204-P507-H2SO4体系萃取稀土元素的研究[J]. 中国稀土学报,2007,25(1):55 - 58.
[4] 邹冠生,赖兴华,张玉忠. 沉淀法提取混合稀土的工艺条件试验[J]. 佛山大学学报,1992,10(2):68 - 73.
[5] 王东方. 草酸市场前景及生产应用[J]. 化工技术经济,2003,21(3):20 - 22.
[6] 龚世伟,陈金芳. 草酸的生产方法及其进展[J]. 广东化工,2011,38(2):75 - 76.
[ 7] 周张锋,李兆基,潘鹏斌,等. 煤制乙二醇技术进展[J]. 化工进展,2010,29(11):2003 - 2009.
[8] 杨富翔,黄辉华. 煤制醇研究进展[J]. 广东化工,2013,40(11):71 - 72,85.
[9] 陈善继. 黄磷尾气的综合利用[J]. 磷肥与复肥,2008,23(1):45 - 48.
[10] 亢永斌,宋培中. 甲酸钠钙化法合成草酸生产工艺的研究[J]. 山西化工,2002,22(2):16 - 17,34.
[11] 许景寒,瞿东蕙,杨文平. 草酸生产技术现状及市场前景分析[J]. 广东化工,2012,39(10):91 - 92.
[12] 段启伟,闵恩泽,何鸣元. 绿色技术在石油化工中的应用研究进展[J]. 石油化工,2000,29(7):530 - 534.
[13] 张启云,黄维捷,文峰,等. 草酸二甲酯加氢合成乙二醇反应的研究[J]. 石油化工,2007,36(4):340 - 344.
[14] 阮复昌,范娟,黄国水. 各种草酸生产工艺的对比及我国草酸工业的现状[J]. 广东化工,1997(5):14 - 17.
[15] 李辉,王煊军. 化学氧化法制备草酸工艺述评[J]. 广东化工,2010,38(9):30 - 32.
[16] 周锦成. 葡萄糖制草酸的工程放大数学模型及模拟[J]. 广西化工,1994,23(3):29 - 32,42.
[17] 李凤飞. 葡萄糖氧化制草酸[J]. 精细化工中间体,2008,38(8):54 - 56.
[18] 张平,蔡水洪. 草酸的溶剂萃取研究[J]. 化学世界,1994(3):138 - 142.
[19] 张青枝,张深松,鲁富贵,等. 硝酸氧化淀粉水解液制备草酸过程中NOx的回收利用[J]. 精细化工,1994,11(2):42 - 45.
[20] Malmary G,Albet J,Putranto A,et al. Recovery of Aconitic and Lactic Acids from Simulated Aqueous Effluents of the Sugar-Cane Industry Through Liquid-Liquid Extraction[J]. Chem Technol Biotechnol,2000,75(3):1169 - 1173.
[21] Wang Jianlong,Wen Xianghua,Zhou Ding. Production of Citric Acid from Molasses Integrated with in-Situ Product Separation by Ion-Exchange Resin Adsorption[J]. Bioresour Technol,2000,75(3):231 - 234.
[22] Di L M,Smithb B D,Kidab T,et al. Separation of Fructose from a Mixture of Sugars Using Supported Liquid Membranes[J]. J Membr Sci,2000,174(2):217 - 224.
[23] Fischer K,Bipp H P. Generation of Organic Acids and Monosaccharides by Hydrolytic and Oxidative Transformation of Food Processing Residues[J]. Bioresour Technol,2005,96(7):831 - 842.
[24] Guru M,Bilgesu A Y,Pamuk V. Production of Oxalic Acid from Sugar Beet Molasses by Formed Nitrogen Oxides[J]. Bioresour Technol,2001,77(1):81 - 86.
[25] Smitha T N,Hasha K,Daveyb C L,et al. Modifcations in the Nitric Acid Oxidation of D-Glucose[J]. Carbohydr Res,2012(350):6 - 31.
(编辑 邓晓音)
Green Production Process for High Purity Oxalic Acid
Qiao Liyan1, Huang Jie1, Du Xiaoli1, Yan Dong1, Xiao Jianxiong1, Hou Xiaowei2
(1. Shaanxi Key Laboratory of Physico-Inorganic Chemistry,Northwestern University,Xi’an Shaanxi 710069,China;2. Xi’an Maxsun Kores New Materials Co. Ltd,Xi’an Shaanxi 710077,China)
Crude oxalic acid was prepared from polysaccharide through sulfuric acid hydrolysis and then nitric acid oxidation. Purifed oxalic acid was prepared by the recrystallization of the crude oxalic acid,in which the mother liquor was recycled by extraction with tributyl phosphate. The purity of the product oxalic acid was analyzed by means of DSC and HPLC. The investigation indicated that,the maximum baci-extraction amount of water to tributyl phosphate containing oxalic acid was 83.70 g/ L,and the maximum extraction amount of tributyl phosphate to the mother liquor was 134.07 g/L. The glucose mass in the hydrolysate was 183.70 g(based on the 200 mL polysaccharide) under the optimum conditions for the hydrolysis of polysaccharide of V(polysaccharide)∶V(H2SO4) 1∶1,70-80 ℃ and hydrolysis time 4 h. The prepared oxalic acid mass was 62.43 g(based on the 200 mL polysaccharide) under the optimum conditions for the hydrolysate oxidation of V(polysaccharide)∶V(HNO3) 1∶2.89,70 ℃ and reaction time 6 h.
rare earth metal;oxalic acid;polysaccharide;oxidation by nitric acid;extraction separation
1000 - 8144(2014)10 - 1185 - 05
TQ 420.6
A
2014 - 05 - 02;[修改稿日期] 2014 - 06 - 29。
乔丽燕(1988—),女,甘肃省庆阳市人,硕士生,电邮 352969642@qq.com。联系人:黄洁,电话 029 - 88307755,电邮 huangjie@nwu.edu.cn。
陕西省科学技术研究发展计划项目( 2013K02-25);第47批留学回国人员科研启动基金教外司留(20131792);陕西省教育厅科研计划项目(14JF025)。
