太原地区罗非鱼红细胞免疫功能研究
2014-06-07王建明
李 雁 王建明
(太原动物园,山西太原 030009)
太原地区罗非鱼红细胞免疫功能研究
李 雁 王建明
(太原动物园,山西太原 030009)
目的:为探讨非灵长类动物体内是否存在红细胞免疫功能及是否存在免疫黏附受体分子。方法:实验以经济鱼类为研究对象并设计试验,运用荧光显微镜及免疫电镜技术,从细胞学水平上观察了罗非鱼红细胞对血清致敏的绿色荧光大肠杆菌(GFP-E.coli)的免疫黏附现象;运用扫描免疫电镜对罗非鱼免疫粘附现象进行观察,并通过细胞花环试验对太原地区代表性养殖鱼塘中的罗非鱼进行了红细胞免疫功能的测定;选用本实验自制提取的黄芪杂多糖拌料投喂罗非鱼,观测黄芪杂多糖的免疫增强作用。结论:罗非鱼红细胞具有免疫粘附功能且以高剂量700mg/kg饲料的剂量拌料投喂,可增强罗非鱼红细胞免疫功能。
鱼红细胞;免疫粘附;黄芪杂多糖
目前,人类医学领域中已成形成完整的红细胞免疫系统概念,大量的研究证实其在体内广泛地参与特异性与非特异性免疫、机体免疫调控,而红细胞CR1是红细胞免疫功能最重要的物质基础。然而,纵观动物红细胞免疫研究进展,对于非灵长类动物体内是否存在红细胞免疫黏附现象以及免疫黏附现象是否由CR1与活化的补体成分之间的反应来介导等方面的问题仍然存在争议。因此,本实验设计以主要经济鱼类罗非鱼为研究对象,运用显微技术及免疫学相关方法来探讨鱼类红细胞免疫黏附功能及其分子基础,以期能为动物红细胞免疫研究提供参考。
1 试验材料
1.1 试验动物
尼罗罗非鱼(太原市金胜村),红尾罗非鱼(太原市吴家堡村),荧光大厂杆菌(GFP-E.coli)为实验室冻存,酿酒酵母(Saccharomyces cereviseae)为本实验室保存菌。
1.2 主要试剂、仪器
黄芪杂多糖:本实验室粗提粉。
雷公藤多甙片(10mg/片):上海复旦复华药业有限公司,批号:100308。
EDTA抗凝管(湖南三力医药器械厂),淋巴细胞分离液(中国医学科学院生物工程研究所研制),戊二醛(成都科龙化工试剂厂,分析纯),PBS(0.1mol/L,pH=7.4),PBSB(10mM的葡萄糖和0.1%的BSA),0.9%NaCl,新鲜兔血清,LB液体培养基,LB固体培养基,氨苄青霉素(100μg/mL),LB液体培养基(含100μg/mL氨苄青霉素),LB固体培养基(含100μg/mL氨苄青霉素);梯度酒精(30%、50%、70%、80%、90%、95%、100%),锇酸(北京恒业中远化工厂),环氧树脂Epon812(北京恒业中远化工厂);酸度计(HANNA,pH211),荧光显微镜(BX51TF,Japan),扫描电镜(JSM-6400,Japan),溅射喷金仪(JFC-1600,Japan)
2 试验步骤
2.1 罗非鱼血清制备
选取健康、个体均匀罗非鱼个体,尾静脉采血,EDTA抗凝,按照血液:淋巴细胞分离液=1:2的比例将血液缓慢加入分离液表面,分离血清,血清标明品种保存备用;
2.2 罗非鱼红细胞悬液制备
取上述红细胞沉淀,用生理盐水洗涤、离心2次(2 000 r/ min,5 min),配制成浓度为1.5×107/mL的红细胞悬液。
2.3 荧光大肠杆菌制备
(1)GFP-E.coli复苏与纯化
取试管加入5mL的LB液体培养基,将冻存GFP-E.coli接种于培养基中,37℃,220rpm振荡培养13h,再转入含100μg/ml氨苄青霉素钠的LB液体培养基中培养过夜。挑取培养的菌悬液在含100μg/ml氨苄青霉素钠的LB固体培养基上接种,37℃培养箱中过夜,取单菌落接种于含100μg/ml氨苄青霉素钠的LB液体培养基振荡培养过夜。利用倍比稀释方法制备梯度菌液,分别涂板,选长出菌落范围在20~200板计算菌浓度。
公式一:
每管细菌浓度(个/ml)=(三个重复板菌落数的和/3)×稀释倍数×10
公式二:
细菌总浓度(个/ml)=各管细菌浓度的平均值
(2) GFP-E.coli的致敏:
取浓度为1.68×109/mL的GFP-E.coil悬液100μl,与0.9mL的新鲜罗非鱼血清混匀,于37℃下孵育1h,孵育完毕,2000rmp离心5min。弃去上清,菌重悬于PBSB中,涂片镜检,无异常备用。
2.4 罗非鱼红细胞免疫粘附光镜观察
取尼罗罗非鱼红细胞悬液离心洗涤两次,重悬后镜检无异常备用。分别取3支EP管,编号为A、B、C。三管中各加入500μl红细胞悬液。A管中加入致敏GFP-E.coli悬液,B管中加入未致敏处理的GFP-E.coil菌液,C管中加入PBS,37℃,70r/min振荡孵育1h,孵育完毕后1500r/min,5min,离心洗涤两次,洗涤时候,特别注意动作要轻柔。PBSB重悬,涂片,荧光显微镜检。
红尾罗非鱼红细胞处理同上。
2.5 罗非鱼红细胞免疫粘附电镜观察
(1)分别取尼罗罗非鱼、红尾罗非鱼致敏GFP-E.coli孵育组细胞悬液;
(2)1500rpm,离心5min,弃去上清;
(3)用2~3%的戊二醛固定1.5h;
(4)用磷酸缓冲液清洗3次,每次5min;
(5)用50%、70%、80%、90%乙醇梯度脱水,各梯度10min,再用100%乙醇脱水3次,每次30min;
(6)用叔丁醇置换3次,每次30min;
(7)用冷冻干燥仪干燥样品;
(8)用双面胶带将样品粘到样品台上;
(9)用离子溅射仪给样品镀10nm金膜,上镜观察。
2.6 罗非鱼红细胞免疫粘附花环试验
(1)酵母的制备
将酵母多糖试剂用生理盐水洗涤,配成1×108/ml 细胞悬液,分为两份,一份加等量罗非鱼血清混匀,37℃,30min,洗涤并恢复原浓度,另一份不做处理,备用。
(2)红细胞受体(RBC-C3bR)花环试验
取致敏酵母多糖悬液分别与尼罗罗非鱼、红尾罗非鱼红细胞悬液各50μL混合。37℃,水浴30 min,然后加入pH 值为7. 2的Hank’s液100μl,混匀;再加入4%的多聚甲醛25μl,固定5 min;平行涂片2张,自然干燥,甲醇固定2 min,再用Wright-Giemsa复合染色30 min;高倍镜检,以1个红细胞粘附2个或2个以上酵母者为1个花环,计数200个红细胞,求出花环率。
(3)红细胞免疫复合物(RBC一ICR)花环试验
取非致敏酵母悬液分别于尼罗罗非鱼、红尾罗非鱼红细胞悬液50μl混合,37℃,水浴30 min,然后加入pH 值为7. 2 的Hank’s液100μl,混匀;再加入4%的多聚甲醛25μl,固定5 min;平行涂片2张,自然干燥,甲醇固定2 min,再用Wright-Giemsa复合染色30 min;高倍镜检,以1个红细胞粘附2个或2个以上酵母者为1个花环,计数200个红细胞,求出花环率。
2.7 中药饲料添加剂对罗非鱼红细胞免疫粘附的影响
选用本实验室提取精制的黄芪多糖为中药添加剂,两品种罗非鱼均按照单因素完全随机设计,随机分为4组,每组8尾,另取8尾作为空白对照组,第Ⅰ组为空白对照组,第II、III组为实验组(AHPS高、低剂量处理组),拌料投喂(见表1)。
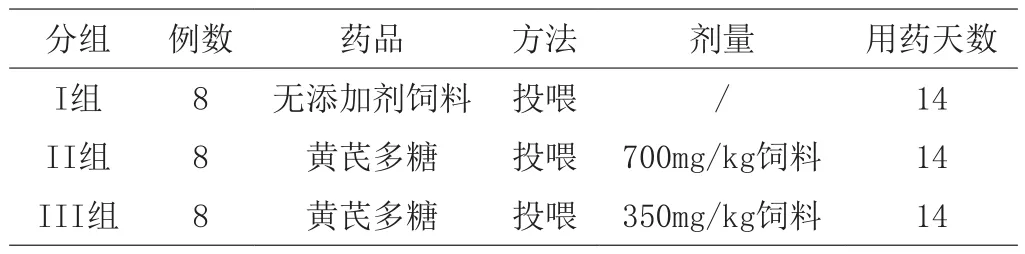
表1 试验分组及处理
于最后一天拌料投喂结束,全群罗非鱼采血,分组标记,按照2.6试验操作,计算各组红细胞花环率。
3 试验结果
3.1 GFP-E.coli镜检结果
GFP-E.coli经过复苏纯化,在菌体内表达绿色荧光蛋白。在荧光场下,绿色荧光清晰可见。GFP-E.coli电镜下观察,结果显示GFP-E.coli呈短棒状,两端钝圆,长度约为2~3μm。表明,冻存GFP-E.coli复苏成功,生长良好,且能够被激发出绿色荧光,可以作为粘附报告因子以用于后续试验。
3.2 罗非鱼红细胞免疫粘附光镜观察
GFP-E.coli经新罗非鱼血清致敏,于37℃下与红细胞孵育后,涂片镜检。镜检结果发现,在红细胞表面可清晰观察到绿色荧光,说明被新血清致敏后的GFP-E.coli,可以被红细胞黏附,所以能够在红细胞表面观察到GFP-E.coli体内表达的绿色荧光,充分说明罗非鱼红细胞可以免疫黏附经血清补体作用过的GFP-E. coli;
未经新鲜罗非鱼清致敏的GFP-E.coli与红细胞孵育之后,涂片镜检。结果发现在罗非鱼红细胞表面未能观察到绿色荧光,只可见红细胞洗涤之后残留下的少数GFP-E.coli,因此在视野中也可以观察到绿色荧光,这就表明红细胞与未经新鲜血清致敏的GFP-E.coli并未发生免疫黏附现象。
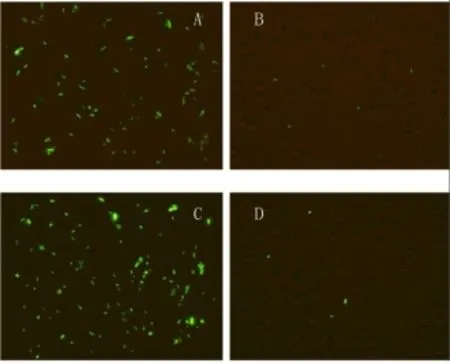
图1 如A中箭头所指,可以看出尼罗罗非鱼红细胞与GFP-E.coli两者发生免疫黏附(1000×);B中箭头所指为尼罗罗非鱼红细胞及残留的少数GFP-E.coli菌体,两者之间分散存在,没有发生免疫黏附现象(1000×);C中可以看出红尾罗非鱼红细胞与GFP-E.coli两者发生免疫黏附(1000×),D中可以看出红尾罗非鱼红细胞及残留少数GFP-E.coli菌体,两者之间分散存在,没有发生免疫黏附现象(1000×)。
3.3 罗非鱼红细胞免疫粘附扫描电镜观察
经新鲜罗非鱼血清致敏后的GFP-E.coli与红细胞孵育,电镜下观察发现,扫描电镜下能够清楚地看到红细胞表面黏附有数量不等的GFP-E.coli。由此可见,两个品种的罗非鱼红细胞能够黏附经血清致敏的GFP-E.coli。

图4 作图为扫描电镜下尼罗罗非鱼红细胞黏附着数量不等的致敏GFP-E.coli(8000×),右图为红尾罗非鱼红细胞粘附现象
3.4 罗非鱼红细胞花环试验
花环试验结果表明,致敏酵母菌可与罗非鱼红细胞形成花环,未致敏酵母菌可与红细胞形成花环,尼罗罗非鱼、红尾罗非鱼红细胞免疫粘附受体花环率依次为:31.80±1.86、30.09±1.67,IC花环率依次为24.40±1.41、23.36±2.64。

表2 罗非鱼花环率结果
3.5 中药饲料添加剂对罗非鱼红细胞免疫粘附的影响
结果显示,尼罗罗非鱼空白对照组、高剂量组、低剂量组RBC-C3bR依次为31.80±1.8、42.16±3.22、38.83±1.17,其RBC-ICR值依次为24.40±1.41、23.28±3.32、24.04±2.66;红尾罗非鱼空白对照组、高剂量组、低剂量组RBC-C3bR依次为30.09 ±1.67、40.39 ±2.51、36.23 ±1.08,其RBC-ICR值依次为23.36±2.64、22.64±2.81、23.04±1.06,(见表3,表4)。

表3 黄芪杂多糖对尼罗罗非鱼花环率影响结果

表4 黄芪杂多糖对红尾罗非鱼花环率影响结果
4 分析讨论
4.1 罗非鱼红细胞免疫黏附试验结果分析
人红细胞表面的补体受体分子可以结合补体致敏的免疫复合物、病毒、细菌等外源分子,称之免疫黏附(immune adhere,IA)。免疫黏附是红细胞的最重要的免疫功能,因此免疫黏附受体是红细胞免疫深入研究的基石。Duke(1930)首次观察到灵长类动物的红细胞能够结合血清致敏的锥虫[32]。此后,R. A. Nelson研究表明红细胞免疫黏附功能受血清中的补体成分complement 3(C3),complement 4(C4)的介导[33],其中补体C3的作用更为明显[88]。细菌、病毒等分子进入血液后激活补体系统,导致C3与酶分子内硫酯结合,发生亲核反应,引起C3裂解为具有高活性的C3b片段[5]。通过C3b包被在外源分子表面完成对外源分子的致敏并形成免疫复合物(Immune complex,IC),进而人红细胞通过其表面补体受体与C3b特异性结合将致敏分子黏附于红细胞表面,可见介导红细胞免疫黏附的并不是C3本身,而是其酶解产物C3b[34]。国内上世纪九十年代,陈思义,王旭东等人沿用人医理论,探讨了牛、鸡、犬等不同动物的红细胞花环率[21][25][26][28]。但是纵观而言,动物红细胞免疫黏附受体的研究仍然存在方法单一的问题,进而限制了动物红细胞免疫的研究步伐。
本实验中,用新鲜血清致敏GFP E.coli,GFP E.coli激活血清中补体成分,产生的补体活性片段包被于GFP E.coli表面,进而与红细胞表面特异性补体受体结合,发生黏附。由于红细胞表面黏附有GFP E.coli,因此在荧光显微镜下可见致敏GFP-Ecoil孵育组红细胞表面带有绿色荧光,结果证实猪红细胞膜表面存在可以特异结合补体活性片段的活性分子即膜补体受体分子。未经血清致敏的GFP E.coli由于失去补体活性片段的介导而不能与红细胞表面的补体受体分子结合,进而不能被红细胞免疫黏附。所以,GFPEcoil未致敏孵育组红细胞表面未能观察到绿色荧光。由此可见,猪红细胞膜表面存在特异性免疫黏附受体——膜补体受体分子,而且红细胞与致敏病原粒子之间的免疫黏附属于抗原抗体反应,即红细胞膜补体受体分子具有特异性,这也正是前人研究中红细胞花环的物质基础。
本实验采用扫描免疫电镜进一步观察了红细胞与GFP E.coli的免疫黏附现象。扫面电镜结果可见罗非鱼红细胞表面黏附有数量不等的致敏GFP E.coli,表明红细胞表面存在有特异性免疫黏附受体—膜补体受体,其可以与致敏GFP E.coli表面的补体活性成分特异性地结合,进而致敏GFP E.coli被红细胞黏附于表面,说明红细胞与致敏GFP E.coli之间是特异性地结合,而非外力因素干扰所致。
本实验采用基因工程菌的绿色荧光作为报告因子,不需要特殊染色或标记,可以在荧光场下直接观察红细胞对致敏GFP E.coli的免疫黏附作用,而且实验中利用电子显微镜从微观上观察红细胞黏附致敏GFP E.coli的现象,进而提高了红细胞免疫黏附结果的精确性和科学性。
4.2 罗非鱼红细胞免疫粘附功能测定
本试验结果表明,这两品种罗非鱼红细胞上均存在免疫粘附受体,从而罗非鱼红细胞具有重要的免疫功能;进一步提示,由于种属相近,其红细胞上粘附受体的数量无显著差异。正常罗非鱼红细胞粘附受体花环率高于红细胞免疫复合物花环率,这是因为在正常情况下.体内形成的抗原一抗体一补体复合物及C3自然分解产生的C3b 均较少,因而占位的粘附受体较少.故红细胞粘附受体花环率明显高于红细胞免疫复合物花环率。这与郭峰等人报道的人及动物红细胞花环率结果相似。
4.3 中药饲料添加剂对罗非鱼红细胞免疫粘附的影响
从结果中看出,尼罗罗非鱼黄芪多糖高剂量、低剂量投喂组其红细胞花环率相比空白组有显著提高(P<0.05);红尾罗非鱼黄芪多糖高剂量、低剂量投喂组其红细胞花环率相比空白组亦有显著提高(P<0.05),两品种罗非鱼均以以700mg/kg剂量拌料投喂免疫增强效果较好。但是,可能由于品种差异较小或样本数量问题,两品种间数据未见有显著差异。
人及动物红细胞C3 b 受体花环率的高低与机体健康状况有一定关系,患恶性肿瘤、白血病、贫血、鸡传染性法氏囊病、鸡马立克氏病等疾病时,红细胞受体花环率下降[35][36][37]。本实验初步证实黄芪杂多糖可以增强罗非鱼非特异性免疫反应,但是鱼的各种疾病是否也对红细胞粘附受体花环率有一定影响尚需进一步探讨。
5 结论
(1)太原市金胜村、吴家堡村的罗非鱼红细胞具有免疫功能,可以粘附致敏复合物,尼罗罗非鱼、红尾罗非鱼的红细胞花环率依次为31.80±1.86、30.09±1.67,可作为临床基础数据参考;
(2)黄芪杂多糖作为饲料添加剂对尼罗河罗非鱼、红尾罗非鱼均具有免疫增强作用。
(3)本实验初步证实黄芪杂多糖可以增强罗非鱼红细胞免疫功能,但是鱼的其他疾病是否也对红细胞粘附受体花环率有一定影响尚需进一步探讨。
[1] Birmingham DJ,Hebert LA.CR1 and CR1-like:the primate immune adherence receptors[J].Immunol Rev,2001,180:100-11.Review.
[2] 红细胞免疫的物质基础及影响因素,浙江畜牧兽医赵孟春,李宏全,段瑞旭,白瑞,2007年第3期
[3] Rowe JA,Raza A,Diallo DA,et al.Erythrocyte CR1 expression level does not correlate with a HindIII restriction fragment length polymorphism in Africans:implications for studies on malaria susceptibility [J].Genes and Immunity,2002,3:497-500.
[4] Cockburn IA,Rowe JA.Erythrocyte complement receptor 1(CR1)expression level is not associated with polymorphisms in the promoter or 3′untranslated regions of the gene[J].International Journal of Immunogenetics,2005,33:17-20.
[5] 郭峰,钱宝华,张乐之.现代红细胞免疫[M].上海:第二军医大学出版社,2002.pp1.
[6] 李宏全,黄芪多糖的提纯工艺及对红细胞免疫功能的调节[D],山西:山西农业大学,2008年6月
[7] Nardin A,Lindorfer MA,Taylor RP.How are immune complexes bound to the primate erythrocyte complement receptor transferred to acceptor phagocytic cells.Mol Immunol,2009,36(13-14):827-35.
[8] Horakova E,Gasser O,Sadallah S,et al.Complement Mediates the Binding of HIV to Erythrocytes[J]. The Journal of Immunology,2004,173:4236-4241.
[9] Hament JM,van Dijk H,Fleer A,et al.Pneumococcal immune adherence to human erythrocytes[J].Eur J Clin Invest,2003,33(2):169-75.
[10] 马骞寰,黄芪多糖对红细胞调控T淋巴细胞活性的影响[D],山西:山西农业大学,2008年6月
[11] 郭峰,张乐之,薛春燕,等.肝炎患者红细胞免疫分子CR1定量与循环免疫复合物的变化[J].深圳中西医结合杂志,2004,11(6):342-343.
[12] 马海利,韩惠瑛,王胜,郑明学,李宏全,宁官保,中国预防兽医学报,附红细胞体自然感染对猪红细胞的影响,2003年,第25卷第4期
