四种伏牛山原生药用植物的抗癌活性
2014-06-07高嘉屿邓瑞雪张延萍尹卫平
高嘉屿,杨 櫹,邓瑞雪,张延萍,尹卫平
(河南科技大学a.化工与制药学院;b.新区医院,河南 洛阳 471023)
四种伏牛山原生药用植物的抗癌活性
高嘉屿a,杨 櫹b,邓瑞雪a,张延萍a,尹卫平a
(河南科技大学a.化工与制药学院;b.新区医院,河南 洛阳 471023)
基于伏牛山原生药用植物白花蛇舌草、淫羊藿、鱼腥草和冬凌草在肿瘤治疗中的临床应用,研究了该四种药物对食管癌和肝癌细胞中的抑制活性。通过萃取获得药物不同浓度的乙醇提取物后,使用噻唑蓝(MTT)法测定了EC109食管癌和HepG2肝癌细胞接受不同浓度不同时间药物刺激后的生长状况。其中,淫羊藿和鱼腥草的最低IC50仅为0.18 mg/mL和0.16 mg/mL,而白花蛇舌草和冬凌草的最低IC50分别达到0.52 mg/mL和0.66 mg/mL。此研究结果首次证明:白花蛇舌草、淫羊藿、鱼腥草和冬凌草对于食管癌EC109和肝癌HepG2细胞有浓度依赖和时间相关的体外生长抑制作用,为其临床应用和进一步研究奠定基础。
抗癌;伏牛山药用植物;食管癌;肝癌;细胞毒性;凋亡
0 引言
恶性肿瘤是中国当前重大的公共卫生问题,据中国肿瘤登记年报2012公布的数据,中国每年癌症死亡约250万人。其中,河南地区高发的肝癌和食管癌的发病率位居癌症死亡率的第三位和第四位,且目前尚无有效治疗手段[1]。位于河南省中西部的伏牛山以其独特的地理位置孕育了大量的药用植物,在中医抗肝癌和食管癌方剂中有着重要的作用,构成了当地民间抗癌防癌的基础。
本文报道的四味药材白花蛇舌草、淫羊藿、鱼腥草和冬凌草在伏牛山区广泛分布。根据传统中医理论的认识,它们有清热解毒和扶正培本的作用,可实现肿瘤类疾患的标本兼治[2]。临床应用表明:包含有此四种药用植物的中药方剂对中晚期肝癌或食管癌患者的临床症状有明显改善,可不同程度地提高患者生存率。尽管此四种药物的抗癌作用已经在多种体内外肿瘤模型中被证实,但是对于它们在食管癌和肝癌代表细胞株EC109和HepG2上的活性研究目前尚无文献报道。鉴于此,本研究使用不同浓度的乙醇对白花蛇舌草、淫羊藿、鱼腥草和冬凌草进行萃取,并以EC109和HepG2细胞为药靶,对获得的醇提物进行细胞毒性测试,其结果将为此四种抗癌植物的临床应用和进一步研究奠定基础。
1 材料和方法
1.1 试验材料
白花蛇舌草、淫羊藿、鱼腥草和冬凌草2013年3月购于洛阳好一生大药房,经河南农业大学中药材工程技术研究中心高致明教授鉴定对应药用植物为真品,样品保存于伏牛山药用植物资源标本馆(20137951-20137954)。EC-109和HepG2细胞株由河南科技大学医学院提供,使用DMEM高糖型培养基(北京索莱宝科技有限公司)含体积分数为10%的特级胎牛血清(北京索莱宝科技有限公司),培养环境为37℃和5%CO2。
1.2 试验方法
药物用粉碎机粉碎至300目细粉,加入体积分数分别为10%、30%、70%的乙醇溶液,置于超声波清洗机中充分振荡提取20 min,重复5次,过滤,收集滤液。重复萃取1次,将2次滤液合并,使用旋转蒸发仪除去溶剂,获得相应药物不同乙醇浓度的提取物,待用。
在96孔细胞培养板中每孔加入200 μL浓度为1.5×104个细胞每亳升的悬浊液。培养24 h后,加入10 μL相应浓度的提取物(5 mg/mL、2.5 mg/mL、1.25 mg/mL、0.625 mg/mL、0.312 5 mg/mL和0.156 25 mg/mL),无药培养基为对照。每个浓度重复测试3次。培养24 h、48 h和72 h后,每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h。移除全部液体后加入100 μL异丙醇,在酶标仪上读取光密度(OD,590 nm)。细胞的生长抑制率计算如下:((对照OD-样品OD)/对照OD)×100%。
结果数据显示为平均值±标准差(SD)。样本间数据对比使用单因素方差分析(ANOVA)。对照组和样本组的统计学差异由Student’s t-test计算获取。当P<0.05时,结果视为有统计学差异。
2 结果与讨论
2.1 白花蛇舌草醇提物在体外对食管癌和肝癌细胞的生长抑制作用
图1和图2分别为白花蛇舌草醇提物在体外对食管癌细胞EC109和肝癌细胞HepG2的生长抑制作用。由图1和图2可知:白花蛇舌草3种浓度的乙醇提取物在体外对EC109食管癌和HepG2肝癌细胞均有浓度依赖性的生长抑制作用。在EC109细胞中,70%(体积分数)的乙醇提取物在72 h抑制作用最强,其IC50可达到0.52 mg/mL。而HepG2则在48 h对该药70%(体积分数)的乙醇提取物最为敏感,IC50为0.68 mg/mL。除此之外,较高乙醇浓度白花蛇舌草提取物的抑癌作用总是强于低浓度提取物。结合文献报道,提示白花蛇舌草的有效抗癌部位可能为黄酮、多糖、萜以及蒽醌类成分[3]。
白花蛇舌草的体外细胞毒性已被报道于多种癌细胞株中,但对于食管癌EC109细胞和肝癌HepG2细胞的作用此处为首次报道。其50%细胞生长抑制浓度大于0.5 mg/mL,与其他类型癌细胞株的细胞毒性报道较为一致[4-5]。白花蛇舌草杀伤癌细胞的主要药理机制为通过调节相关基因及蛋白的表达,如Bcl-2、Bax、Fas/FasL、Caspase和MMP等,从而实现抑制细胞周期生长、肿瘤血管生成,最终导致癌细胞凋亡[4-6]。而此结论也与本试验显微镜观察较为一致:相对于对照组EC-109或是HepG2细胞饱满,大小均匀的形态,接受白花蛇舌草刺激后的癌细胞皱缩明显,体积变小,大小不一,随着药物浓度升高,细胞数量逐渐减少、碎片增多,大量细胞凝聚成团块状,呈典型的凋亡状态。综上所述,白花蛇舌草的醇提物在体外对食管癌EC109和肝癌HepG2的细胞毒性明显,且呈浓度依赖性并与作用时间相关,其杀伤机制可能为凋亡相关的蛋白调节。

图1 白花蛇舌草醇提物在体外对食管癌细胞EC109的生长抑制作用

图2 白花蛇舌草醇提物在体外对肝癌细胞HepG2的生长抑制作用
2.2 淫羊藿醇提物在体外对食管癌和肝癌细胞的生长抑制作用
图3和图4分别为淫羊藿醇提物在体外对食管癌细胞EC109和肝癌细胞HepG2的生长抑制作用。由图3和图4可知:10%、30%和70%(体积分数)乙醇淫羊藿提取物均可以抑制EC109和HepG2的生长,并且其作用伴随着浓度的增加而增强。其中,食管癌细胞在药物刺激48 h时最敏感,其体积分数70%乙醇提取物的IC50仅为0.18 mg/mL;而肝癌细胞在药物刺激72 h时最敏感,体积分数70%乙醇提取物的IC50为0.33 mg/mL。同白花蛇舌草相似,较高浓度的乙醇所提取的淫羊藿部位抗癌作用相对较强,结合文献分析,黄酮类化合物可能为其主要活性成分[7]。
尽管淫羊藿作为主要组分被记载于众多抗癌方剂当中,但其醇提取部位体外的抗食管癌EC109和肝癌HepG2活性于此为首次报道。除此之外,也有报道淫羊藿黄酮成分对人血癌HL-60、肝癌H7402和鼠血癌WEHI-3等数种肿瘤细胞有生长抑制作用[8]。其活性可通过影响癌细胞生长周期(G0/G1期抑制),进而启动凋亡程序而实现,其中相关调节蛋白/mRNA包括bcl-2、c-myc和p21[9]。据此,淫羊藿对于EC109和HepG2细胞的抗癌机制可推测为凋亡相关的蛋白网络调节。
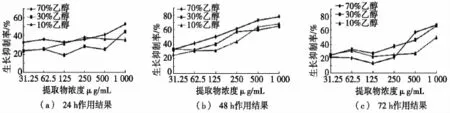
图3 淫羊藿醇提物在体外对食管癌细胞EC109的生长抑制作用
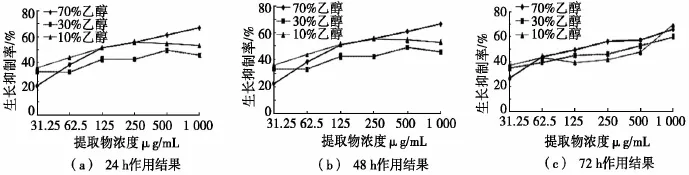
图4 淫羊藿醇提物在体外对肝癌细胞HepG2的生长抑制作用
2.3 鱼腥草醇提物在体外对食管癌细胞的生长抑制作用
体积分数10%、30%以及70%的乙醇鱼腥草提取物在体外对于食管癌EC109细胞的生长有浓度依赖性的抑制作用(见图5)。其中,体积分数70%乙醇的提取物在24 h即可达到对EC109的最大杀伤效果,其IC50仅需0.16 mg/mL;而低浓度的乙醇提取物需较长时间,在72 h才获得最低IC50为0.58 mg/mL。此结果结合文献报道推测,鱼腥草醇提物中的有效抗癌成分应为黄酮类化合物及生物碱[10]。

图5 鱼腥草醇提物在体外对食管癌细胞EC109的生长抑制作用
鱼腥草的体外抗癌活性已被报道于多种癌细胞株中,其IC50值为0.1~0.4 mg/mL[11-12],同此次发现的在食管癌EC109细胞上的活性较为一致。鱼腥草刺激能够抑制cyclin D1,cyclin A,Bax/Bcl-2,CDK 4和CDK 2的表达,并同时上调p27,caspase-8,caspase-9和caspase-3水平,从而诱导A549肺癌和HT29结肠癌细胞凋亡[11]。而对于血癌细胞Molt-4,鱼腥草则通过下调Bcl-xl蛋白表达,提升Smac/Diablo,Bax和GRP78水平,从而实现经由内质网应激途径的细胞凋亡[12]。据此可以推断:鱼腥草醇提物所诱导的食管癌细胞生长抑制也应经过对凋亡相关蛋白的调节而达成的。
2.4 冬凌草醇提物在体外对食管癌细胞的生长抑制作用
冬凌草乙醇提取物均对食管癌细胞EC109有浓度依赖性的生长抑制作用,并且其效力在48 h达到最大(见图6)。其中,体积分数70%乙醇提取物的IC50达0.66 mg/mL。在全部3个时间节点,冬凌草醇提物的活性均随着乙醇浓度的增加而增强。结合文献报道,其抗癌活性成分应来源于多糖、黄酮类和萜类化合物[13]。
据文献报道,冬凌草及其有效活性成分对白血病细胞、宫颈癌、膀胱癌、乳腺癌和肝癌等数种癌细胞呈现有细胞毒性作用[14-16]。冬凌草的主要抗癌机制包括调节Bax、survivin、cdc2、cdc25c、p16、p21、p27、c-myc[17]和caspase 3/8[18]等一系列凋亡相关蛋白,从而将癌细胞的生长静止于G0/G1期或G2/M期,同时启动程序化死亡信号[17-18]。此次发现的冬凌草在EC109食管癌细胞上的活性相较于已报道的体外抗癌活性较为一致,但此药物抗食管癌的药理机制尚不明确,结合已知文献,提示凋亡相关蛋白应为其进一步研究的药物靶点。
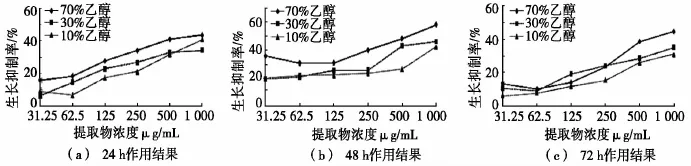
图6 冬凌草醇提物在体外对食管癌细胞EC109的生长抑制作用
3 结论
(1)四种伏牛山原生药用植物白花蛇舌草、淫羊藿、鱼腥草和冬凌草的醇提物在体外对于食管癌细胞EC109或肝癌细胞HepG2具有浓度依赖的生长抑制作用,其中70%的乙醇提取物活性最强。
(2)白花蛇舌草、淫羊藿、鱼腥草和冬凌草醇提物的抗癌活性与时间相关,其中除鱼腥草在24 h即达到最大作用外,其他3种药物均需48~72 h才可在目标癌细胞株中获取最低IC50(最强效果)。
(3)四种药物在体外对于食管癌或是肝癌的杀伤效果同此前文献报道的抗癌活性较为一致,并提示其抗癌作用是通过对凋亡相关蛋白网络的调节而实现。其中,淫羊藿和鱼腥草70%乙醇提取物对食管癌细胞的IC50仅需0.15 mg/mL左右,有进一步深入研究其作用单体活性成分和分子药理机制的潜力。
[1] 赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012.
[2] State Pharmacopoeia Committee of the People’s Republic of China.Pharmacopoeia of the People’s Republic of China[M].2000 ed.Beijing:Chemical Industry Press,2000.
[3] Wang X,Cheng W M,Yao X N,et al.Qualitative Analysis of the Chemical Constituents in Hedyotis Diffusa by HPLC-TOFMS[J].Natural Product Research,2012,26(2):167-172.
[4] Chen X J,Cao Z Y,Chen T S,et al.Water Extract of Hedyotis Diffusa Willd Suppresses Proliferation of Human HepG2 Cells and Potentiates the Anticancer Efficacy of Low-dose 5-fluorouracil by Inhibiting the CDK2-E2F1 Pathway[J].Oncology Reports,2012,28(2):742-748.
[5] Lin J M,Wei J H,Shen A L,et al.Hedyotis Diffusa Willd Extract Suppresses Sonic Hedgehog Signaling Leading to the Inhibition of Colorectal Cancer Angiogenesis[J].International Journal of Oncology,2013,42(2):651-656.
[6] Wang N,Li D Y,Niu H Y,et al.2-Hydroxy-3-methylanthraquinone from Hedyotis Diffusa Willd Induces Apoptosis in Human Leukemic U937 Cells Through Modulation of MAPK Pathways[J].Archives of Pharmacal Research,2013,36(6):752-728.
[7] 黄秀兰,周亚伟,王伟.淫羊藿黄酮类化合物药理研究进展[J].中成药,2005,27(6):719-721.
[8] 赵勇,崔正言,张玲,等.MTT法检测淫羊藿甙对几种瘤细胞株增殖的抑制作用[J].上海免疫学杂志,1995,15(3):167-168.
[9] 李贵新,张玲,王芸,等.淫羊藿甙诱导白血病细胞凋亡及其对癌基因表达的影响[J].中华血液学杂志,2002,23(6):322-323.
[10] 胡汝晓,肖冰梅,谭周进,等.鱼腥草的化学成分及其药理作用[J].中国药业,2008,17(8):23-25.
[11] Chen Y F,Yang J S,Chang W S,et al.Houttuynia cordata Thunb Extract Modulates G0/G1 Arrest and Fas/CD95-mediated Death Receptor Apoptotic Cell Death in Human Lung Cancer A549 Cells[J].Journal of Biomedical Science,2013,20:18-25.
[12] Prommaban A,Kodchakorn K,Kongtawelert P,et al.Houttuynia cordata Thunb Fraction Induces Human Leukemic Molt-4 Cell Apoptosis Through the Endoplasmic Reticulum Stress Pathway[J].Asian Pacific Journal of Cancer Prevention,2012,13:1977-1981.
[13] 左海军,李丹,吴斌,等.冬凌草的化学成分及其抗肿瘤活性[J].沈阳药科大学学报,2005,22(4):258-262.
[14] Li F R,Fan J F,Wu Z,et al.Reversal Effects of Rabdosia rubescens Extract on Multidrug Resistance of MCF-7/Adr Cells in vitro[J].Pharmaceutical Biology,2013,51(9):1196-1203.
[15] 梁菊,陈姗,刘秋伟.冬凌草抗菌霜剂的制备和局部抗感染实验[J].河南科技大学学报:自然科学版,2011,32(5):101-104.
[16] 杜鹏强,李晓天,石迎迎,等.大鼠灌胃冬凌草乙素的药代动力学研究[J].郑州大学学报:理学版,2013,45(1):77-80.
[17] Gao F H,Hu X H,Li W,et al.Oridonin Induces Apoptosis and Senescence in Colorectal Cancer Cells by Increasing Histone Hyperacetylation and Regulation of p16,p21,p27 and c-myc[J].BMC Cancer,2010,10:610-620.
[18] Kang N,Zhang J H,Qiu F,et al.Inhibition of EGFR Signaling Augments Oridonin-induced Apoptosis in Human Laryngeal Cancer Cells Via Enhancing Oxidative Stress Coincident with Activation of Both the Intrinsic and Extrinsic Apoptotic Pathways[J].Cancer Letters,2010,294:147-158.
R285.5
A
1672-6871(2014)04-0077-05
河南省国际科技合作计划基金项目(104300510064)
高嘉屿(1980-),男,辽宁沈阳人,副教授,博士,主要研究方向为抗癌天然产物药理.
2013-12-19
