异绿原酸对烟曲霉生物被膜的体外作用
2014-06-07陈一强孔晋亮邬丽红
罗 劲 陈一强 孔晋亮 邬丽红 黄 宏
广西医科大学第一附属医院呼吸疾病研究所,广西南宁 530021
烟曲霉是导致临床免疫力低下患者肺部真菌感染的常见病原体之一。近年来虽然新型抗曲霉菌药物的研发取得了一定的进展,但唑类耐药和多重耐药菌株的出现,使烟曲霉感染的患者病死率依旧很高。体外研究发现,生物被膜形成是烟曲霉产生耐药的重要机制之一,且生物被膜一旦成熟,其耐药性将提高几十、几百甚至上千倍[1],控制难治性烟曲霉感染成为当前临床治疗上面临的一大难题。因此若能够寻求一种能够有效破坏已经形成的烟曲霉生物被膜的药物或方法,或将有助于解决这一难题。金银花主要抗真菌活性成分为绿原酸和异绿原酸[2-3],本课题组前期研究发现,绿原酸能破坏铜绿假单胞菌及烟曲霉生物被膜[4-5],而目前异绿原酸对生物被膜相关生物学作用罕有报道,因此本实验旨在探究异绿原酸对不同时期烟曲霉生物被膜的体外作用,为控制生物被膜药物的研发在原料选择方面提供更多科学依据。
1 材料与方法
1.1 材料
收集广西医科大学第一附属医院(以下简称“我院”)2012年5月~2013年9月临床分离烟曲霉共31株,用结晶紫染色法测定成膜能力,选取成膜能力最强烟曲霉菌株(编号为A.f4)为实验菌株。质控菌株为近平滑念珠菌ATCC22019由我院临床微生物检验鉴定中心提供。
1.2 主要试剂
异绿原酸(中国食品药品检定研究院,批号111782-201204)以最大溶解度溶解于二甲基桠枫(DMSO,Solarbio公司),0.22 μm 滤器滤过后于-20℃保存;结晶紫粉末(天津红岩试剂厂)溶解于灭菌去离子水配制成质量分数为1%的结晶紫染液;RMPI-1640粉(Gibico 公司);3-(N-吗啉基)丙磺酸-4-吗啉丙磺酸(MOPS,美国 Sigma 公司);LIVE/DEAD BacLight Bacterial Viability死活菌染色试剂盒(Invitrogen公司);马铃薯葡萄糖琼脂培养基(PDA,中国路桥技术责任有限公司);分析纯无水乙醇(天津Kermel化学试剂有限公司);磷酸盐缓冲液(PBS)粉(美国 sigma公司)。
1.3 仪器
圆形玻璃细胞爬片(直径13 mm,天津博泰克科技公司)作为构建生物被膜的载体,高压灭菌备用;生物安全柜(苏州净化设备有限公司BHC-1300IIA/B2);智能生化培养箱(常州市伟嘉仪器制造有限公司 SPX250);酶标仪(美国 Thermo Multiskan MK3);扫描电镜(日立SU8020);激光共聚焦显微镜(CLSM,Nikon A1)。
1.4 方法
1.4.1 孢子悬液的制备 将受试的烟曲霉菌株A.f4接种至PDA斜面,37℃恒温复苏3 d后,转种于另一PDA培养基37℃活化3 d,用5 mL含0.025%Tween-20的PBS冲洗斜面收集孢子,20 mL MOPS缓冲后pH为7.0的RPMI-1640重悬孢子,血细胞计数板调整孢子浓度为1×105个/mL,作为建立烟曲霉体外静止生物被膜模型的孢子悬液。
1.4.2 异绿原酸的最低抑菌浓度(MIC)和最低杀菌浓度(MFC)测定 参照美国临床实验室标准协会(clinical and laboratory standards institute,CLSI)M38-A2 丝状真菌药敏指南[6]并做适当调整,测定异绿原酸对受试菌株A.f4及质控菌株的MIC和MFC。其中异绿原酸最终受试浓度为 2~1024 μg/mL(1024 μg/mL 为最大溶解度,且各浓度含DMSO终体积分数≤1%)。
1.4.3 体外烟曲霉静止生物被膜模型的建立 参考Mowat等[7]的方法,往无菌24孔板各孔加入1个灭菌生物被膜载体及1 mL制备好的孢子悬液,静置于生化培养箱,分别于37℃恒温孵育24 h和48 h,在载体上形成早期、成熟期烟曲霉生物被膜。培养期间每隔24小时更换1次RPMI-1640培养液。
1.4.4 CLSM检测经异绿原酸作用后不同时期生物被膜内死活菌 建模后,异绿原酸组加入1024 μg/mL的异绿原酸,空白对照组则加入RPMI-1640培养液;加药前各孔分别用灭菌PBS轻轻漂洗生物被膜表面3次除去未黏附菌。药物作用48 h(期间每隔24小时用相同的液体换液1次)后将载体取出,以灭菌PBS轻轻漂洗生物被膜表面3次。按照LIVE/DEAD BacLight Bacterial Viability试剂盒的使用说明,将碘化丙啶(PI)及Syto-9荧光染料按1∶1比例配制好后用灭菌去离子水稀释500倍,取200 μL加入各孔没过载体,室温避光染色15 min,无菌PBS轻轻漂去未黏附染料,自然干燥后置于CLSM下放大200倍观察。
1.4.5 SEM观察异绿原酸对不同时期生物被膜的形态干预 建模、分组同CLSM。药物作用48 h(期间每隔24小时分别用相同的液体换液)后将载体取出,灭菌PBS轻轻漂去载体表面的浮游菌,2.5%戊二醛固定24 h,依次用50%、70%、80%、90%乙醇梯度脱水并干燥后,真空喷镀金粉,于20 kV电压、放大2000倍条件下进行扫描电镜(SEM)形态学观察。
1.4.6 结晶紫染色法对不同浓度异绿原酸作用于不同时期生物被膜后的定量分析 按照上述方法建模后,用灭菌PBS轻轻漂洗生物被膜表面3次以去除未黏附菌。根据药敏试验结果将实验分为:空白对照组、不同浓度异绿原酸组(64、128、256、512、1024 μg/mL),异绿原酸组加入上述浓度的药物,空白对照组加入新鲜RPMI-1640培养液。药物作用48 h(期间每隔24 h各组分别用相同的液体换液),取出各组载体,参照Peeters等[8]及Shao等[9]的方法并做适当改进:灭菌PBS缓冲液轻轻漂去生物被膜表面的浮游菌,室温干燥后将载体置于新的24孔板中,加入1%结晶紫1 mL染色15 min。再次轻轻漂洗生物被膜表面未黏附的结晶紫,室温干燥后加入1 mL无水乙醇脱色10 min。吸取100 μL洗脱液加入96孔板,酶标仪570 nm波长测定各孔吸光度值(A570),以无水乙醇作为空白对照。各组每次分别设置3个副孔取其平均值,实验独立重复3次。
1.5 统计学方法
使用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析及SNK检验,以P<0.05为差异有统计学意义。
2 结果
2.1 异绿原酸的MIC和MFC测定结果
根据CLSI M38-A2丝状真菌药敏指南判读标准,异绿原酸对受试烟曲霉A.f4菌株及质控菌株的MIC和MFC均大于1024 μg/mL。
2.2 各组CLSM检测结果比较
成熟期烟曲霉生物被膜内菌丝密度较早期更为密集。无论早期或成熟期,药物作用48 h后,空白对照组和异绿原酸组生物被膜内的菌丝均以具有活力的绿色为主,几乎没有出现红色死亡状态的菌丝。见图 1(封三)。
2.3 SEM观察结果
2.3.1 对早期烟曲霉生物被膜破坏作用 空白对照组的菌丝大部分被黏稠的胞外基质包裹使之相互黏附形成致密的三维网状结构,仅能隐约看到部分菌丝轮廓,见图2(A);经异绿原酸作用后,胞外基质明显减少,菌丝轮廓饱满,清晰可见,见图2(B)。
2.3.2 异绿原酸对成熟期烟曲霉生物被膜破坏作用与早期相比,成熟期的生物被膜结构更加致密。空白对照组烟曲霉菌丝表面完全被浓密厚实的胞外基质包裹,几乎看不到菌丝的轮廓,见图2(C);异绿原酸组的菌丝表面虽然仍有残留少量的胞外基质,但相对于同时期空白对照组而言,胞外基质已经明显减少,菌丝轮廓更为清晰,见图2(D)。
2.4 结晶紫染色法对异绿原酸作用于不同时期生物被膜后的定量结果
无论早期或成熟期的生物被膜,当异绿原酸作用浓度达 256 μg/mL 及以上时,即 256、512、1024 μg/mL异绿原酸组的A570值与同期空白对照组比较,差异均有统计学意义(P < 0.05);64、128 μg/mL 异绿原酸组的A570值与同期空白对照组比较,差异均无统计学意义 (P > 0.05);256、512、1024 μg/mL 异绿原酸组 A570值两两比较,差异均有统计学意义(P<0.05),即随着异绿原酸浓度增加,生物被膜减少更明显;浓度低于256 μg/mL异绿原酸组对载体上生物被膜量影响与空白对照组比较,差异无统计学意义(P>0.05)。见表1。
3 讨论
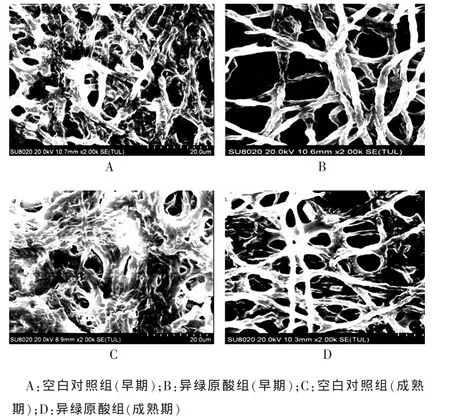
图2 不同时期烟曲霉生物被膜形态学(SEM,2000×)
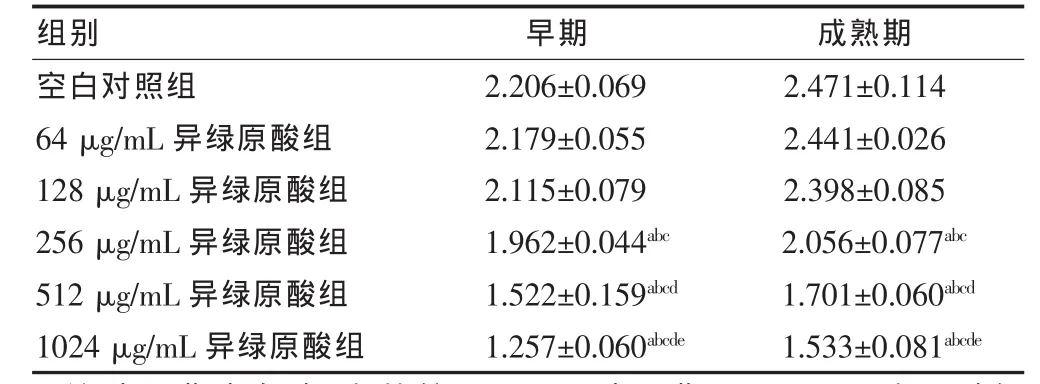
表1 异绿原酸作用于不同时期烟曲霉生物被膜后结晶紫染色法定量结果比较(x±s,n=3)
具有成膜能力的烟曲霉临床分离菌株在体外培养24 h后,可获得由多层菌丝有序排列形成具有复杂三维立体结构特征的多细胞菌落,即早期生物被膜,48 h后生物被膜逐渐成熟即成熟期生物被膜[10-11]。生物被膜形成以后,烟曲霉对常用抗真菌药物如两性霉素B及其脂质体、伏立康唑、伊曲康唑、卡泊芬净、米卡芬净等抗真菌药的敏感性均下降[12],且生物被膜越成熟,包裹在生物被膜内的菌体耐药性越明显。胞外基质是构成生物被膜的基础物质,其主要成分为多糖(半乳糖甘露聚糖,α-1,3-葡聚糖)、单糖、多元醇、疏水蛋白及各种抗原等。胞外基质带负电荷,可以吸收多肽链中带正电荷的氨基侧链,从而形成一道疏水屏障,阻碍亲水性抗真菌药物渗入菌体发挥杀菌作用[13]。随着烟曲霉生物被膜的成熟或在唑类药物诱导条件下,多耐药蛋白(MDR4)等多耐药基因表达会明显上调,其转录翻译出的MDR能介导菌体对药物的外排作用,降低细胞膜通透性,从而减少抗真菌药物在菌体内的蓄积量[14]。烟曲霉次级代谢产物胶霉毒素随着生物被膜的形成和成熟,产生量不断增加,使烟曲霉菌体得以避开宿主免疫系统的攻击并长期在宿主体内生存[15],这可能也是其发生耐药的机制之一。
金银花是清热解毒中药,其活性成分绿原酸类主要包括绿原酸(单咖啡酰奎宁酸)和异绿原酸(二咖啡酰奎宁酸),具有体外抗炎、抗菌、抗病毒及免疫调节作用。绿原酸类物质的抗真菌机制主要与其立体结构和棘白菌素类抗真菌药物结构具有相似性有关[2,16-17]。异绿原酸在金银花活性成分中的构成比仅次于绿原酸,化学结构比绿原酸多一个咖啡酰基,两者同属于苯丙素类化合物。本研究以最大溶解度的异绿原酸稀释100倍(1024 μg/mL)后作用于烟曲霉早期及成熟期生物被膜,CLSM观察到生物被膜内的菌丝仍有活力,说明亚抑菌浓度的异绿原酸对菌丝本身没有直接杀菌作用。SEM及结晶紫染色法定量结果证实异绿原酸可以使包裹菌丝的胞外基质明显减少,且随着其浓度增高(≥256 μg/mL),生物被膜减少愈显著,即异绿原酸能够抑制或降解胞外基质,破坏不同时期的烟曲霉生物被膜结构,其作用呈浓度依赖性。异绿原酸对成熟期生物被膜破坏作用不如早期生物被膜明显,这可能与成熟期生物被膜培养周期更长,胞外基质更浓厚,药物作用时间不足或菌体对药物外排作用随生物被膜成熟而增强有关,其具体机制有待进一步研究;可以推测,若能在生物被膜形成的早期阶段,用异绿原酸干预胞外基质形成或破坏其结构,减弱生物被膜屏障作用,并联合使用抗真菌药物,可增强药物的渗透并在菌体内达到有效蓄积量,从而发挥其杀菌活性,同时还能减轻大剂量应用抗真菌药物给机体带来的毒副作用,解决当前治疗生物被膜相关感染在药物选择方面捉襟见肘的现状。本课题组后期将通过进一步联合抗真菌药物实验来证实这一猜想。异绿原酸主要来源于金银花,其产地遍布全国各省,原材料丰富,取材便利,若能应用于临床治疗烟曲霉生物被膜相关感染,将极大降低药物成本,节约医疗费用,增加经济效益。本实验结论进一步拓展了中药金银花活性成分的功效范围,使其临床医疗应用前景更加广阔。
[1]Seidler MJ,Salvenmoser S,Muller FM,et al.Aspergillus Fumigatus forms biofilms with reduced antifungal drug susceptibility on bronchial epithelial cells[J].Antimicrob Agents Chemother,2008,52(11):4130-4136.
[2]MaCM,KullyM,KhanJK,etal.Synthesisof chlorogenic acid derivatives with promising antifungal activity[J].Bioorg Med Chem,2007,15(21):6830-6833.
[3]Ozcelik B,Kartal M,Orhan I,et al.Cytotoxicity,antiviral and antimicrobial activities of alkaloids,flavonoids,and phenolic acids[J].Pharm Biol,2011,49(4):396-402.
[4]温红侠,陈一强,朱莲娜,等.绿原酸对铜绿假单胞菌生物膜干预作用的体外研究[J].中华医院感染学杂志,2009,12(12):1478-1481.
[5]邬丽红,陈一强,孔晋亮,等.金银花主要活性成分对烟曲霉生物膜的体外影响[J].中国现代医药杂志,2014,6(6):1-4.
[6]John HR,Barbara DA,Beth AS,et al.Reference method for broth dilution antifungal susceptibility testing of filamentous fungi,approved standard-second edition M38-A2[S].Clinical Laboratory Standards Institute,2008:1-35.
[7]Mowat E,Butcher J,Lang S,et al.Development of a simple model for studying the effects of antifungal agents on multicellular communities of Aspergillus Fumigatus[J].J Med Microbiol,2007,56(Pt9):1205-1212.
[8]Peeters E,Nelis HJ,Coenye T,et al.Comparison of multiple methods for quantification of microbia biofilms grown in microtiterplates[J].JMicrobiolMethods,2008,72(2):157-165.
[9]Shao J,Cheng H,Wu D,et al.Antimicrobial effect of sodium houttuyfonate on staphylococcus epidermidis and candida albicans biofilms[J].J Tradit Chin Med,2013,33(6):798-803.
[10]唐梦丹,郑建锋,赵敬军.曲霉生物膜研究进展[A].2012全国中西医结合皮肤性病学术会议论文汇编,2012:1.
[11]Kaur S,Singh S.Biofilm formation by Aspergillus Fumigatus[J].MedMycol,2014,52(1):2-9.
[12]Arendrup MC.Update on antifungal resistance in Aspergillus and Candida[J].Clin Microbiol Infect,2014,20(Suppl6):42-8.
[13]Mowat E,Lang S,Williams C,et al.Phase-dependent antifungal activity against Aspergillus Fumigatus developing multicellular filamentous biofilms[J].J Antimicrob Chemother,2008,62(6):1281-1284.
[14]Rajendran R,Mowat E,Mcculloch E,et al.Azole resistance of Aspergillus Fumigatus biofilms is partly associated with efflux pump activity [J].Antimicrob Agents Chemother,2011,55(5):2092-2097.
[15]Bruns S,Seidler M,Albrecht D,et al.Functional genomic profiling of Aspergillus Fumigatus biofilm reveals enhanced production of the mycotoxin gliotoxin[J].Proteomics,2010,10(17):3097-3107.
[16]Karunanidhi A,Thomas R,Van belkum A,et al.In vitro antibacterial and antibiofilm activities of chlorogenic acid against clinical isolates of stenotrophomonas maltophilia including the Trimethoprim/Sulfamethoxazoleresistant strain[J].Biomed Res Int,2013,2013(12):392-458.
[17]Sung WS,Lee DG.Antifungal action of chlorogenic acid against pathogenic fungi,mediated by membrane disruption[J].Pure and Applied Chemistry,2010,82(1):219-226.
