登革2型病毒NS3蛋白具有抑制病毒复制的作用
2014-06-07朱碧青郑学礼
朱碧青,郑学礼
登革热是由登革病毒(DENV)引起的一种严重的虫媒病毒性传染病,主要在热带、亚热带地区流行[1]。据报道,全球约有25亿人受到登革热感染的威胁[2]。然而目前尚无特异有效的登革疫苗和抗病毒制剂[3]。
登革病毒属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),其基因组为单股正链RNA,长约11 kb,共编码3种结构蛋白(C、prM、E)和7种非结构蛋 白 (NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)[4]。其中NS3蛋白是一种亲水性的多功能蛋白,分子量(Mr)约为69kDa,含618个氨基酸,具有蛋白酶、RNA解旋酶和RNA聚合酶活性,在病毒的复制和成熟过程中起作用[5]。NS3蛋白含有蛋白酶和解旋酶两个结构域,具有良好的免疫原性,可诱导机体产生B、T细胞应答[6]。已有研究表明,NS3蛋白在病人和受试者体内可诱导产生较好的免疫反应,登革病毒NS3已成为有效的抗病毒靶标[7]。本研究目的在于构建DENV非结构蛋白NS3及其结构域的重组蛋白,并对其活性作初步鉴定,为登革疫苗的研制打下实验基础。
1 材料和方法
1.1 病毒株、菌株、质粒及细胞 DENV-2(新几内亚株)和大肠杆菌DH5α为本实验室保存。载体pcDNA3.1(+)由中山大学附属肿瘤医院实验室所赠。幼仓鼠肾细胞(BHK-21)为本实验室保存。
1.2 试剂 Trizol和Lipofectamine 2000购自美国Invitrogen公司;质粒提取试剂盒和凝胶回收试剂盒购自美国 Omega Bio-Tec公司;逆转录酶、PFU聚合酶、快速限制性内切酶、DNA Marker、pMD 18-T Vector试剂盒、实时定量PCR试剂盒等均购自大连TaKaRa公司;抗NS3兔多克隆抗体(SAB2700181)购自德国的Sigma公司;FITC标记的羊抗兔IgG和HRP标记的羊抗兔IgG均为SantaCruz公司产品;PVDF膜、Electrochemiluminescence(ECL)试剂盒均购自Bio-Rad公司。
1.3 目的基因的扩增 根据DENV-2NGC病毒株基因组序列(GenBank:NC-001474)设计引物如下:扩增非结构蛋白NS3及其结构域NS3P、NS3H的基因序列(图1)。使用pfu聚合酶进行PCR扩增:94℃2min;然后以92℃1min、55℃1min、72℃2min进行30个循环,再72℃延伸5min。
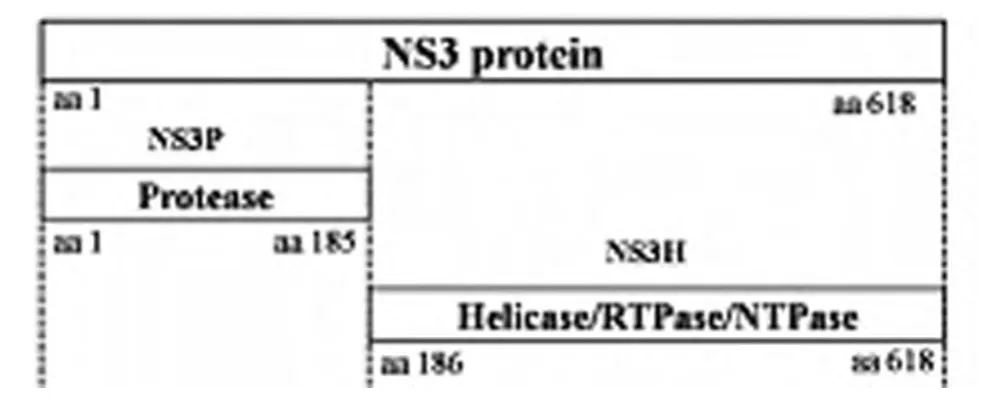
图1 DENV-2-NS3、DENV 2-NS3蛋白酶(NS3P)区 域 及DENV-2-NS3解旋酶(NS3H)区域结构示意图Fig.1 Schematic representation of DENV 2-NS3,NS3Pand NS3H
1.4 重组表达载体的构建 用快速性内切酶EcoR V和XbaI分别双酶切真核表达载体pcDNA3.1(+)和PCR产物,分别使用凝胶回收试剂盒及产物纯化试剂盒回收纯化目的片段,于4℃连接过夜,转化大肠杆菌DH5α,随机挑取克隆,经菌液PCR筛选阳性克隆,送Invitrogen公司测序,将读码框正确的重组质粒命名为pcNS3P、pcNS3H和pcNS3(见表1)。使用质粒提取试剂盒提取质粒,紫外分光光度计(Nanodrop2000)测定浓度用于转染。
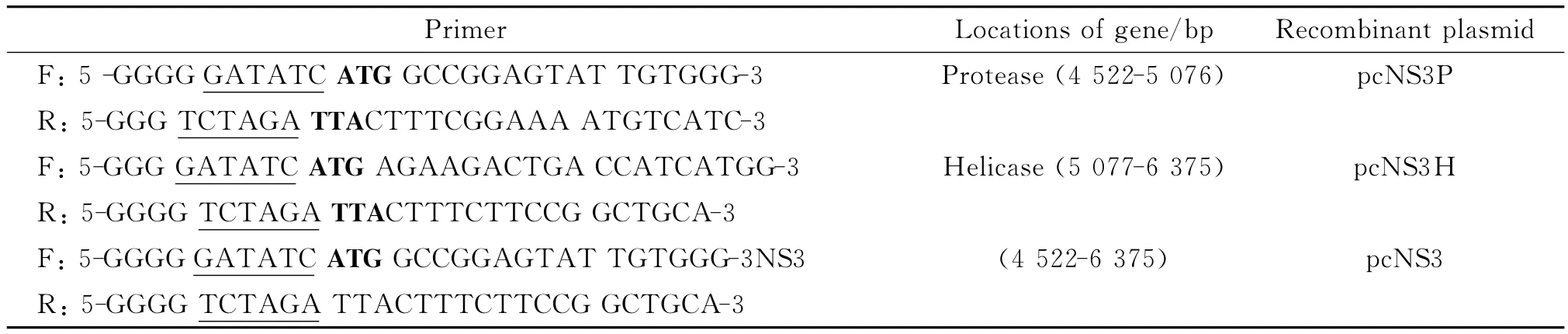
表1 登革病毒NS3蛋白酶、解旋酶和全长的引物序列Tab.1 Primers of NS3protease,NS3helicase and NS3full-length
1.5 转染 2×104个/孔的BHK-21细胞培养于含10%FBS的DMEM完全培养基中,待细胞在6孔板中长满单层时,将4μg重组质粒及空质粒pcDNA3.1(+)分别与10μL Lipo2000混合,转染细胞,于37℃、5%CO2下继续培养,于24h、36h、48h和72h分别收集细胞用于鉴定重组质粒的转染水平。
1.6 RT-PCR 采用Trizol法提取转染细胞的总RNA,经 DNaseI处 理 后,通 过 RT-PCR 检 测NS3P、NS3H和NS3基因在BHK-21细胞中的转录。PCR扩增NS3蛋白酶、解旋酶和全长基因的循环条件为:94℃2min;然后以92℃1min、55℃1 min、72℃2min进行25个循环,最后72℃延伸5 min。
1.7 间接免疫荧光 转染后24h的单层细胞用0.1mol/L、pH 7.4的PBS漂洗两次,用4%多聚甲醛固定10min后,用0.6%皂素透化10min。其后用1%BSA封闭30min。以SAB2700181(稀释度1∶500)为一抗、FITC标记的羊抗兔(1∶100稀释度)为二抗进行间接免疫荧光检测。
1.8 Western印迹 转染后48h收集细胞,用预冷的PBS缓冲液洗涤两次后,提取细胞总蛋白。将总蛋白定量后溶解于1×上样缓冲液中,煮沸5min后,离心,经12%SDS-PAGE分离;用半干转移印将胶上蛋白转移至PVDF膜上,用含5%脱脂奶粉的TBST室温封闭1h;以1∶1 000稀释的Anti-NS3(SAB2700181)为一抗,室温孵育2.5h,用 TBST洗膜6次,每次5min;以1∶8 500稀释的HRP标记的羊抗兔IgG为二抗,于室温孵育1h;用TBST洗膜6次,每次5min;ECL显色。
1.9 病毒感染和Real-time PCR反应体系 将转染6h后的细胞,弃去 转染液,用 DENV-2(MOI=1)攻击细胞,96h后收集细胞,用Trizol试剂提取各组BHK-21细胞的RNA,具体步骤详见说明书及相关文献。提取的总RNA(1ug)经逆转录为cDNA,备用于实时荧光定量PCR(QPCR)分析。QPCR反应体系和条件按说明书进行相关操作。反应条件:预变性95℃,30s,变性95℃、5s,退火55℃、30s,延伸72℃、30s,扩增40个循环,并收集溶解曲线。BHK-21分为以下3个组:实验组:质粒pcNS3P、pcNS3H和pcNS3转染,病毒攻击;空白对照组:质粒pcDNA3.1(+)转染,病毒攻击;阳性对照组:未转染质粒,病毒攻击。
1.10 统计学处理 使用SPSS13.0统计软件分析数据,组间比较采用One-Way ANOVA的多重比较,P<0.05为差异有统计学意义。
2 结 果
2.1 重组表达载体的构建与鉴定 以登革2型NGC株病毒全长cDNA克隆载体为模板进行扩增,可分别获得555bp、1 299bp和1 854bp的DNA片段(图2),与预期的NS3P、NS3H 和NS3基因大小一致。经同样双酶切的PCR产物与pcDNA3.1(+)进行连接,转化大肠杆菌DH5α后经菌液PCR筛选阳性克隆。测序结果表明,插入片段序列分别与NS3P、NS3H和NS3完全一致,并以正确的读码框插入表达载体。
2.2 重组pcNS3P、pcNS3H和pcNS3蛋白的表达与鉴定 采用Lipo2000将重组载体及pcDNA3.1(+)转染BHK-21细胞后,首先在RNA水平检测NS3P、NS3H和NS3基因的转录。为避免质粒污染,提取转染48h后的细胞总RNA后,经DNase I处理后,用蛋白酶及解旋酶的两对引物进行RTPCR。结果可获得分别与NS3H和NS3P大小一致的基因片段。未转染组及空白质粒转染组则不能获得目的条带。(图3)这说明重组质粒pcNS3P、pc-NS3H和pcNS3可在BHK-21细胞中转录产生NS3及其结构域基因的mRNA。
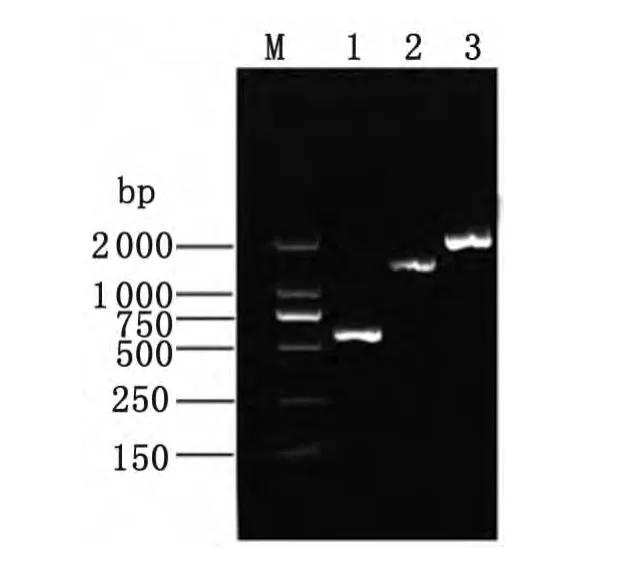
图2 登革2型病毒NS3P、NS3H和NS3基因的扩增M:DL2000;1:NS3P基因扩增产物;2:NS3H 基因扩增产物;3:NS3基因扩增产物Fig.2 Products of DEN-V 2-NS3P,NS3Hand NS3by PCRM:Marker DL2000;Lane 1:Product of DENV 2-NS3P;Lane 2:Product of DENV 2-NS3H;Lane 3:Product of DEN-V 2-NS3.
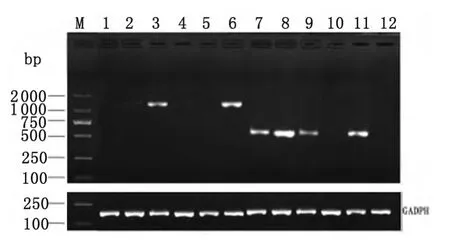
图3 RT-PCR检测NS3P、NS3H和NS3基因在BHK-21细胞中的转录M:DL2000;1和12:未经转染处理的总 RNA;2、4和7:转染pcNS3的细胞总RNA;3和6:转染pcNS3H的细胞总RNA;5和10:转染pcDNA3.1(+)的细胞总 RNA;9和11:转染pcNS3P的细胞总RNAFig.3 Level of transcription of NS3P,NS3Hand NS3gene in BHK-21cells by RT-PCRM:Marker DL2000;Lane 1and 12:The transcription of total RNA without transcription;Lane 2,4 and 7:The transcription of total RNA with pcNS3 recombination plasmid;Lane 3and 6:The transcription of total RNA with pcNS3Hrecombination plasmid;Lane 5and 10:The transcription of total RNA with pcDNA3.1(+)plasmid;Lane 9and 11:The transcription of total RNA with pcNS3Precombination plasmid.
为进一步观察登革2型NGC株非结构蛋白NS3及其结构域在BHK-21细胞中的表达情况,我们于转染24h后收集细胞,采用抗登革2型病毒NS3多克隆抗体作为一抗,进行间接免疫荧光检测。结果表明,转染24h、36h、48h和72h后,可在细胞质中观察到吸附有特异绿色荧光颗粒的物质,这说明NS3、NS3H和NS3P已在BHK-21细胞中表达(图4)。转染48h后提取细胞总蛋白进行SDS-PAGE,将胶上蛋白转移至PVDF膜,以Anti-NS3为一抗进行Western印迹,结果存在相对分子量约为69kDa、50kDa及18kDa的特异蛋白(图5),与 DENV2-NS3、DENV2-NS3H 和 DENV2-NS3P蛋白的预测大小相吻合。

图4 间接免疫荧光检测NS3P、NS3H和NS3在BHK-21细胞中的表达(瞬时转染24h,400×)A为NS3P的表达;B为NS3H的表达;C为NS3的表达;D为转染pcDNA3.1(+)Fig.4 Immunofluorescence of BHK-21cells transfected with recombinant plasmids based on NS3functional domains(Magnification 400×)A:NS3P;B:N3P;C:NS3;D:pcDNA3.1(+).
2.3 Real-time PCR 探讨重组 pcNS3、pcNS3H 及pcNS3P在细胞胞内对DENV复制的抑制效果 收集经DENV-2型NGC病毒株攻击72h的各转染实验组、未转染组及空白对照组的BHK-21细胞,应用QPCR检测各组细胞内病毒载量的变化。图6显示:转染pcNS3、pcNS3H组均与空白对照组及未转染组间的病毒载量存在着差异(P<0.05),空白对照组与未转染组之间差异没有统计学意义。转染pcNS3P组虽与未转染组及空白对照组间有量的变化,但之间的差异仍无统计学意义(P>0.05)。
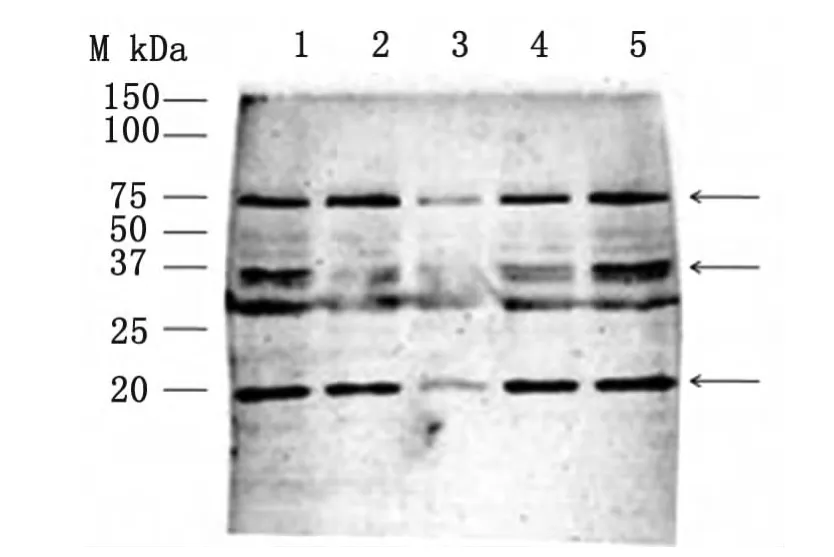
图5 Western印记检测NS3P、NS3H和NS3蛋白在BHK-21细胞中表达M:蛋白Marker;1:转染pcNS3H的细胞总蛋白;2和4:转染pcNS3的细胞总蛋白;3:转染pcDNA3.1(+)的细胞总蛋白;5:转染pcNS3P的细胞总蛋白。箭头为所指目的蛋白条带Fig.5 Protein of NS3P,NS3Hand NS3of DEN-V II in BHK-21by Western blotM:Marker;Lane 1:Total proteins of cells with transcription;Lane 2and 4:Total proteins of cells with pcNS3;Lane 3:Total proteins of cells with pcDNA3.1 (+);Lane 5:Total proteins of cells with pcNS3P.

图6 实时荧光定量PCR比较分析重组蛋白对登革2型病毒的调控(抑制)水平 (*表示差异存在统计学意义,***,P<0.001;*,P<0.05)Fig.6 Regulation for virus replication of recombination proteins of DENV-2with QPCR
3 讨 论
登革病毒非结构蛋白NS3,具有疏水性,在黄病毒中有很高的保守性[9],具有若干个T细胞表位[10]。已有试验表明,NS3蛋白在病人和受试者体内可诱导产生较好的免疫反应。为深入了解NS3在登革病毒致病过程中的作用机制,我们首先在哺乳细胞BHK-21中表达了DENV-2-NGC病毒株的NS3蛋白及其结构域,并对其活性作了初步的探究。
NS3蛋白由N端185个氨基酸残基的蛋白酶及C端433个氨基酸残基的解旋酶两个结构域构成[11-12]。NS3蛋白 N 端前180氨基酸含有丝氨酸蛋白酶区域,其前167氨基酸是DEN-V-2蛋白水解活性所需的最少残基数[13-14],剩余的C端含有3个酶活性的区域:NTP酶、RNA解螺旋酶和RTP酶,所以NS3蛋白对病毒在宿主体内的复制起着极其重要的作用。研究发现pcNS3及pcNS3H重组质粒可在哺乳细胞内对登革病毒的复制具有一定的抑制作用。最近研究发现日本脑炎病毒中NS3蛋白区域和NS3解螺旋酶区域会启动细胞死亡程序[15],而日本脑炎病毒和登革病毒同属黄病毒家族,都经过蚊媒传播。另外,在Langet病毒,一种蜱传播的脑炎黄病毒家族中,其NS3蛋白也需要结合半胱天冬酶-8引起细胞凋亡[16]。所以,登革病毒的NS3蛋白和NS3H也有可能是通过启动细胞死亡程序来减少病毒在宿主体内复制。NS3蛋白N端前180氨基酸含有丝氨酸蛋白酶区域,这个区域要发挥作用,需要病毒NS2B区域的活性[17],故而转染pcNS3P的重组质粒的BHK-21细胞对登革病毒的复制没有明显的抑制作用。
本研究缺陷在于 Western检测(图5)的NS3、NS3P和NS3H蛋白的特异性条带尚不清楚,原因为使用的是DENV-2-NS3的多克隆抗体进行检测,致使目的条带不特异,但蛋白的分子量符合大小。本实验后期在各蛋白下游加His-Tag标签蛋白,使用特异性抗体的针对His-Tag的蛋白进行检测。
综上所述,NS3蛋白区域具有一定的抗病毒作用,但这种作用主要集中在NS3H区域,而需要NS3P区域发挥抗病毒作用,可能需要NS2B区域的共同作用,这为我们进一步研究登革病毒非结构蛋白NS3基因疫苗提供一定的策略[18]。
[1]Helbig KJ,Carr JM,Calvert JK,et al.Viperin is induced following dengue virus type-2(DENV-2)infection and has anti-viral actions requiring the C-terminal end of viperin[J].PLoS Negl Trop Dis,2013,7(4):e2178.
[2]Flynn A.A study exploring the knowledge,attitudes and practices of young people regarding dengue fever and the extent of community involvement in vector control of the disease in Trinidad and Tobago[J].West Indian Med J,2012,61(6):615-618.
[3]Prusis P,Junaid M,Petrovska R,et al.Design and evaluation of substrate-based octapeptide and non substrate-based tetrapeptide inhibitors of dengue virus NS2B-NS3proteases[J].Biochem Biophys Res Commun,2013,434(4):767-772.
[4]Chambers TJ,Hahn CS,Galler R,et al.Flavivirus genome or-ganization,expression,and replication[J].Annu Rev Microbiol,1990,44:649-688.
[5]Tian Y,Chen W,Yang Y,et al.Identification of B cell epitopes of dengue virus 2NS3protein by monoclonal antibody[J].Appl Microbiol Biotechnol,2013,97(4):1553-1560.
[6]Rivino L,Kumaran EA,Jovanovic V,et al.Differential targeting of viral components by CD4+versus CD8+T lymphocytes in dengue virus infection[J].J Virol,2013,87(5):2693-2706.
[7]Byrd CM,Grosenbach DW,Berhanu A,et al.Novel benzoxazole inhibitor of dengue virus replication that targets the NS3 helicase[J].Antimicrob Agents Chemother,2013,57(4):1902-1912.
[8]Sung JM,Lee CK,Wu-Hsieh BA.Intrahepatic infiltrating NK and CD8Tcells cause liver cell death in different phases of dengue virus infection[J].PLoS One,2012,7(9):e46292.
[9]Incicco JJ,Gebhard LG,Gonzalez-Lebrero RM,et al.Steadystate NTPase activity of Dengue virus NS3:number of catalytic sites,nucleotide specificity and activation by ssRNA[J].PLoS One,2013,8(3):e58508.
[10]Mathew A,Rothman AL.Understanding the contribution of cellular immunity to dengue disease pathogenesis[J].Immunol Rev,2008,225:300-313.
[11]Rivino L,Kumaran EA,Jovanovic V,et al.Differential targeting of viral components by CD4+versus CD8+T lymphocytes in dengue virus infection[J].J Virol,2013,87(5):2693-2706.
[12]Malavige GN,Huang LC,Salimi M,et al.Cellular and cytokine correlates of severe dengue infection[J].PLoS One,2012,7(11):e50387.
[13]Falgout B,Pethel M,Zhang YM,et al.Both nonstructural proteins NS2Band NS3are required for the proteolytic processing of dengue virus nonstructural proteins[J].J Virol,1991,65(5):2467-2475.
[14]Li H,Clum S,You S,et al.The serine protease and RNA-stimulated nucleoside triphosphatase and RNA helicase functional domains of dengue virus type 2NS3converge within a region of 20amino acids[J].J Virol,1999,73(4):3108-3116.
[15]Yiang GT,Chen YH,Chou PL,et al.The NS3protease and helicase domains of Japanese encephalitis virus trigger cell death via caspasedependent and independent pathways[J].Mol Med Rep,2013,7(3):826-830.
[16]Prikhod'Ko GG,Prikhod'Ko EA,Pletnev AG,et al.Langat flavivirus protease NS3binds caspase-8and induces apoptosis[J].J Virol,2002,76(11):5701-5710.
[17]Niyomrattanakit P,Winoyanuwattikun P,Chanprapaph S,et al.Identification of residues in the dengue virus type 2NS2B cofactor that are critical for NS3protease activation[J].J Virol,2004,78(24):13708-13716.
[18]Mladinich KM,Piaskowski SM,Rudersdorf R,et al.Dengue virus-specific CD4+and CD8+T lymphocytes target NS1,NS3 and NS5in infected Indian rhesus macaques[J].Immunogenetics,2012,64(2):111-121.
[19]Tian Y,Chen W,Yang Y,et al.Identification of B cell epitopes of dengue virus 2NS3protein by monoclonal antibody[J].Appl Microbiol Biotechnol,2013,97(4):1553-1560.
