HPV16L1在整合型重组毕赤酵母中的表达及病毒样颗粒的纯化
2014-06-07田晓娟张丽芳李文姝薛向阳
田晓娟,冯 娟,张丽芳,李文姝,薛向阳
宫颈癌是全球妇女第二大常见的恶性肿瘤,严重威胁女性生命健康,而且近年来宫颈癌发病呈现年轻化趋势[1]。我国每年宫颈癌的新发病例大约15万人,导致约8万人死亡[2]。大量研究证实,高危型人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌的重要病因[3-4],其中,50%~60%宫颈癌组织可检测到HPV16[5],因此,HPV16是引起宫颈癌最重要的型别[6]。
HPV衣壳蛋白L1真核或原核细胞表达后可自行装配成病毒样颗粒 (virus-like particles,VLPs)。这种不含病毒核酸的VLPs已证实能有效的诱导机体产生针对HPV的保护性免疫反应[7]。目前,基于 HPV L1VLPs的Gardasil四价疫苗和Cervarix二价疫苗已经批准上市,接种后可诱导出良好的预防效果。但这两种HPV疫苗价格均较昂贵,尤其是对发展中的国家,限制其推广使用。中国大陆目前尚未正式引进HPV疫苗[8]。因此,研制经济有效的HPV疫苗迫在眉睫。特探索HPV16L1在整合型重组毕赤酵母中的表达及病毒样颗粒的纯化,以为HPV疫苗开发奠定基础。
1 材料与方法
1.1 材料 真核表达载体pPIC3.5K,原核原核E.coli.DH5α菌株,真核GS115菌株均由本实验室保存。pMD18-T载体购自TaKaRa公司,限制性内切酶BamHⅠ、EcoR I、BglII,T4DNA 连接酶、核酸分子质量标准DNA Marker、蛋白预染Marker,2×PCR Master Mix均购自Ferments公司;无内毒素质粒抽提纯化试剂盒(Endofree Plasmid Maxi Kit)购自Omega公司;HPV 16L1单克隆抗体购自abcam公司,HRP-羊抗鼠IgG购自联科生物技术有限公司(KPL公司产品);增强型HRP-DAB底物显色试剂盒购自天根生化,小量质粒DNA提取试剂盒、PCR产物纯化试剂盒、DNA琼脂糖凝胶回收试剂盒均购自上海捷瑞生物技术有限公司;Hi-TrapTM Heparin HP column购自美国GE Healthcare公司;其它试剂为国产或进口分析纯试剂。引物由上海生物工程有限公司合成。
1.2 方法
1.2.1 重组表达质粒pPIC3.5K/HPV16L1的构建 在不改变氨基酸密码的前提下,用酵母偏爱的同义密码子替代来自GenBank的野生型HPV16 L1基因序列(ACCESSION No.AY177679)中的酵母稀有密码子,将优化好的基因进行全序列合成,合成的目的片段经BamH I和EcoR I双酶切后连接入经过相同酶切处理的真核表达载体pPIC3.5K上,按常规分子生物学方法获得重组真核表达质粒pPIC3.5K/HPV16L1。以pPIC3.5K载体的通用引物5′AOX和3′AOX进行PCR鉴定,选鉴定出的阳性克隆送测序,测序结果正确的克隆进行下一步实验。
1.2.2 HPV16L1重组毕赤酵母菌的筛选 上述测序正确的阳性克隆扩大培养后用Endo-Free Plasmid Maxi Kit提取质粒DNA,BglⅡ酶切线性化后,电转化GS115感受态细胞。采用组氨酸缺陷的MD平板初步筛选阳性克隆,由于MD平板筛选的假阳性比较高,所以本实验在平板初步筛选的基础上,再进行PCR鉴定,以确保筛选的阳性克隆确实含有目的片段。
1.2.3 HPV16L1目的蛋白的诱导表达:将阳性转化菌接种到YPD培养基中活化后,接种至BMGY培养基中培养约18h。将上述菌液室温4 000rpm离心10min,菌体沉淀加BMMY培养基重悬后诱导表达。每24h向培养基添加无水甲醇至终浓度为1.0%,诱导后每24h取样,收集菌体沉淀,分析目的蛋白的表达。
1.2.4 重组蛋白的鉴定 利用SDS-PAGE和Western blotting分析重组毕赤酵母菌HPV16L1蛋白表达。高压细胞破碎仪破碎菌体,40μL菌体裂解液与10μL 5×protein loading buffer混匀,沸水煮沸3min,冷却后,12 000r/min离心2min,上清经10%SDS-PAGE胶电泳,行考马斯亮蓝染色同时,将PAGE胶上蛋白转至PVDF膜,5%脱脂奶粉封闭,与 HPV16L1单抗(1∶6 000)反应2h,TBST洗膜后,与HRP标记的羊抗鼠IgG二抗(1∶6 000)反应1h,TBST洗膜后,利用增强型HRP-DAB底物显色试剂盒(天根生化)显色。通过在暗室中曝光对PVDF膜上的目标蛋白进行分析。
1.2.5 HPV16L1VLPs的纯化与鉴定 收集诱导5d的菌体,高压细胞破碎仪破碎细胞,获得蛋白样品。将蛋白样品在binding buffer(2.68mmol/L KCl,1.47mmol/L KH2PO4,8.1mmol/L Na2HPO4,0.33mol/L NaCl,pH 7.0+0.01%Tween 80)中4℃透析3h。将透析好的蛋白样品上样到 Hi-TrapTM Heparin HP柱,用含不同浓度NaCl的E-lution buffer洗脱,收集包含L1蛋白的片段[9],利用Western blotting鉴定纯化结果。
1.2.6 VLPs的电镜观察 将适量纯化好的蛋白样品滴在铜网上,滤纸吸去多余的样品,然后滴加醋酸铀染色液,滤纸吸去多余染料,干燥后在透射电镜下观察VLPs的大小形态。
2 结 果
2.1 pPIC3.5K/HPV16L1重组质粒的构建及鉴定 将经酵母密码子优化的HPV16L1基因克隆入pPIC3.5K 载体,构建的pPIC3.5K/HPV16L1重组质粒(图1A)。PCR可扩增出与预期大小约1 518bp的目的片段,BamH I和EcoR I双酶切同样显示HPV16L1基因已成功克隆入pPIC3.5K载体中(图1B)。DNA测序进一步验证pPIC3.5K/HPV16L1重组质粒成功构建。

图1 pPIC3.5K/HPV16L1重组质粒图谱和酶切鉴定结果A:pPIC3.5K/HPV16L1重组质粒图谱;B:pPIC3.5K/HPV16L1重组质粒PCR及酶切鉴定结果。M1:1kDp DNA ladder marker,泳道1:pPIC3.5K/HPV16L1质粒PCR产物,泳道2:pPIC3.5K/HPV16L1质粒,泳道3:pPIC3.5K/HPV16L1质粒BamH I/EcoR I双酶切产物,M2:250bp DNA ladder markerFig.1 Map and restriction identification of recombinant pPIC3.5K/HPV16L1plasmidA:Map of recombinant pPIC3.5K/HPV16L1plasmid;B:Identification of recombinant pPIC3.5K/HPV16L1plasmid by PCR method and restriction enzyme digestion.M 1:1kDp DNA ladder;Lane 1:PCR product of pPIC3.5K/HPV16L1plasmid;Lane 2:PPIC3.5K/HPV16L1;Lane 3:pPIC3.5K/HPV16L1plasmid digested with BamH I and EcoR I restriction enzyme;M 2:250bp DNA ladder marker.
2.2 甲醇诱导重组蛋白的表达及鉴定 甲醇诱导重组酵母菌,高压细胞破碎仪破碎菌体获得目的蛋白后,利用SDS-PAGE和 Western blotting鉴定HPV16L1蛋白的表达。如图2显示,甲醇诱导48h后,Western blotting结果中清晰可见与HPV16L1单抗反应的特异条带,大小约为57kD,与理论分子量相符。由于表达量较低,SDS-PAGE电泳仅见微弱的目的蛋白条带。
2.3 HPV16L1VLPs的纯化与鉴定 肝素钠柱纯化诱导后重组酵母菌蛋白裂解液中自组装形成的HPV16L1VLPs。以0.6mol/L到1.2mol/L线性梯度的NaCl洗脱目的蛋白,利用SDS-PAGE和Western blotting鉴定纯化效果。结果显示洗脱HPV16L1VLPs的NaCl范围是0.6~1.0mol/L,见图3。
2.4 HPV16L1VLPs的电镜观察 以1.0mol/L NaCl洗脱纯化的蛋白样品进行醋酸铀染色,电镜观察VLPs。结果显示,经负染色后,在电镜下可以看到与天然病毒形态相似的大约55nm左右的病毒样颗粒,但是其直径大小不等(图4)。

图2 HPV16L1蛋白的SDS-PAGE和Western blot分析A:HPV16L1蛋白的SDS-PAGE 分析;B:HPV16 L1单抗鉴定目的蛋白。M:预染的protein marker,泳道1:GS115酵母菌;泳道2:pPIC3.5K/GS115酵母菌;泳道3:pPIC3.5K/HPV16L1/GS115酵母菌诱导前;泳道4:pPIC3.5K/HPV16L1/GS115酵母菌诱导48h.Fig.2 Analysis of HPV16L1expression by SDS-PAGE and Western blottingA:Identification of HPV16L1protein in 12%SDSPAGE;B:Identification of HPV16L1proteinby monoclonal antibody.M:Prestained protein marker;Lane 1:GS115strain;2:pPIC3.5K/GS115strain;3:pPIC3.5K/HPV16L1/GS115strain before induction;4:pPIC3.5K/HPV16L1/GS115strain induced for 48h.
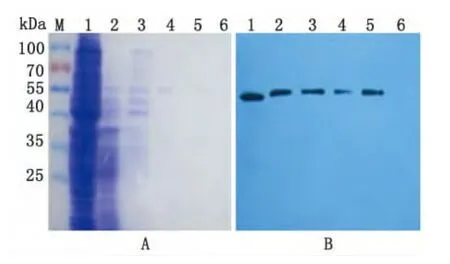
图3 SDS-PAGE和Western blot分析HPV16L1VLPs的纯化A:SDS-PAGE分析纯化的 HPV16L1VLPs;B:HPV16L1单抗鉴定纯化的VLPs。M:预染的protein marker 1:pPIC3.5K/HPV16L1重组酵母菌蛋白裂解液上柱前样品;2-6:含0.6mol/L,0.7mol/L,0.8mol/L,1.0mol/L,1.2mol/L不同浓度NaCl洗脱液的洗脱样品。Fig.3 Analysis of HPV16L1VLPs purification by SDSPAGE and Western blottingM:Prestained protein marker;Lane 1:Lysate of induced GS115strain with recombinant plasmid pPIC3.5K/HPV16L1;Lanes 2-6:Elution samples by Elution Buffer containing 0.6mol/L,0.7mol/L,0.8mol/L,1.0mol/L and 1.2mol/L concentrations of NaCl.

图4 HPV16L1VLPs电镜观察Fig.4 Observation of HPV16L1VLPs by electron microscopy
3 讨 论
目前批准上市的HPV预防性疫苗价格昂贵,极大地限制了在宫颈癌高发的发展中国家使用。到目前为止,可成功表达HPV L1蛋白的外源表达系统有原核表达系统[10]、酵母表达系统[11]、杆状病毒-昆虫细胞表达系统[12]及转基因植物等[13]。巴斯德毕赤酵母(Pichia pastoris)表达系统是20世纪80年代初期发展起来的一种新型的外源蛋白表达系统。作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。不仅如此,操作时与E.coli及酿酒酵母同样简单。它比杆状病毒-昆虫细胞或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。这些使得毕赤酵母表达系统成为目前最优秀、应用最为广泛的外源基因表达系统之一。本研究探索HPV16L1在整合型重组毕赤酵母中的表达及病毒样颗粒的纯化。
密码子的偏爱性使得克隆的外源基因往往难以在异种生物细胞高效表达[14]。为提高重组毕赤酵母HPV16L1表达量,本研究根据毕赤酵母的密码子偏好性对野生型HPV16L1基因进行了密码子的优化。由于毕赤酵母菌体内无稳定的附加型载体,而且既往的研究也未见HPV L1的分泌型表达,为此,本研究选择了胞内表达载体pPIC3.5K,利用整合型载体作为HPV16L1外源基因的表达载体。
结果显示,这种设计能有效表达HPV16L1目的蛋白。纯化HPV VLPs的方法常见的有蔗糖垫超速离心法、氯化铯梯度离心法、尺寸排阻色谱法等,但是这些方法步骤复杂,严重的影响了目的蛋白的得率,并大大增加了生产成本[9]。由于HPV感染的受体是细胞表面的粘多糖硫酸乙酰肝素[15-16],而肝素钠的结构与硫酸乙酰肝素相似,可与构象完整的VLPs结合,与错误折叠的VLPs不反应[15,17-19]。为此,我们选择用肝素纯化HPV16L1 VLPs,电镜负染不但再次证实构建的重组毕赤酵母中能有效表达HPV16L1目的蛋白,而且也证实采用肝素钠能有效快速地纯化 HPV L1VLPs。Knappe表明HPV16VLPs与肝素间的相互作用是依赖于正电荷分布[20]。因此我们将样品透析后进行VLPs纯化。
总之,本研究利用整合型重组毕赤酵母成功的表达了HPV16L1目的蛋白,而且通过肝素一步法快速获得了结构完整的HPV16L1VLPs,这些研究将为HPV16预防性疫苗新工艺的改善奠定了基础。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.DOI:10.3322/caac.20107
[2]Huang P,Tian JJ,Peng HY.Clinical significance of HPV detection for cervical precancerous[J].Chin Foreign Med Res,2011,9(29):140-141.(in Chinese)黄平,田晶晶,彭海燕.宫颈癌癌前HPV检测的临床意义[J].中外医学研究,2011,9(29):140-141.
[3]Cai HB,Ding XH,Chen CC.Prevalence of single and multiple human papilloma virus types in cervical cancer and precursor lesions in Hubei,China[J].Oncology,2009,76(3):157-161.DOI:10.1159/000195885
[4]Wentzensen N,Wilson LE,Wheeler CM,et al.Hierarchical clustering of human papilloma virus genotype patterns in the ASCUSLSIL triage study[J].Cancer Res,2010,70(21):78-86.DOI:10.1158/0008-5472.CAN-10-1188
[5]Bryan JT.Developing an HPV vaccine to prevent cervical cancer and genital warts[J].Vaccine,2007,25(16):3001-3006.DOI:10.1016/j.vaccine.2007.01.013
[6]Park MA,Kim HJ,Kim HJ.Optimum conditions for production and purification of human papillomavirus type 16L1protein from Saccharomyces cerevisiae[J].Protein Expr Purif,2008,59(1):175-181.DOI:10.1016/j.pep.2008.01.021
[7]Yang XY,Bo H,Shu YL.The research progress of hepatitis B virus core antigen as a carrier for virus-like partical vaccine[J].Chin J Virol,2012,28(3):311-315.(in Chinese)杨星钰,薄洪,舒跃龙.乙肝病毒核心抗原作为载体用于病毒样颗粒疫苗研究的主要进展[J].病毒学报,2012,28(3):311-315.
[8]Hai F,Bai M,Meng HB,et al.The research progress of human papillomavirus(HPV)vaccine[J].J Radioimmunol,2013,26(4):438-442.(in Chinese)海峰,白梅,孟和宝,等.人乳头瘤病毒(HPV)疫苗的研究进展[J].放射免疫学杂志,2013,26(4):438-442.
[9]Kim HJ,Kim SY,Lim SJ,et al.One-step chromatographic purification of human papillomavirus type 16L1protein from Saccharomyces cerevisiae[J].Protein Expr Purif,2010,70(1):68-74.DOI:10.1016/j.pep.2009.08.005
[10]Yang XF,Qu XZ,Wang K,et al.Construction of prophylactic human papillomavirus type 16L1capsid protein vaccine delivered by live attenuatedShigella flexneristrain sh42[J].Acta Biochim Biophys Sin(Shanghai),2005,37(11):743-750.
[11]Smith JJ,Burke A,Bredell H,et al.Comparing cytosolic expression to peroxisomal targeting of the chimeric L1/L2(ChiΔH-L2)gene from human papillomavirus type 16in the methylotrophic yeasts Pichia pastoris and Hansenula polymorpha[J].Yeast,2012,29(9):385-393.DOI:10.1002/yea.2917
[12]Abdoli A,Soleimanjahi H,Fotouhi F,et al.Human papillomavirus type16-L1VLP production in insect cells[J].Iran J Basic Med Sci,2013,16(8):891-895.
[13]Regnard GL,Halley-Stott RP,Tanzer FL,et al.High level protein expression in plants through the use of a novel autonomously replicating geminivirus shuttle vector[J].Plant Biotechnol J,2010,8(1):38-46.DOI:10.1111/j.1467-7652.2009.00462.x
[14]Zhao X,Huo KK,Li YY.Synonymous codon usage inPichia pastoris[J].Chin J Biotechnol,2000,16(3):308-311.(in Chinese)赵翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J].生物工程学报,2000,16(3):308-311.
[15]Giroglou T,Florin L,Schafer F,et al.Human papillomavirus infection requires cell surface heparan sulfate[J].J Virol,2001,75(3):1565-1570.DOI:10.1128/JVI.75.3.1565-1570.2001
[16]Joyce JG,Tung JS,Przysiecki CT,et al.The L1major capsid protein of human papillomavirus type 11recombinant virus-like particles interacts with heparin and cell-surface glycosaminoglycanson human keratinocytes[J].J Biol Chem,1999,274(9):5810-5822.
[17]Wang X,Sapp M,Christensen ND,et al.Heparin-based ELISA reduces background reactivity in virus-like particle-based papillomavirus serology[J].J Gen Virol,2005,86(1):65-73.DOI:10.1099/vir.0.80472-0
[18]Rommel O,Dillner J,Fligge C,et al.Heparan sulfate proteoglycans interact exclusively with conformationally intact HPV L1assemblies:basis for a virus-like particle ELISA[J].J Med Virol,2005,75(1):114-121.DOI:10.1002/jmv.20245
[19]Selinka HC,Giroglou T,Nowak T,et al.Further evidence that papilloma virus capsids exist in two distinct conformations[J].J Virol,2003,77(24):12961-12967.
[20]Knappe M,Bodevin S,Selinka HC,et al.Surface-exposed amino acid residues of HPV16L1protein mediating interaction with cell surface heparan sulfate[J].J Biol Chem,2007,282(38):27913-27922.DOI:10.1074/jbc.M705127200
