阻塞性睡眠呼吸暂停与非酒精性脂肪性肝病的关系研究
2014-06-06杨小骏
杨小骏,张 海,金 华
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是以睡眠过程中反复上呼吸道塌陷为特征的疾病,表现为气道完全梗阻(呼吸暂停)或部分梗阻(低通气)。低通气者称为阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS),可导致睡眠中断、间歇性缺氧、嗜睡和注意力不集中等表现[1]。30~70岁人群中,约有13%的男性和6%的女性有不同程度的OSA,由于肥胖者人数增加,OSA发病率呈逐年上升趋势[2]。非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是胰岛素抵抗与血脂异常密切相关的代谢应激性肝内脂肪酸沉积所致肝损伤。NAFLD包括非酒精性单纯性脂肪肝(nonalcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及相关的肝硬化和肝细胞癌等[3]。
目前研究显示OSA与心血管事件、代谢相关疾病有密切关系,是其独立的风险因素。NAFLD作为代谢综合征的表现形式,也与心血管事件的高风险相关。因此,关于NAFLD和OSA的共同发病机制受到关注。本研究旨在观察OSA患者中NAFLD发生情况和两者之间关系。
1 对象与方法
1.1 对象 2011年1月-2014年2月在我科住院行多导睡眠呼吸监测患者,符合入组标准者共141例。排除标准:酒精、病毒或其他原因引起的慢性肝病,慢性肺部疾病包括慢性阻塞性肺疾病(COPD)、结核,中枢性或混合性睡眠呼吸暂停等。
1.2 方法
1.2.1 常规检查 完善临床和实验室常规检查。稳态模型胰岛素抵抗(HOMA-IR)指数用于评价患者胰岛素抵抗水平。HOMA-IR计算方法:空腹血糖水平(mmol/L)×空腹胰岛素水平(mIU/L)/22.5。正常个体指数为1,胰岛素抵抗水平越高,HOMA-IR指数越大。
1.2.2 超声检测 参照中华医学会肝病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病诊疗指南》[4],影像学诊断标准具备以下3项表现中2项者为弥漫性脂肪肝:①肝脏近场回声弥漫性增强(明亮肝),回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。排除酒精性、病毒性或其他原因引起的慢性肝病可诊断为NAFLD。
1.2.3 多导睡眠呼吸监测和OSAHS诊断与评价 参照中华医学会呼吸病学分会睡眠呼吸障碍学组制定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》[5],对入组患者进行多导睡眠监测,监测项目包括心电图、脑电图、二导眼电图、下颌颏和胫前肌肌电图、口鼻呼吸气流、胸腹呼吸运动、血氧饱和度、体位、鼾声等,监测整夜不少于7 h的睡眠。OSAHS诊断标准:每夜7 h睡眠过程中呼吸暂停和低通气反复发作30次以上,或呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次/h。睡眠呼吸暂停低通气程度:正常为 AHI<5次/h,轻度为 AHI 5~14次/h,中度为 AHI 15~29次/h,重度为 AHI≥30次/h;低血氧程度:最低血氧饱和度(LSaO2)正常为>90%,轻度 LSaO2为85% ~90%,中度为80%≤LSaO2<85%,重度为LSaO2<80%。
1.3 统计学处理 用SPSS 13.0软件进行统计分析。GraphPad Prism 6软件进行制图。计量资料以均数 ±标准差(±s)表示。组间均数比较用Student t检验或Mann-Whitney U检验,计数资料组间率的比较用 χ2检验,理论频数小于5时使用Fisher精确检验,Pearson相关分析用于评估变量间相关性。P<0.05为差异有统计学意义。
2 结果
2.1 OSAHS组与非OSAHS组间一般资料的比较141例中,OSAHS组83例,其他58例为非 OSAHS组。141例中经 B超确诊为 NAFLD 65例,占46.1%。OSAHS组中 NAFLD占56.6%(47/83),非OSAHS组中 NAFLD占31.0%(18/58),两组比较差异有统计学意义(P<0.01)。两组患者分别采集性别、年龄、血压、糖尿病、血脂、体质指数(BMI)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、HOMA-IR,经统计分析显示,OSAHS组ALT和HOMA-IR指数显著高于非OSAHS组(P<0.01),其余项目未见统计学差异(P>0.05),见表1。
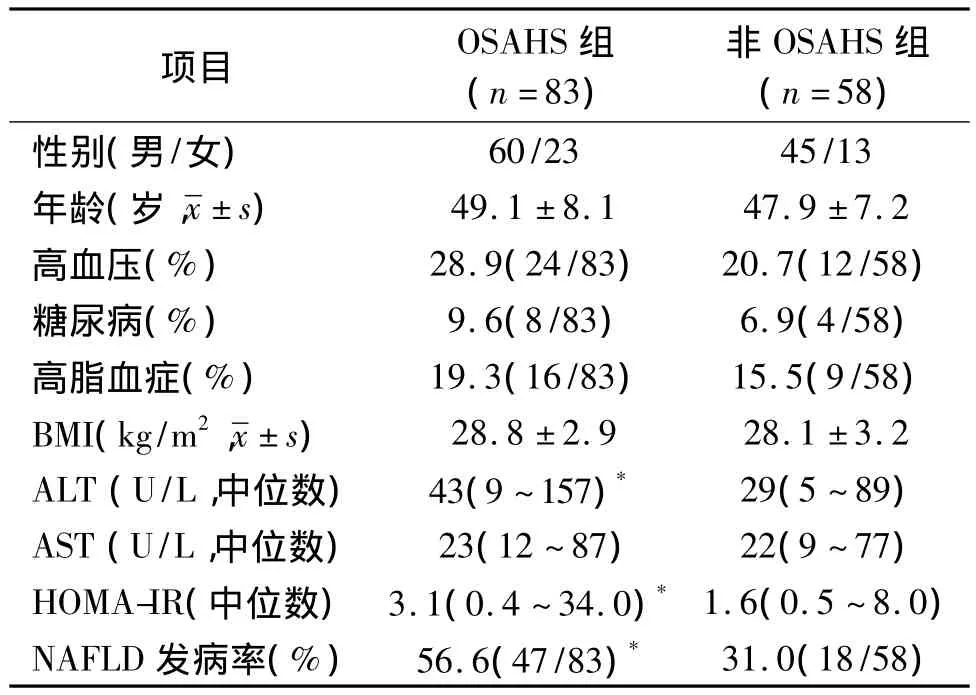
表1 OSAHS组与非OSAHS组间一般资料的比较
2.2 OSA严重程度与NAFLD比例的关系 根据AHI指数将OSAHS患者分为轻、中和重度三组,分别观察NAFLD比例。AHI<5次/h的非OSAHS组中NAFLD为31.0%(18/58)。AHI 5~14次/h组为43.8%(14/32),AHI 15 ~29 次/h组为 57.1%(16/28),AHI≥30 次/h 组为 73.9%(17/23)。NAFLD患者比例与AHI增加相关(图1)。
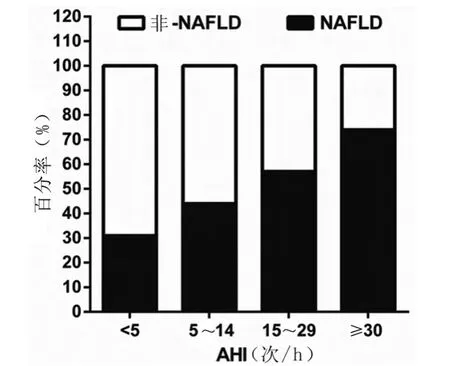
图1 NAFLD在不同AHI分组中比例分析
2.3 OSA患者中肝功能与最低血氧饱和度(LSaO2)相关性分析 ALT与LSaO2呈负相关,相关系数r=-0.676,P <0.01,见图 2。AST 与 LSaO2无相关性,r=-0.066,P=0.551,见图 3。

图2 ALT与最低血氧饱和度(LSaO2)的关系
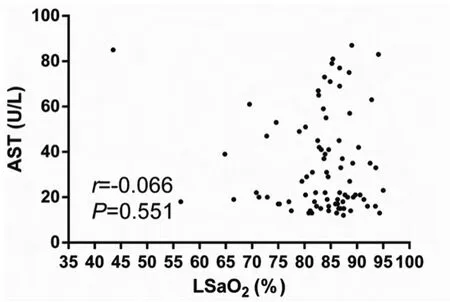
图3 AST与最低血氧饱和度(LSaO2)的关系
3 讨论
OSA与代谢综合征密切相关,并增加心血管事件风险。很多OSA患者同时患有多种疾病,如高血压、胰岛素抵抗等。NAFLD是最常见的肝脏疾病[6],作为代谢综合征的肝脏表现形式,也是心血管事件独立的风险因素[7]。NAFLD发生和发展的具体机制尚不清楚,越来越多证据显示OSA所致慢性间歇性缺氧与其相关[8]。Meta分析对 668名OSA患者和404名对照比较,肝酶指标、NAFLD和肝纤维化发病率均显著增高[9]。我们的结果显示,OSA患者中NAFLD的发病率达56.6%,显著高于非OSAHS组的 31.0%,而且随着 AHI的增高,NAFLD比例越来越高,说明机体夜间缺氧可能参与脂肪肝的发病机制。
OSA患者间歇性缺氧会导致交感神经和副交感神经周期性兴奋[10],自主神经功能紊乱、内皮细胞功能障碍、氧化应激、促炎症反应和凝血障碍等,引发胰岛素抵抗、2型糖尿病和心血管事件[11]。脂肪代谢紊乱主要涉及以下3个过程:脂肪组织脂解作用增强、脂肪降解减少、肝脏脂肪合成增加。间歇性缺氧则是这些过程的关键性调节因子。
由OSA所致慢性间歇性缺氧和血脂代谢紊乱引起胰岛素抵抗,导致脂肪在肝细胞内聚集形成单纯性脂肪肝。对健康志愿者进行的研究显示,间歇性缺氧可以产生不依赖于肥胖的胰岛素抵抗[12],而OSA诱导的胰岛素抵抗可以通过持续正压通气逆转[13]。胰岛素抵抗会使脂肪细胞数量和激素敏感性脂肪酶活性增加,肝脏摄取游离脂肪酸作用增强,同时减弱胰岛素对脂解作用的抑制,增加游离脂肪酸浓度。本研究也发现,OSAHS组与非OSAHS组比较HOMA-IR指数显著升高,说明OSAHS组胰岛素抵抗现象较为严重,这可能是由于慢性间歇性缺氧造成的。
慢性间歇性缺氧可以通过颈动脉体激活交感神经系统,导致脂肪组织分解,游离脂肪酸增多并转运到不同器官,使器官脂肪变性和炎症发生,形成NAFLD[14]。同时,运输入肝的游离脂肪酸增加,造成肝脏脂肪的积累。频繁的低通气或呼吸暂停发作导致反复血氧饱和度下降,造成严重的血氧不足。同时会增加炎症和氧化应激反应,产生脂质过氧化、细胞变性、坏死和凋亡,促炎症细胞因子释放,肝星形细胞激活及纤维化。增加的游离脂肪酸超出了线粒体脂肪酸β氧化的能力,进一步增强氧化应激和炎症反应[15]。
比较OSAHS组与非OSAHS组肝酶发现,ALT水平差异有显著性,而AST差异无统计学意义,提示肝功能受损所致AST和ALT升高程度不一致,这可能与两种酶在肝细胞内分布位置不同有关。ALT主要存在于肝细胞线粒体外,而AST主要存在于线粒体内。结合本研究,提示肝功能受损程度较轻时主要表现以ALT异常为主[16]。为进一步研究OSA对肝损害的影响,我们将OSA患者中LSaO2与ALT和AST水平进行相关性分析,发现 ALT水平与LSaO2呈负相关,提示肝损害程度与OSA缺氧程度相关,进一步证实OSA所致间歇性缺氧对机体的损伤作用。Kallwitz等[17]报道对85例接受外科治疗的肥胖患者进行睡眠监测和肝活检发现,伴有OSA的肥胖患者ALT水平显著增加,且有更明显的肝损害进展的组织学证据,而OSA与AST水平并无相关性,这与本研究结果相似。也有研究发现,随OSA程度加重,患者ALT和AST水平均升高[18]。这可能与不同研究涉及的患者病情、样本量有关。
总之,我们的研究表明随着 OSA的加重,NAFLD的发病率显著增高,且肝损程度越来越严重,这可能与OSA导致的慢性缺氧和胰岛素抵抗等有关。因此,OSA可能是NAFLD的独立风险预测因素。由于OSA与NAFLD之间相互联系的具体分子机制尚未完全明确,仍然需要进行相关的前瞻性随机对照试验,而治疗 OSA是否会延迟或降低NAFLD的进展也有待进一步研究。
[1]Drager LF,Togeiro SM,Polotsky VY,et al.Obstructive sleep apnea:a cardiometabolic risk in obesity and the metabolic syndrome[J].J Am Coll Cardiol,2013,62(7):569-576.
[2]Peppard PE,Young T,Barnet JH,et al.Increased prevalence of sleep-disordered breathing in adults[J].Am J Epidemiol,2013,177(9):1006-1014.
[3]Vernon G,Baranova A,Younossi ZM.Systematic review:the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J].Aliment Pharmacol Ther,2011,34(3):274-285.
[4]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[5]中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[6]周晓丹,施 洪.青年干部脂肪肝检出率与生活习惯、血脂、血清酶相关性分析[J].东南国防医药,2011,13(4):350-351.
[7]王 颖,钟 勇,史兆荣,等.中青年非酒精性脂肪肝与代谢综合征的关系[J].东南国防医药,2012,14(2):144-175.
[8]Musso G,Olivetti C,Cassader M,et al.Obstructive sleep apnea-hypopnea syndrome and nonalcoholic fatty liver disease:emerging evidence and mechanisms[J].Semin Liver Dis,2012,32(1):49-64.
[9]Sookoian S,Pirola CJ.Obstructive sleep apnea is associated with fatty liver and abnormal liver enzymes:a meta-analysis[J].Obes Surg,2013,23(11):1815-1825.
[10]曹江晨,李路军,任 伟,等.阻塞性睡眠呼吸暂停综合征541例心电图分析[J].东南国防医药,2012,14(2):159-163.
[11]Hamilton GS,Naughton MT.Impact of obstructive sleep apnoea on diabetes and cardiovascular disease[J].Med J Aust,2013,199(8):S27-30.
[12]Louis M,Punjabi NM.Effects of acute intermittent hypoxia on glucose metabolism in awake healthy volunteers[J].J Appl Physiol,2009,106(5):1538-1544.
[13]Sharma SK,Agrawal S,Damodaran D,et al.CPAP for the metabolic syndrome in patients with obstructive sleep apnea[J].N Engl J Med,2011,365(24):2277-2286.
[14]Mirrakhimov AE.Nonalcoholic fatty pancreatic disease and cardiometabolic risk:is there is a place for obstructive sleep apnea?[J]Cardiovasc Diabetol,2014,13:29.
[15]Dowman JK,Tomlinson JW.Newsome PN.Pathogenesis of non-alcoholic fatty liver disease[J].QJM,2010,103(2):71-83.
[16]Feng SZ,Tian JL,Zhang Q,et al.An experimental research on chronic intermittent hypoxia leading to liver injury[J].Sleep Breath,2011,15(3):493-502.
[17]Kallwitz ER,Herdegen J,Madura J,et al.Liver enzymes and histology in obese patients with obstructive sleep apnea[J].J Clin Gastroenterol,2007,41(10):918-921.
[18]Shpirer I,Copel L,Broide E,et al.Continuous positive airway pressure improves sleep apnea associated fatty liver[J].Lung,2010,188(4):301-307.
