AtchyB基因过表达对转基因洋桔梗抗氧化性的影响
2014-06-05杨海兰武卫党
季 静,杨海兰,王 罡,武卫党,金 超,吴 疆
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
AtchyB基因过表达对转基因洋桔梗抗氧化性的影响
季 静1,2,杨海兰1,2,王 罡1,2,武卫党1,金 超2,吴 疆1,2
(1. 天津大学化工学院,天津 300072;2. 天津大学遗传工程研究所,天津 300072)
由转β-胡萝卜羟化酶(AtchyB)基因的洋桔梗获得T1代转基因系,经PCR及northern blot技术检测后,对L8和 L25两个转基因系及野生对照进行 UV-B紫外胁迫处理.检测胁迫前后植株的类胡萝卜素、氧化酶(SOD、POD、CAT)和 MDA及光合作用相关参数值.对比结果表明:① 胁迫使得基因表达水平强化,转基因系中与抗氧化性相关类胡萝卜素显著高于对照,叶黄素循环池显著放大;② 酶促系统对非酶促系统产生影响,使得转基因系与对照间的酶活力存在差异,和对照比,转基因系的SOD对紫外胁迫更敏感,但MDA无显著差异,这可能是两种系统协调作用的结果;③ 胁迫后,转基因系 Fv/Fm和 ΦPSⅡ值显著高于对照,体现出其更强的抗氧化性.qP值显示AtchyB基因过表达对洋桔梗光化学猝灭影响不大,其中L25的NPQ显著高于对照,可见其非光化学淬灭能力有所提高.
转基因洋桔梗;AtchyB基因;类胡萝卜素;抗氧化性;光合作用
非生物胁迫包括温度、干旱、盐分、重金属及辐射等,严重影响作物的生长和产量[1].随着臭氧层的破坏,紫外-B(UV-B,280~315,nm)的辐射对地面植物的影响越来越严重,主要原因之一是其产生的活性氧[2].活性氧是指在生物体内与氧代谢有关的含氧自由基和易形成自由基的过氧化物的总称[3].它能引起植物核酸破坏、酶的抑制、蛋白质氧化以及膜脂质过氧化反应等[4].氧化产物 MDA,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性.此外,紫外产生过剩的光能也会在光合系统Ⅰ和Ⅱ中将电子传给氧气使之变成 O2-,导致膜脂过氧化,引起MDA的积累[5].UV辐射影响捕光系统,抑制光合成中电子的运输,光合系统Ⅱ(PSⅡ)是 UV破坏的主要部位,会导致光化学率Fv/Fm下降[6].
植物在遇到胁迫后,会产生应激反应,通过增加抗氧化酶活性或非酶抗氧化物质的合成来清除活性氧.前者为SOD、POD、CAT、APX、GPX等构成酶促系统,后者为类胡萝卜素、抗坏血酸、谷胱甘肽、类黄酮、生育酚等构成的非酶促系统[7].其中,类胡萝卜素是具有抗氧化性的一类色素,跟植物的光损伤保护、光能的捕获以及膜稳定性相关,尤其是植物在逆境下的发育及生理活动中.编码β-胡萝卜素羟化酶的基因 chyB是抗逆研究非常关键的一个基因.Cho等[8]研究转chyB基因的拟南芥发现,其中玉米黄质、新黄质、紫黄质提高.番茄中克隆的 chyB基因转入烟草后,相关类胡萝卜素含量提高,使得自由基清除能力增强,抗氧化性急剧提高[9].Davison等[10]使chyB基因在拟南芥中过表达,增大了叶黄素循环池,降低了脂质的过氧化反应,提高了拟南芥对高光照和高温的抗性.
此外,类胡萝卜素包括叶黄素和其他玉米黄质生成的叶黄素类等,是光捕获天线复合物的重要成分,不仅能保护光合成机构,防止光氧化[11-12],还能触发非光化学猝灭,消耗过多的热能,同时对脂质过氧化反应也起到保护作用[13-14].据研究,叶黄素循环耗散过量激发能,与非光化学猝面系数(NPQ)存在密切的正相关关系[15].叶黄素参与光系统中捕光色素蛋白复合物的组装、结构,并保持其功能的稳定性[16].
本实验中研究对象为洋桔梗.洋桔梗名草原龙胆,属龙胆科,其花期较长、花色多样、花型艳丽,是著名的观赏植物,越来越受到人们喜爱[17].基因工程能够将异源基因引入,对洋桔梗进行改良,包括其颜色、香味、紫外下显荧光、花期花型和抗除草剂等方面[18-22].Zhao等[23]将拟南芥中的 FT基因通过农杆菌介导法转入洋桔梗中,并成功表达.Wu等[24]成功将 AtchyB基因转入洋桔梗,其强光胁迫下相关类胡萝卜素含量显著提高.
笔者从紫外胁迫方面对转AtchyB基因洋桔梗的抗氧化性进行了进一步研究.通过转基因洋桔梗 3种重要酶促系统SOD、POD、CAT和非酶促类胡萝卜素含量的测定,分析其清除机制.光合参数的测定,反映植物光合效率及对过剩光能的淬灭能力,以此研究chyB基因表达的影响.
1 材料和方法
1.1 植物材料
转基因洋桔梗来自于本实验室.2个品系为转AtchyB基因(来自拟南芥,NM_001036638.2)洋桔梗T1代,标记为L5、L8、L10、L25.野生型对照WT.
所用质粒载体为本实验室保存的植物双元表达载体 pCambia2300,含有卡那霉素抗性基因,质粒图谱见图 1.所用根癌农杆菌株为本实验室构建的含有pCambia2300-AtchyB的C58菌株,农杆菌C58具有卡那霉素抗性.
1.2 植株阳性验证
1.2.1 PCR验证
取野生及转基因植株叶片 CTAB法提取基因组后,进行PCR检测,见表1.
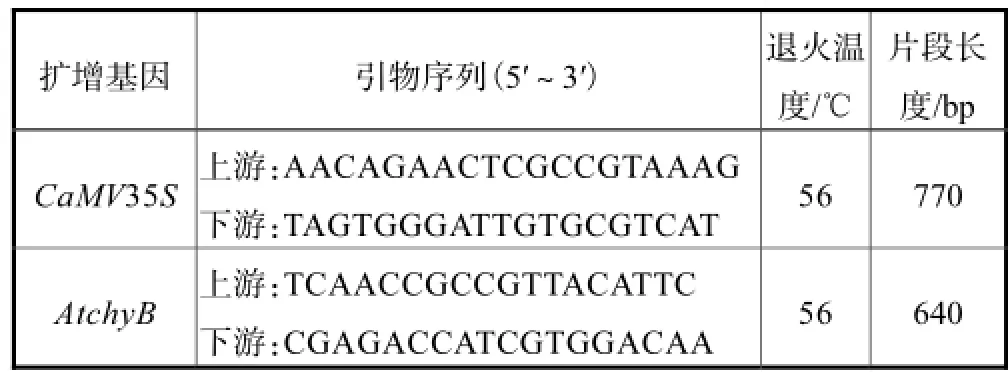
表1 PCR检测分析的引物Tab.1 Primers used for PCR analysis
1.2.2 Northern blot分析
Northern blot检测使用罗氏试剂盒(DIG Northern Starter Kit),以 DNA为模板,通过体外转录过程合成大量 RNA转录本,用地高辛标记得到探针,进行杂交分子的检测.
1.3 UV-B照射
取长势良好的洋桔梗第2对叶片,其中1个为对照,摘下后低光保存,另 1个放在美国伯乐GelDocXR凝胶成像仪下(UV-B透射光302,nm)照射15 min为1次,中间间隔5 min,共进行3次.
1.4 HPLC测定类胡萝卜素
方法参见文献[24].HPLC测得了 WT及 L8、L25在胁迫前、胁迫后的相关类胡萝卜素值.包括新黄质(neoxanthin,N)、紫黄质(violaxanthin,V)、花药黄质(antheraxanthin,A)、玉米黄质(zeaxanthin,Z)、代表黄素循环池的 V-A-Z 三者之和、叶黄素(lutein,L)、β-胡萝卜素(β-carotene,B)和总类胡萝卜素(T)的含量.
1.5 SOD、POD、CAT及MDA的测定
可溶蛋白测定用考马斯亮蓝比色法.蛋白标准曲线制备:BSA制成梯度溶液,与考马斯亮蓝反应后用UV-分光光度计测595,nm下的OD值.
SOD、POD、CAT和 MDA的测定:取叶片0.1,g,加入 0.1,mol/L的磷酸缓冲液,用组织研磨器研磨成浆.3,000,r/min离心 10,min,取上层匀浆液.用南京建成生物工程研究所的试剂盒方法测定相关参数,并计算酶活及MDA含量,3次重复取平均.
1.6 LI-6400便携式光合仪测定光合参数
为了保证离体测量尽量接近植物正常条件下的参数,在早上摘取叶片后立即用湿的脱脂棉包裹叶柄处防止空气进入叶柄.后经紫外照射后黑暗处进行20 min暗适应,用光合仪叶室夹住叶片,测定初始荧光(Fo)、可变荧光(Fv)、最大荧光(Fm)和恒态荧光(Fs).保证测定时间在9:00—11:00之间.仪器作用光打开,0.5,h预热.叶片放置光下 0.5,h进行光适应后,测定作用光下的最小荧光(Fo′)、最大荧光(Fm′).通过计算得到Fv/Fm、ΦPSⅡ、NPQ和qP.
Fv/Fm是常用于度量植物PSⅡ活性的重要指标,反映植物叶片原初光能转换效率.ΦPSⅡ表示实际光化学量子产量,反映 PSⅡ反应中心在部分关闭时的实际原初光能捕获效率.PSⅡ天线色素吸收光能用于电子链传递,而剩余的被耗散的部分由 NPQ反映.qP表示 PSⅡ天线色素吸收光能用于光化学电子传递的份额,反映质体醌氧化状态和 PSⅡ电子传递活性.
1.7 统计学分析数据
以下胁迫前后变化值皆为胁迫后值减去胁迫前值.用spss17.0软件对L8和L25分别与WT进行独立 T-test.数据用平均值±标准差的形式表示.显著性分析:P<0.05时,用 a标记,代表显著;P<0.01时,用b标记,代表极显著.
2 结 果
2.1 阳性验证
PCR产物凝胶电泳结果如图 2所示,northern blot验证结果如图 3所示.根据验证结果,最终选择L8和L25作为实验对象.
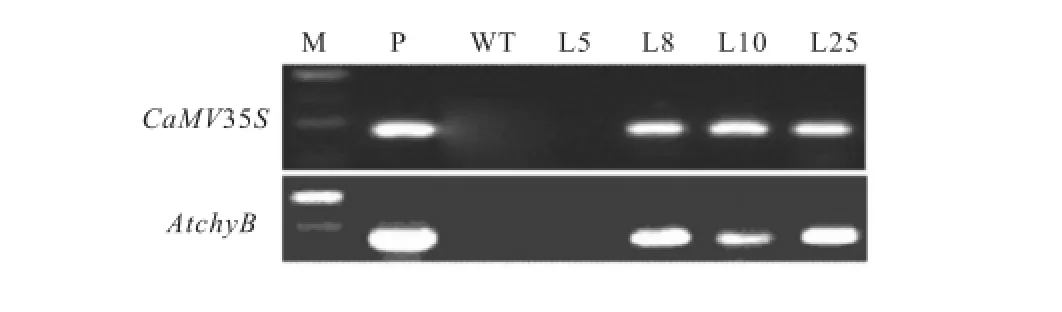
图2 PCR产物凝胶电泳结果Fig.2 Electrophoresis analysis of PCR products
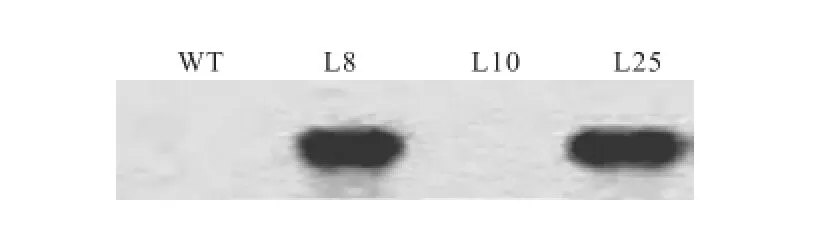
图3 Northern blot 验证结果Fig.3 Northern blot verification result
2.2 类胡萝卜素含量
紫外前后相关类胡萝卜素含量如图4所示.
紫外照射之前,转基因植株的类胡萝卜素含量显著高于野生植株.其中,L8与野生比较,V-A-Z、N、T显著高于WT.L25与野生植株比较,V-A-Z、N、L、T显著高于 WT.β-胡萝卜素含量在转基因系与对照间无显著差异.
紫外照射后,L8和 L25的 V-A-Z、N、L、T显著高于WT;β-胡萝卜素显著低于对照.
紫外后与紫外前的差值(见表 2)比较可以看出,对照的类胡萝卜素含量都有所降低.而转基因植株的 V-A-Z、N、L变化不明显.差别最明显的是 V-AZ,在WT中其含量下降了26.59%;而胁迫后转基因植株中其含量有所提高,L8与 L25分别提高了2.08%和 11.05%.转基因植株β-胡萝卜素下降值高于对照.WT、L8和L25 3者的β-胡萝卜素下降分别为 29.74%、81.05%、74.08%,总类胡萝卜素含量下降分别为21.36%、10.10%、3.85%.
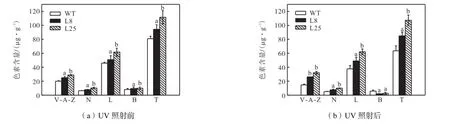
图4 紫外照射前后WT、L8和L25类胡萝卜素含量Fig.4 Content of carotenoids in WT,L8,L25 before and after UV irradiation

表2 紫外照射前后WT、L8和L25类胡萝卜素含量变化值Tab.2 Chang values of the carotenoids in WT,L8,L25 before and after UV irradiation μg/g
2.3 SOD、POD、CAT及MDA
标准曲线公式 y=0.920,64,x,相关系数 R2= 0.991,89>0.98,斜率值有意义.
测得的SOD、POD、CAT 3种酶值及MDA在紫外前后值如图 5所示.可见,紫外胁迫前,L8和 L25的SOD都显著低于野生植株,POD极显著高于野生植株,而CAT显著高于野生植株.
紫外胁迫后,3种酶值都有所降低,转基因植株的SOD与野生植株存在极显著差异,POD仍极显著高于野生植株.转基因植株与野生植株 CAT趋于相同.
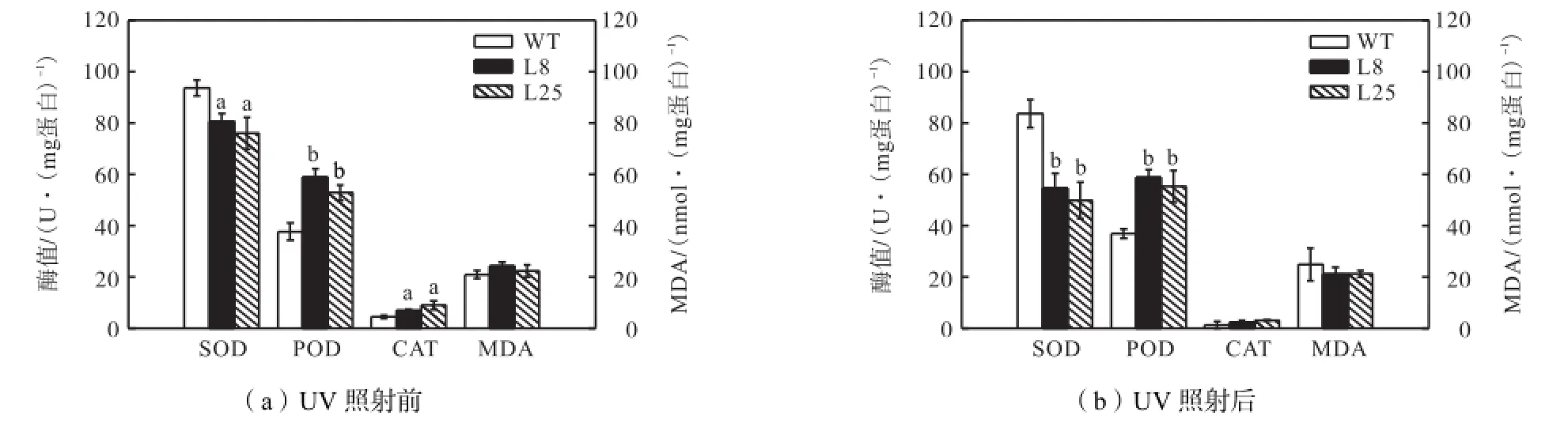
图5 紫外照射前后酶值及MDA值Fig.5 Enzyme activity and MDA content before and after UV irradiation
胁迫前后变化值(见表 3)的比较显示,转基因植株的 SOD降低值显著大于野生植株.L8和 L25的变化值是对照的2.61和2.62倍,POD和CAT变化值在转基因植株与对照间无显著差异.胁迫前后,转基因植株和野生植株的MDA值存在着差异,但是由于误差原因,统计学方法分析后并不能确定这一差异的显著性.

表3 紫外照射前后酶及MDA的变化值Tab.3 Change values of the enzyme activity and MDA content before and after UV irradiation
2.4 光合参数
测量的光合参数值包括 Fv/Fm、ΦPSⅡ、qP及 NPQ值,如表4所示.
数据分析得出,紫外前转基因植株与野生植株比较,光化学效率 Fv/Fm、ΦPSⅡ、NPQ和 qP值都无显著 差异.
紫外照射后(见图 6),3个植株的各项参数都受到一定影响.转基因植株 Fv/Fm、ΦPSⅡ显著高于野生植株;qP差异不显著.转基因植株的 NPQ值略高于对照,其中L25的值高于对照85.71%.
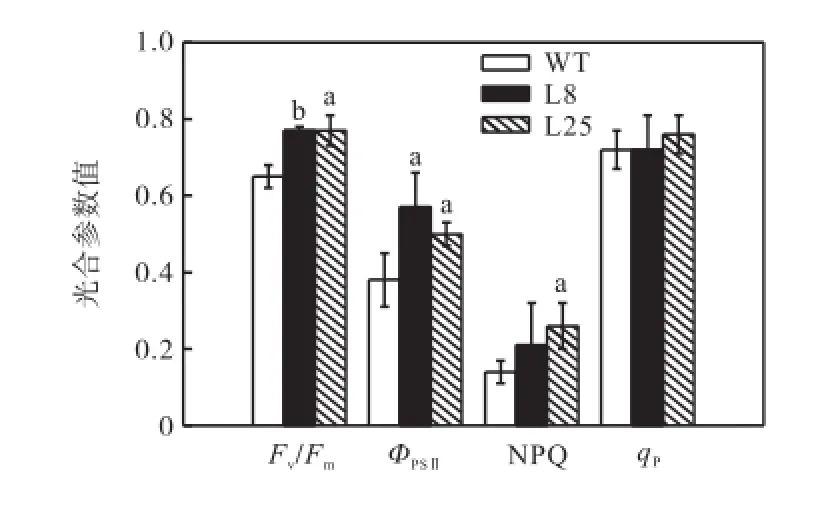
图6 紫外照射后光合参数Fig.6 Photosynthetic parameters after UV irradiation
3 结 论
(1) 紫外照射前,AtchyB基因在洋桔梗中的表达不同程度上提高了β-胡萝卜素下游相关色素含量,但是β-胡萝卜素含量无显著差异.紫外的作用使得β-胡萝卜素含量下降,尤其是转基因植株,比野生植株下降更严重.这也说明了UV-B辐射下AtchyB基因表达加强,V-A-Z(紫黄质-花药黄质-玉米黄质)、N(新黄质)、L(叶黄素)不同程度的提高体现了其在植物逆境时去除活性氧方面发挥了必要的作用.转基因植株的总类胡萝卜素含量下降低于对照,尤其是L25,说明了转基因植株在逆境中更加稳定.
(2) 紫外照射前,转基因植株的SOD低于对照,而POD、CAT的值高于对照,这表明类胡萝卜素这种非酶促系统对酶促系统产生了影响.紫外照射后,SOD的显著变化显示,其在转基因植株中对紫外胁迫敏感度强于对照,可见转基因植株的酶促系统防御机制在逆境下较弱.但是MDA这种氧化产物并未有明显变化.这可能是植物的酶促系统与非酶促系统起到了协同作用的结果,二者共同起到了抗氧化作用.
(3) 紫外照射前,光合的4个重要生理指标在转基因植株和野生植株间无显著差异.紫外胁迫后,Fv/Fm、ΦPSⅡ、NPQ在对照和转基因植株间出现差异,体现了转基因植株高的抗逆性.qP值说明基因的表达对光化学淬灭影响不大.转基因植株 NPQ的增加高于对照,说明转基因植株有更高的热耗散能力即非光化学淬灭能力,在逆境下自我调节能力更强.
[1] Josine T L,Ji J,Wang G,et al. Advances in genetic engineering for plants abiotic stress control [J]. African Journal of Biotechnology,2011,10(28):5402-5413.
[2] Rybus-Zajac M,Kubis J. Effect of UV-B radiation on antioxidative enzyme activity in cucumber cotyledons[J]. Acta Biologica Cracoviensia Series Botanica,2010,52(2):97-102.
[3] Shen X,Li X,Li Z,et al. Growth,physiological attributes and antioxidant enzyme activities in soybean seedlings treated with or without silicon under UV-B radiation stress[J]. Journal of Agronomy and Crop Science,2010,196(6):431-439.
[4] Doupis G,Chartzoulakis K,Beis A,et al. Allometric and biochemical responses of grapevines subjected to drought and enhanced ultraviolet-B radiation [J]. Australian Journal of Grape and Wine Research,2011,17(1):36-42.
[5] Ahn M J,Noh S A,Ha S,et al. Production of ketocarotenoids in transgenic carrot plants with an enhanced level of beta-carotene [J]. Plant Biotechnology Reports,2012,6(2):133-140.
[6] Moon Y R,Kim J H,Lee M H,et al. Thermal dissipation of excess light in Arabidopsis leaves is inhibited after gamma-irradiation [J]. Journal of Plant Biology,2008,51(1):52-57.
[7] 尹永强,胡建斌,邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报,2007,23(1):105-110.
Yin Yongqiang,Hu Jianbin,Deng Mingjun. Latest development of antioxidant system and responses to stress in plant leaves[J]. Chinese Agricultural Science Bulletin,2007,23(1):105-110(in Chinese).
[8] Cho D H,Jung Y J,Choi C S,et al. Astaxanthin production in transgenic Arabidopsis with chyB gene encoding beta-carotene hydroxylase[J]. Journal of Plant Biology,2008,51(1):58-63.
[9] Choi Y J,Yoon K Y,Yun H K,et al. Enhanced antioxident effect by over expression of tomato beta-carotene hydroxylase gene(chyB)using agrobacterium-infiltration in tobacco plant[J]. Korean Journal of Horticultural Science and Technology,2011,29(3):267-272.
[10] Davison P A,Hunter C N,Horton P. Overexpression of beta-carotene hydroxylase enhances stress tolerance in Arabidopsis[J]. Nature,2002,418(6894):203-206.
[11] Gotz T,Sandmann G,Romer S. Expression of a bacterial carotene hydroxylase gene(crtZ)enhances UV tolerance in tobacco[J]. Plant Molecular Biology,2002,50(1):129-142.
[12] Bramley P M. Regulation of carotenoid formation during tomato fruit ripening and development[J]. Journal of Experimental Botany,2002,53(377):2107-2113.
[13] Pogson B J,Rissler H M. Genetic manipulation of carotenoid biosynthesis and photoprotection[J]. Philosophical Transactions of the Royal Society of London Series B:Biological Sciences,2000,355(1402):1395-1403.
[14] Havaux M,Niyogi K K. The violaxanthin cycle protects plants from photooxidative damage by more than one mechanism[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(15):8762-8767.
[15] Pieters A J,Tezara W,Herrera A. Operation of the xanthophyll cycle and degradation of D1 protein in the inducible CAM plant,Talinum triangulare,under water deficit[J]. Annals of Botany,2003,92(3):393-399.
[16] 林植芳,彭长连,林桂珠.植物黄体素(Lutein)与环氧化黄体素-黄体素循环[J]. 植物生理学通讯,
2006,42(3):385-394. Lin Zhifang,Peng Changlian,Lin Guizhu. Lutein and lutein epoxide-lutein cycle in plants[J]. Plant Physiology Communications,2006,42(3):385-394(in Chinese).
[17] Lugassi-Ben-Hamo M,Kitron M,Bustan A,et al. Effect of shade regime on flower development,yield and quality in lisianthus[J]. Scientia Horticulturae,2010,124(2):248-253.
[18] Deroles S C,Bradley J M,Schwinn K E,et al. An antisense chalcone synthase cDNA leads to novel colour patterns in lisianthus(Eustoma grandiflorum)flowers[J]. Molecular Breeding,1998,4(1):59-66.
[19] Mercuri A,Sacchetti A,Schiva T,et al. Green fluorescent flowers[J]. Plant Science,2001,161(5):961-968.
[20] Aranovich D,Lewinsohn E,Zaccai M. Post-harvest enhancement of aroma in transgenic lisianthus(Eustoma grandiflorum)using the Clarkia breweri benzyl alcohol acetyltransferase(BEAT)gene[J]. Postharvest Biology and Technology,2007,43(2):255-260.
[21] Thiruvengadam M,Yang C H. Ectopic expression of two MADS box genes from orchid(Oncidium Gower Ramsey)and lily(Lilium longiflorum)alters flower transition and formation in Eustoma grandiflorum[J]. Plant Cell Reports,2009,28(10):1463-1473.
[22] Chen Y T,Fang Q S,Chiang C H,et al. Transgenic Eustoma grandiflorum expressing the bar gene are resistant to the herbicide Basta(A(R))[J]. Plant Cell Tissue and Organ Culture,2010,102(3):347-356.
[23] Zhao Q,Ji J,Wang G. Testing an induciable expression system in transgenic lisianthus(Eustoma grandiflorum cv. LisaBlue)[J]. African Journal of Biotechnology,2012,11(21):4767-4772.
[24] Wu W D,Ji J,Wang G,et al. Overexpression of AtchyB in Eustoma grandiflorum Shinn enhances its tolerance to high-light via zeaxanthin accumulation[J]. Plant Molecular Biology Reporter,2012,30(6):1433-1443.
(责任编辑:田 军)
Effect of Over-Expression of AtchyB on the Oxidation Resistance of Transgenic Eustoma Grandiflorum
Ji Jing1,2,Yang Hailan1,2,Wang Gang1,2,Wu Weidang1,Jin Chao2,Wu Jiang1,2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. Research Institute of Genetic Engineering,Tianjin University,Tianjin 300072,China)
T1 generation of the transgenic Eustoma grandiflorum was obtained by over-expressing AtchyB gene encoding β-carotene hydroxylase,and they were detected by PCR and northern blot technology. UV-B radiation stress was applied to the transgenic lines(L8 and L25)and the control,then the carotenoids content,oxydase activities(SOD、POD、CAT),MDA and the photosynthetic parameters before and after the radiation were analyzed. The results are as follows:① UV-B strengthened the gene expression level,and the carotenoids related to the oxidation resistance in the transgenic lines are much higher compared to the control. Besides,the xanthophyll cycle is strongly enhanced in transgenic lines.② the enzymatic system has an effect on the non-enzymatic system,so there has some difference in the oxydase activities between the transgenic lines and the control. The SOD of the transgenic lines is more sensitive to the UV-B radiation stress,but there is no significant difference in MDA content probably due to the synergy of the two systems. ③ The Fv/Fmand ΦPSⅡvalue of transgenic lines are significantly higher,which shows the stronger oxidation resistance to UV-B radiation stress. The undifferentiated qPvalue shows that over-expression of AtchyB gene has no effect on the photochemical quenching. The higher value of NPQ in L25 means its nonphotochemical quenching ability has bean improved.
transgenic Eustoma grandiflorum;AtchyB gene;carotenoids;oxidation resistance;photosynthesis
Q945
A
0493-2137(2014)08-0735-06
10.11784/tdxbz201212037
2012-12-17;
2013-03-06.
国家自然科学基金资助项目(31271793,31271419);国家转基因生物新品种培育重大专项资助项目(2014ZX08003-002B).
季 静(1965— ),女,博士,教授,jijingtjdx@163.com.
杨海兰,yanghailan@tju.edu.cn.
