阿哌沙班片微生物限度检查方法验证
2014-06-05范新风
范新风
(北京双鹭药业股份有限公司,北京 100041)
阿哌沙班片微生物限度检查方法验证
范新风
(北京双鹭药业股份有限公司,北京 100041)
目的建立阿哌沙班片微生物限度检查方法。方法细菌计数采用离心法联合薄膜过滤法;霉菌及酵母菌计数采用培养基稀释法;控制菌大肠埃希菌采用常规法。结果在3次独立的平行试验中,5株试验菌的回收率均>70%,符合验证要求。结论该微生物检查法消除了样品的抑菌性,可用于该品种的微生物限度检查。
阿哌沙班片;微生物限度检查;方法学验证
阿哌沙班是口服Xa因子直接抑制剂,继达比加群酯和利伐沙班后上市,用于择期髋关节或膝关节置换手术的成年患者,以预防静脉血栓形成[1]。
按阿哌沙班片国家食品药品监督管理局进口标准药品注册标准:JX20120076微生物限度检查法进行试验:其中细菌计数采用培养基稀释法(每皿0.5 mL),霉菌及酵母菌计数采用平皿法,控制菌采用常规法。结果显示:枯草芽孢杆菌回收率为0%,有明显抑菌性;白色念珠菌回收率仅为67%,有抑菌性。大肠埃希菌回收率98%,金葡菌回收率93%,黑曲霉回收率89%。控制菌检查试验组和阳性对照组阳性菌生长良好,证明该方法专属性良好。由实验结果可以得出,进口注册标准的细菌计数、霉菌和酵母菌计数方法不适用笔者公司生产的阿哌沙班片的微生物限度检查。因此,为保证药品的质量和临床用药安全,保证方法的准确和可靠性,按《中药药典》2010版附录XIJ,进行阿哌沙班片微生物限度检查方法验证。
1 试验材质
1.1 试验样品:阿哌沙班片(规格:5 mg;批号:130401、130402、130403本公司生产)。
1.2 稀释剂与培养基:pH7.0氯化钠-蛋白胨缓冲液(自制)、营养肉汤培养基(101124)、改良马丁培养基(130409)、营养琼脂培养基(110616)玫瑰红钠琼脂培养基(1210184)、胆盐乳糖培养基(1204192)、4-甲基伞形酮葡糖苷酸培养基(MUG)(121023)。以下培养基均购自北京三药科技开发公司。
1.3 试验菌株:枯草芽孢杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、黑曲霉[CMCC(F)98003]、白色念珠菌[CMCC (F) 98001]以上菌株均由中国药品生物制品检定所提供。
1.4 仪器:BSC-1300 IA2生物安全柜(苏静泰安空气技术有限公司)、SW-CJ-2FD超净工作台(苏州美迪净化工程有限公司)、LSB35L-I立式压力蒸汽灭菌器(江阴滨江医疗设备有限公司)、RJTDL-40B低速台式大容量离心机(无锡市瑞江仪器分析有限公司)、LRH-250F生物培养箱(上海一恒科技有限公司)、JJ500电子天平(常熟市双杰仪器厂)、直径90 cm培养皿、移液管等。
2 方法与结果[1]
2.1 预试验小结:按阿哌沙班片国家食品药品监督管理局进口标准药品注册标准:JX20120076微生物限度检查法进行试验:其中细菌采用培养基稀释法(每皿0.5 mL),霉菌及酵母菌采用平皿法,控制菌采用常规法。结果显示:枯草芽孢杆菌回收率为0%,有明显抑菌性;白色念珠菌回收率仅为67%,有抑菌性。大肠埃希菌回收率98%,金葡菌回收率93%,黑曲霉回收率89%。控制菌检查试验组和阳性对照组阳性菌生长良好,证明该方法专属性良好。
为消除样品对枯草芽孢杆菌的抑菌,分别采用培养基稀释法(0.2 mL/皿)、薄膜过滤法进行试验,计算枯草芽孢杆菌回收率:
方法1:取1∶10供试液采用离心法联合培养基稀释法(0.2 mL/皿)进行试验,回收率为67%。方法2:取1∶10供试液采用离心法联合薄膜过滤法,冲洗3次,每次100 mL进行试验,回收率为69%。方法3:取1∶10供试液采用离心法联合薄膜过滤法,冲洗5次,每次100 mL进行试验,回收率为88%。
白色念珠菌采用1∶10储备液培养基稀释法(0.2 mL/皿)进行试验,回收率为99%。经试验,采用薄膜过滤法,当冲洗5次,每次100 mL,枯草芽孢杆菌回收率>70%,采用培养基稀释法(0.2 mL/皿),白色念珠菌回收率>70%。
综上所述,阿哌沙班片拟采用下述方法进行细菌、霉菌及酵母菌计数的方法学验证试验及菌落计数。细菌计数:取1∶10供试液采用离心法联合薄膜过滤法,冲洗5次,每次100 mL进行验证;霉菌及酵母菌计数:取1∶10供试品储备液采用培养基稀释法(0.2 mL/皿)进行验证。控制菌采用常规法进行。
2.2 计数方法验证
2.2.1 菌液制备:接种金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌的新鲜培养物至10 mL营养肉汤中,30~35 ℃培养18~24 h,取此培养液1 mL加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-7,使菌数约为50~100 cfu/mL;接种白色念珠菌的新鲜培养物至10 mL改良马丁培养基中,23~28 ℃培养24~48 h,取此培养液1 mL加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-7,使菌数约为50~100 cfu/mL;接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基上,23~28 ℃培养5~7 d,加入3~5 mL含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱。吸出菌液,取1 mL菌液加含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-4~10-6,使菌数约为50~100 cfu/mL。
2.2.2 供试液的制备:取供试品10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,振摇,作为1∶10的供试品储备液。取1∶10的供试品储备液50 mL,500转/分离心3 min,取全部上清液作为1∶10的供试液[2]。
2.2.3 验证方法:按照《中国药典》2010年版二部微生物限度检查法进行计数方法验证,验证试验至少进行3次独立的平行试验,并分别计算各试验菌每次试验的回收率。①菌液组:分别取菌液1 mL,采用平皿计数法,测定上述制备好的菌液中每毫升的活菌数,测定结果见表1。②供试品对照组:细菌计数 取1 mL的1∶10供试液,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,混匀,过滤。用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,冲洗5次,每次100 mL。冲洗后取出滤膜,菌面朝上贴于已凝固好的营养琼脂培养基,置30~35 ℃培养3 d,测定供试品本底的细菌数。测定结果见表1。霉菌和酵母菌计数:取1∶10供试品储备液1 mL,分别注入5个平皿,每皿0.2 mL,立即倾注玫瑰红钠琼脂培养基,待凝固后,置20~25 ℃培养5 d观察结果。测定供试品本底的霉菌和酵母菌数。测定结果见表1。③试验组。细菌计数:取1 mL的1∶10供试液,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,混匀,过滤。用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,冲洗5次,每次100 mL。在最后一次冲洗液中加入上述菌液(50~100 cfu试验菌),冲洗后取出滤膜,菌面朝上贴于已凝固好的营养琼脂培养基,置30~35 ℃培养3 d,观察结果。测定结果见表1,回收率见表1。霉菌和酵母菌计数:取1∶10供试品储备液0.2 mL和上述真菌菌液1 mL(50~100 cfu试验菌),分别注入平皿中,立即倾注玫瑰红钠琼脂培养基,待凝固后,置20~25 ℃培养5 d观察结果。测定结果见表1,回收率见表1。④稀释剂对照组:分别取10 mL上述细菌菌液(500~1000 cfu试验菌),500转/分离心3 min,取上清液作为稀释剂对照液。取稀释剂对照液1 mL,加至100 mL pH7.0无菌氯化钠-蛋白胨缓冲液中,混匀,过滤。用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,冲洗5次,每次100 mL,冲洗后取出滤膜,菌面朝上贴于已凝固好的营养琼脂培养基中,置30~35 ℃培养3 d观察结果。测定结果见表2,回收率见表2。
2.2.4 判定标准:在3次独立的平行试验中,稀释剂对照组的的菌数回收率(稀释剂对照组的平均菌落数占菌液组的平均菌落数的百分率)应均不低于70%;试验组的菌数回收率(试验组的平均菌落数减去供试品对照组的平均菌落数的值占菌液组的平均菌落数的百分率)应均不低于70%。
2.2.5 测定结果:见表1和表2。
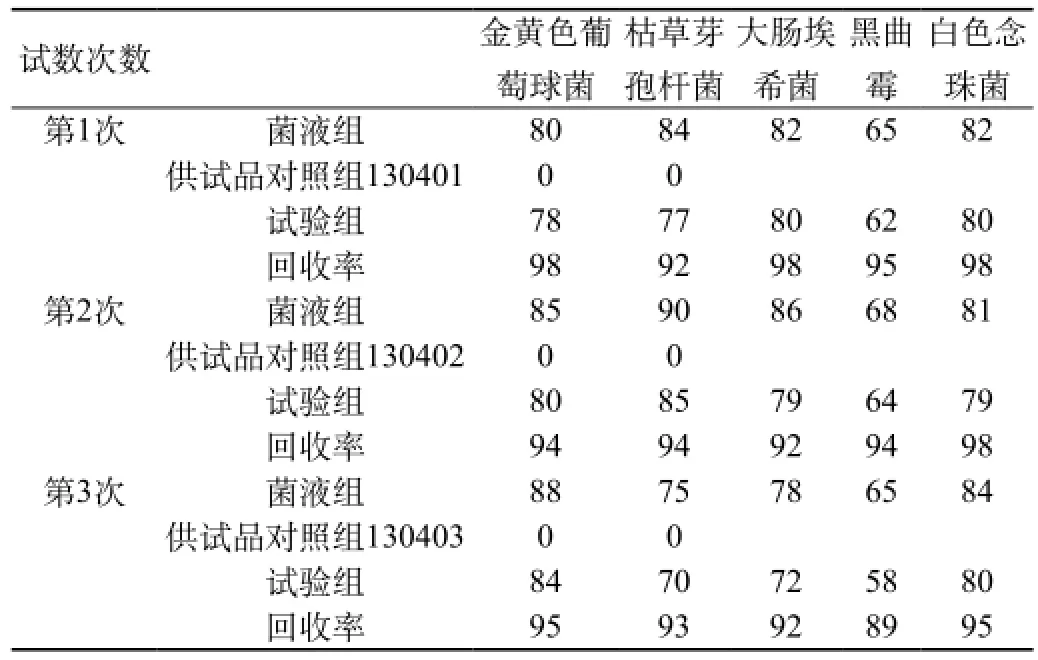
表1 计数方法验证结果
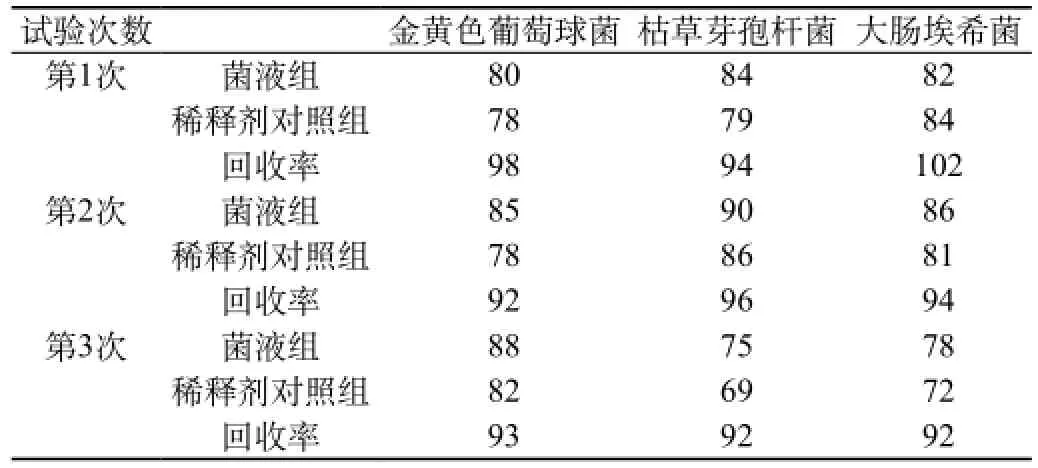
表2 稀释剂对照组回收率测定结果
结论:经上述试验验证,在三次的独立的平行试验中,稀释剂对照组的回收率、试验组的回收率均不低于70%;可采用离心法联合薄膜过滤法进行本品的细菌计数,采用培养基稀释法进行本品的霉菌和酵母菌计数[3]。
2.3 控制菌检查:按照《中国药典》2010年版二部微生物限度检查法进行控制菌的方法学验证试验及检查。
2.3.1 菌液制备:接种大肠埃希菌的新鲜培养物至10 mL营养肉汤中,30~35 ℃培养18~24 h,取此培养液1 mL加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-7,使细菌数约为10~100 cfu/ mL。
2.3.2 供试液的制备:取供试品10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,振摇,作为1∶10的供试品储备液。取1∶10的供试品储备液50 mL,500转/分离心3 min,取全部上清液作为1∶10的供试液。
2.3.3 验证方法:①试验组:取1∶10供试液10 mL,加至胆盐乳糖培养基100 mL中,加入大肠埃希菌10~100 cfu,30~35 ℃培养18~24 h,取上述培养物0.2 mL,加入含5 mL的4-甲基伞形酮葡糖苷酸培养基(MUG)试管中,置30~35 ℃培养于5、24 h观察结果,见表3。②阳性对照组:取大肠埃希菌10~100 cfu,加至胆盐乳糖培养基100 mL中,作阳性菌对照,30~35 ℃培养18~24 h,取上述培养物0.2 mL,加入含5 mL的4-甲基伞形酮葡糖苷酸培养基(MUG)试管中,置30~35 ℃培养于5、24 h观察结果,见表3。③阴性对照组:取10 mL稀释剂,加至胆盐乳糖培养基100 mL中,作阴性对照,30~35 ℃培养18~24 h,取上述培养物0.2 mL,加入含5 mL的4-甲基伞形酮葡糖苷酸培养基(MUG)试管中,置30~35 ℃培养于5、24 h,观察结果,见表3。

表3 控制菌检查结果
表3的结果显示,试验组、阳性对照组阳性菌生长良好,阴性对照组无菌生长,表明该控制菌检查方法的专属性良好。
结论:根据上述验证试验结果,制定本品的微生物限度检查法标准如下:微生物限度,取供试品10 g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,振摇,使呈1∶10的供试品储备液, 取1∶10的供试品储备液50 mL,500转/分离心3 min,取全部上清液作为1∶10的供试液。细菌计数采用薄膜过滤法:取1∶10的供试液1 mL,加至100 mL pH7.0无菌氯化钠-蛋白胨缓冲液中,混匀,过滤。用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,冲洗5次,每次100 mL,冲洗后取出滤膜,依法检查(中国药典2010年版二部附录XIJ)。霉菌和酵母菌计数采用培养基稀释法,取1∶10的供试品储备液1 mL,分别注入5个平皿,每皿0.2 mL,平行制备两份,依法检查(中国药典2010年版二部附录XIJ)。大肠埃希菌检查采用常规法,取1∶10的供试液10 mL加入100 mL胆盐乳糖培养基,依法检查(中国药典2010年版二部附录XIJ)。1g供试品中,细菌数不得过1000个,霉菌和酵母菌数不得过100个,大肠埃希菌不得检出。按照该方法检验供试品符合规定,测定结果见表4。
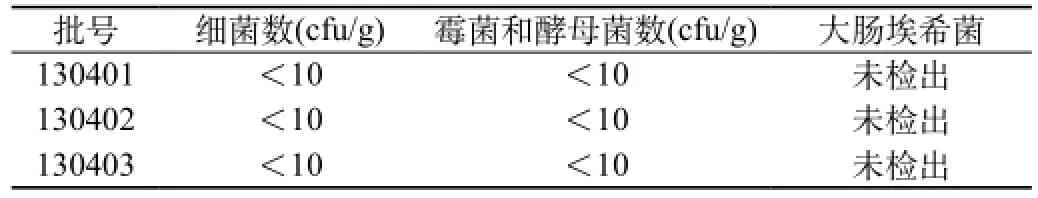
表4 供试品检验结果
3 讨 论
3.1 笔者在建立阿哌沙班片微生物检查方法时发现,相同品种制剂,由于原辅料来源差异、工艺差异,会造成微生物检查方法的不适用。为保证的产品质量和临床用要安全,必须建立适合的方法。同时,笔者认为,当发生变更时,如原料变更、产品的组份、原检验条件发生改变,宜必须重新进行验证,以保证方法的准确性和可靠性。
3.2 阿哌沙班片微生物检查计数方法验证,在3次独立的平行试验中,稀释剂对照组的回收率、试验组的回收率均不低于70%;可采用离心法(500转/分钟离心3 min)联合薄膜过滤法(pH7.0无菌氯化钠-蛋白胨缓冲液冲洗5次,每次100 mL)进行本品的细菌计数,采用培养基稀释法(每皿0.2 mL)进行本品的霉菌和酵母菌计数。
3.3 对于建立药品微生物检查方法,笔者曾做过许多品种验证,尤其对于有抑菌性制剂,消除产品抑菌性、建立准确、可靠的检查方法,笔者认为预实验是非常必要的。预实验能初步证明产品对某一种或某几种菌的抑制,然后,有真对性的进行试验设计和正确试验,即可以节省时间,又可以针对性的解决问题。同时,对于薄膜过滤法消除抑菌性,笔者认为同时可考察不同厂家的滤膜,如颇尔、赛多利斯:以及不同材质的滤膜,如混合纤维性滤膜、改良亲水性聚醚砜滤膜的。
[1] 王磊,钟静芬.口服Xa因子直接抑制剂阿哌沙班的临床研究进展[J].上海医药,2012,33(17):17-20.
[2] 国家药典委员会会编.《中国药典》二部附录[S].北京:中国医药科技出版社,2010:107-116.
[3] 中国药品生物制品检定所.《中国药品标准操作规程》[M].北京:中国医药科技出版社,2010:351-407.
R37
B
1671-8194(2014)34-0063-03
