含利塞膦酸骨水泥对SD大鼠成骨细胞OPG、RANKL和OC表达的影响
2014-06-04张玉彪柳云恩巩天星赵显威高燕侯明晓
张玉彪,柳云恩,巩天星,赵显威,高燕,侯明晓
(1.沈阳军区总医院急诊医学部,沈阳 110016;2.全军重症(战)创伤救治中心实验室和辽宁省重症创伤和器官保护重点实验室,沈阳 110016;3.东北大学生命科学与健康学院,沈阳 110004;4.朝阳市喀左县水泉乡人民政府,朝阳 122000)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,在体内和体外特定的诱导条件下可分化成骨、软骨、脂肪、肌肉、神经、肌腱及韧带等组织。MSCs取材方便,可在体外大量扩增,与颗粒骨和磷酸钙骨水泥的复合物联合培养可作为人工骨移植物。1970年骨水泥开始应用于临床[1],各种骨水泥应运而生,目前,丙烯酸类树脂骨水泥和磷酸钙骨水泥是临床填补骨缺损的主要材料[2,3]。磷硅酸钙水门汀作为一种填充骨缺损的新型材料正处于临床前阶段[4,5],尚未应用于临床手术中。磷硅酸钙水门汀(见图1)具有良好的生物降解能力和延展性,具有临床手术所使用的骨水泥的理化性质,在一定程度下随着利塞膦酸(RA)含量的升高对骨具有促进愈合作用,将一定含量的磷酸二氢钙(MCP)添加到含利塞膦酸的骨水泥中,能够增加骨水泥的强度和凝固速度[6,7]。
本实验所研究的骨水泥材料为纳米级,通过含利塞膦酸的磷硅酸钙水门汀的PBS浸提液对SD大鼠成骨细胞共同培养,然后提取细胞RNA进行荧光定量PCR试验,研究OPG、RANKL和OC3个基因的相对表达量,进而对所研究的骨水泥进行分析评价,并阐述3个基因的相互关系,现报道如下。

图1 磷硅酸钙骨水泥显微结构
图2 成骨细胞生长3d图片(×10)
1 材料与方法
1.1 材料
1.1.1 实验动物 新生48h内SD大鼠胎鼠,由沈阳军区总医院动物实验科提供。
1.1.2 试剂和仪器 试剂:0.25%胰蛋白酶(美国Hyclone公司),Ⅱ型胶原酶(美国sigma公司),胎牛血清(美国Hyclone公司),DMEM(美国Hyclone公司),TRIZOL(美国Cibco公司),反转录试剂盒(日本TARAKA公司),PCR扩增试剂盒(日本TARAKA公司),RealMasterMix(SYBR Green)试剂盒(北京天根公司)。仪器:PCR扩增仪(美国Bio-Rad公司),核酸蛋白分析仪(美国 Thermo Scientific公司),荧光定量PCR仪(美国Bio-Rad公司),振荡培养箱(美国Thermo Scientific公司),水平电泳槽(美国Bio-Rad公司),凝胶成像分析系统(美国Bio-Rad公司),恒温金属浴(杭州博日科技有限公司),超速高速冷冻离心机(美国Beckman Coulter公司)。
1.1.3 引物合成 OC上游引物F:TGCAAAGCC CAGCGACTCT下游引物 R:AGTCCATTGT TGAGGTAGCG扩增产物为98bp;OPG上游引物F:CGTCACCCACAGTCTGAGGAA下游引物R:TCAACTGCCATTTCAAGAGCC扩增产物为216 bp;β-actin上游引物 F:GAACCCTAAGGCCAAC CGTG下游引物R:AGGCATACAGGGACAAC ACAGC扩增产物为104bp;RANKL上游引物F:CCGTGCAAAGGGAATTACAAC下游引物R:GATGGTGAGGTGAGCAAACG扩增产物为134 bp,引物由上海生物工程有限公司合成。
1.2 方法
1.2.1 成骨细胞分离 用SD大鼠胎鼠提取成骨细胞;无菌取下胎鼠颅骨放入无菌PBS中浸泡并剔去骨膜等物质,将颅骨剪成泥状转移到15mL离心管中,加入5mL 0.25%胰蛋白酶,放入37℃5%CO2的培养箱中孵育45min,1 000r/min离心5 min,弃去上清液加入Ⅱ型胶原酶5mL,再放入37℃5%CO2的培养箱中孵育30min,1 000r/min离心5min,弃上清液收获细胞,将细胞用10%胎牛血清的DMEM培养基培养,每2d换液一次,待细胞传代至第3代时(见图2),进行细胞鉴定,经鉴定为成骨细胞,纯度适合本实验[2]。
1.2.2 骨水泥浸提液的制备 骨水泥使用前160℃高温干热灭菌6h,制作1%RA骨水泥模型和15%MCP+0.5%RA骨水泥模型,并以PBS为浸提液的介质分别浸泡7d。
1.2.3 细胞总RNA的提取 将细胞培养传代至第3代,将细胞培养基以7∶1的浓度比与15%MCP+0.5%RA骨水泥和1%RA骨水泥浸提液混合作为细胞培养基,置于6孔板中培养,每组6个平行,培养3d,待6孔板培养细胞汇合度为90%~100%时,提取细胞总RNA。将细胞用无菌PBS洗3次,加入1mLTRIZOL,适当摇动培养皿,将液体吸至1.5mL离心管中室温静置3~5min,然后加入0.2mL氯仿轻轻振摇15s,室温静置2~3min后4℃12 000rpm/min离心15min,取上清无色水相(0.5~0.6mL)吸到EP管中(DEPC处理过)加入0.5mL异丙醇,室温下静置10min。4℃12 000rpm/min离心10min,观察总RNA在管底的白色沉淀,弃去上清液,加入75%的乙醇1mL洗涤(DEPC水新配制),4℃7 500rpm/min离心5 min,重复该操作2次。弃上清液用小Tip吸干液体,空气中金属浴55~60℃干燥沉淀5~10min,加入20~30uL DEPC处理水,用枪吹打均匀溶解总RNA。将上述得到的RNA在核酸蛋白分析仪上检测260/280的OD值。将所提的RNA反转录成cDNA。
1.2.4 样品OPG、RANKL、OC 和β-actin的荧光定量测定 引物序列由上海生工生物试剂有限公司合成,用荧光定量PCR仪进行RT-PCR反映。RTPCR扩增条件:95℃预变性5min,94℃变性10s,58℃退火10s,45个循环,每个循环72℃退火10 s,结束时采集荧光;反应完成后从55~95℃缓慢升温,每个循环上升0.5℃,整个过程进行连续采集荧光,产生融解曲线,每组5个平行。以β-actin为内参基因,通过双标准曲线法对含1%RA的磷硅酸钙骨水泥浸提液和15%MCP+0.5%RA的骨水泥浸提液进行相对表达量的测定,按照构建标准曲线的反应体系及反应条件进行。试验结果以目的基因OPG、RANKL、OC和β-actin拷贝数的比值为目的基因mRNA的相对表达量。为分析不同分离株OPG、RANKL和OC基因表达量的差异,不加浸提液的成骨细胞为阴性,根据公式计算一个目的基因转录水平在不同cDNA样品中相差的倍数。
1.3 统计学方法
运用SPSS 18.0统计学软件进行数据分析,计量数据以均数±标准差(±s)表示,1%RA骨水泥和含15%MCP+0.5%RA骨水泥与对照组组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RNA质量检测
用核酸蛋白分析仪检测提取总RNA的260/280的OD值和RNA浓度,OD值均为1.8~2.0之间,证明所提取的RNA纯度较高,满足试验要求,可以进行试验,对RNA浓度进行定量,浓度均调整为80ng/uL。
2.2 OPG、RANKL和OC表达分析
15%MCP+0.5%RA骨水泥浸提液和1%RA的骨水泥浸提液与空白对照组OPG、RANKL和OC基因的mRNA相对表达量的差异(见表1)。含1%RA的磷硅酸钙骨水泥浸提液具有促进OPG、OC2个基因表达的作用,降低RANKL表达的作用(见图3)。含0.5%RA和15%MCP的磷硅酸钙骨水泥浸提液对OPG、OC2个基因具有促进表达的作用,对RANKL的表达作用不明显(见图4)。含有15%MCP的0.5%RA的骨水泥对成骨细胞OPG和OC的促进表达作用强于1%RA骨水泥,MCP能加速骨水泥的凝固,在浸提液制作过程中骨水泥颗粒不易浸出,含有RA的骨水泥药物释放过程中,骨水泥颗粒会浸出,由于本实验骨水泥材料为纳米级,可能会影响细胞的生长。
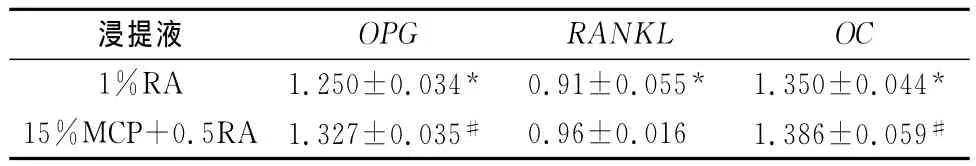
表1 骨水泥浸提液与空白对照组成骨细胞中OPG、RANKL和OC基因的差异表达
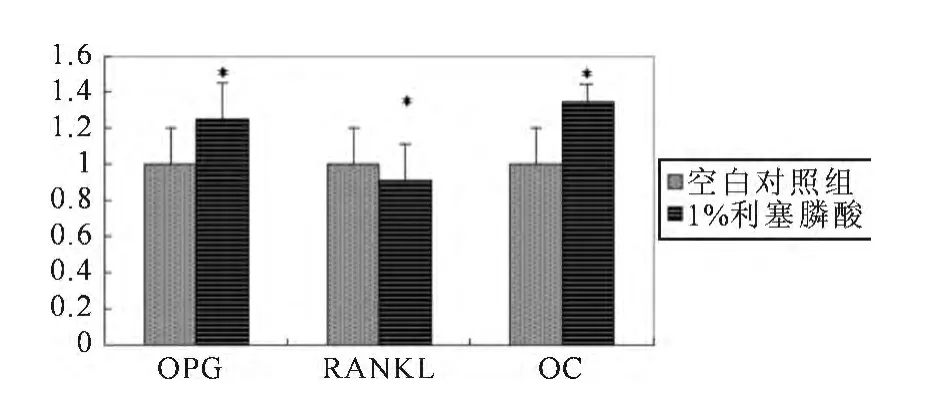
图3 1%RA骨水泥浸提液成骨细胞OPG、RANKL和OC基因mRNA差异表达
3 讨论
在调节破骨细胞分化、活化的多种细胞因子中,OPG通过阻断RANKL的功能,抑制破骨细胞的分化及活化,诱导破骨细胞凋亡。RANKL的前体是RANK,RANKL被认为是介导破骨细胞分化和活化的关键因子,它能刺激破骨细胞的分化、活化,抑制破骨细胞凋亡,与OPG形成2个对立竞争的因子,破骨细胞的成熟及功能状态可通过OPG与RANKL 的比值决定[8]。
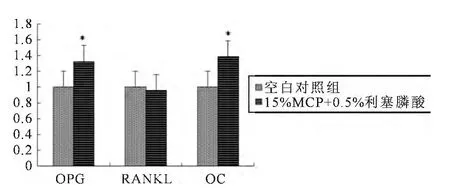
图4 15%MCP+0.5%RA骨水泥浸提液成骨细胞OPG、RANKL和OC基因的mRNA差异表达
OC 属于 γ-羧谷氨酸包含蛋白类(GLA proteins),是维生素K依赖性蛋白类,在骨矿化峰期之后该蛋白开始积聚,使用维生素K拮抗剂能够使此蛋白在骨中的含量减少,对其脯氨酸的含量不产生影响,对骨的机械强度也不产生影响。根据骨钙素的变化情况鉴别骨质疏松的转换类型:老年性骨质中骨钙素升高不明显属于低转换型;绝经后骨质中骨钙素水平明显升高属于高转换型[9]。对骨中OC表达进行分析,可判定骨中含钙量的高低,进而对骨质疏松的类型进行判断,在研究中具有非常重要的意义[10]。
本试验采用相对定量的方法,参比β-actin制备标准曲线,选用1%RA的骨水泥和含15%MCP+0.5%RA的骨水泥DMEM培养基浸提液,浸提液与正常的DMEM培养基的比例为1∶7作为培养细胞的培养基,由于此比例对细胞具有弱毒性,培养3d后提取剩余60%~70%左右细胞的总RNA;以这2个浓度含药量作为研究OPG、RANKL和OC的培养基,通过目的基因转录水平在不同cDNA样品中相差的倍数,证实磷硅酸钙骨水泥浸提液具有促进OPG、OC2个基因表达的作用;RA骨水泥具有降低RANKL表达的作用,添加MCP的RA对RNAKL表达作用不明显;OPG和OC2个基因对成骨细胞的增值具有促进作用,增加骨钙含量促进骨愈合。RANKL为破骨细胞标志性因子,骨水泥浸提液对破骨细胞生成具有抑制作用,说明RA对成骨细胞具有诱导分化作用[11,12]。
本实验通过分子水平进行添加不同药物的磷硅酸盐骨水泥相关基因表达量的分析,阐述所研究材料在基因方面对成骨细胞增殖分化的相关性,含RA的磷硅酸钙骨水泥可促进成骨细胞形成分化,抑制破骨细胞生长,对成骨细胞分化生长和骨愈合具有一定的促进作用,为临床应用提供了一定的实验数据。
[1]Benum P.The use of bone cement as an adjunct to internal fixation of supracondylar fractures of osteoporotic femurs[J].Acta Orthop Scand,1977,48(1):52-56.
[2]Uriarte SA,Fernández-Nieto M,Sastre J.Occupational asthma due to polyvinyl chloride and methyl methacrylate in a plumber[J].J Investig Allergol Clin Immuno,2013,23(6):437-438.
[3]Sariibrahimoglu K,An J,van Oirschot B,et al.Tuning the degradation rate of calcium phosphate cements by incorporating mixtures of polylactic-co-glycolic acid microspheres and glucono-delta-lactone microparticles[J].Tissue Eng Part A,2014,12:223-229.
[4]张玉彪,柳云恩,侯明晓,等.含利塞鳞酸的磷硅酸钙水门汀对成骨细胞增殖和劝能的影响[J].成都医学院学报,2013,8(3):226-229.
[5]张玉彪.硅酸盐骨水泥对SD大鼠成骨细胞毒性的研究[D].沈阳:沈阳农业大学,2013.
[6]Gong T,Wang Z,Zhang Y,et al.Preparation characterization release kinetics and in vitro cytotoxicity of calcium silicate cement as a risedronate delivery system[J].J Biomed Mater Res,2014,102(7):2295-2304.
[7]David A,Lober D.In vitro cytotoxicity of orthodontic archwires in cortical cell cultures[J].Eur J Orthod,2004,26(4):421-436.
[8]Chen K,Zhang N,Ding L,et al.Early intra-articular injection of alendronate reduces cartilage changes and subchondral bone loss in rat temporomandibular joints after ovariectomy[J].Int J Oral Maxillofac Surg,2014,Pii:142-148.
[9]Araújo AA,Varela H,Brito GA,et al.Azilsartan Increases Levels of IL-10,Down-Regulates MMP-2,MMP-9,RANKL/RANK,Cathepsin K and Up-Regulates OPG in an Experimental Periodontitis Model[J].PLoS One,2014,9(5):e96750.
[10]简炼.锶盐对模拟失重大鼠骨组织细胞凋亡的防治效应[D].广州:南方医科大学,2011.
[11]Fletcher HM,Bennett F,Simms-Stewart D,et al.Bone Mineral Density in Jamaican Black Women after Hysterectomy and Bilateral Oophorectomy:An Observational Study[J].West Indian Med J,2013,62(7):593-598.
[12]Fujimura T, Kambayashi Y, Furudate S,et al.Immunomodulatory effect of bisphosphonate risedronate sodium on CD163arginase M2macrophages:the development of a possible supportive therapy for angiosarcoma[J].Clin Dev Immunol,2013,2013:325412.
