依达拉奉对谷氨酸所致神经干细胞损害的保护作用
2014-06-01邹良玉褚晓凡付学军
卢 艺* 邹良玉 褚晓凡 张 莹 付学军
(暨南大学第二临床学院深圳市人民医院,广东 深圳 518020)
依达拉奉对谷氨酸所致神经干细胞损害的保护作用
卢 艺* 邹良玉 褚晓凡 张 莹 付学军
(暨南大学第二临床学院深圳市人民医院,广东 深圳 518020)
目的 探讨依达拉奉对谷氨酸所致神经干细胞损害的保护作用及机制。方法 取大鼠13.5 d胚胎皮质,提取神经干细胞,分为谷氨酸处理组(500 μmol/L)、依达拉奉干预组(500 μmol/L谷氨酸+500 ng/mL依达拉奉)和正常对照组。谷氨酸及依达拉奉处理24 h后,应用光学显微镜高倍下观察各组细胞的形态和数量;并对各组细胞作DAPI及TUNEL染色,计数阳性细胞。结果 与正常对照组比较,谷氨酸处理组细胞的数量减少(P<0.05);依达拉奉组细胞的数量较谷氨酸组明显增多(P<0.05)。谷氨酸处理组的TUNEL阳性细胞明显多于正常对照组(P<0.05),依达拉奉组的TUNEL阳性细胞明显少于谷氨酸组(P<0.05)。结论 依达拉奉通过拮抗谷氨酸诱导的细胞凋亡对谷氨酸所致的神经干细胞损害起到保护作用。
神经干细胞;凋亡;依达拉奉
中枢神经系统发生缺血、缺氧引发神经细胞死亡,由此释放的谷氨酸会导致谷氨酸受体大量激活,钙离子通过激活的谷氨酸受体大量流入细胞内,导致氧化应激反应的发生,其可导致更多的神经细胞损害[1]。依达拉奉是有效的自由基清除剂,大量的临床研究证实其可以改善急性缺血性脑卒中的神经损害症状以及恢复期的日常生活能力。其作用机制主要为抑制脂质过氧化反应、减轻脑内花生四烯酸引起的水肿[1,2]。但依达拉奉能否通过抑制兴奋性神经递质,如谷氨酸的神经损害目前尚无报道。本研究观察依达拉奉对谷氨酸损害的神经干细胞的抗凋亡作用,以探讨依达拉奉神经保护作用的多靶点机制。
1 材料与方法
1.1 材料
孕13.5 d的SD大鼠2只(广东省实验动物监测所提供)。DMEM培养液(Gibco公司),N2、B27(Sigma公司),BFGF(Sigma公司),6孔、24孔细胞培养板(Costar公司),TUNEL染色试剂盒(Roche公司),Nestin抗体(碧云天)。
1.2 方法
1.2.1 细胞培养与分组
将2只孕13.5 d的SD大鼠吸入二氧化碳麻醉处死后,75 %酒精消毒腹部皮肤,取出12只胚胎,将胚胎置于DMEM溶液中,显微镜下取出胚胎皮层,置于15 mL离心管中,经过反复的抽吸,得到悬浮的单细胞,将其种植于细胞培养板。培养条件为37 ℃、5 % CO2和95 %空气、饱和湿度,用含B2、N27、BFGF(Basic Fibroblast Growth Factor碱性成纤维细胞生长因子)的DMEM人工培养基培养,当细胞汇集接近满瓶时,用0.05 %胰蛋白酶消化,离心,收集细胞。细胞鉴定,用神经细胞特异免疫荧光染色检测法测神经干细胞特异性蛋白——巢蛋白(Nestin蛋白)。Nestin蛋白是第6类中间丝骨架蛋白,定位于干细胞的细胞质,已被广泛用作神经干细胞的标志物。在培养基中,NSCs(神经干细胞)呈球团状悬浮生长,神经上皮干细胞巢蛋白表达阳性[3,4]。证实所培养细胞中神经干细胞占95 %以上后继续实验。将细胞均匀接种于6孔培养板和24孔培养板,分为谷氨酸处理组、依达拉奉干预组和正常对照组,每个实验组6个复孔。
1.2.2 细胞模型建立与处理
谷氨酸处理组和依达拉奉干预组的细胞培养液中加入谷氨酸(终浓度为500 μmol/L),诱导神经干细胞损伤[5]。同时在依达拉奉干预组的细胞培养液中加入依达拉奉(浓度为500 ng/mL)。正常对照组的细胞培养液中加入等量的生理盐水。
1.2.3 细胞形态、数量观察
各组细胞药物处理后培养24 h,用光学显微镜(奥林巴斯)高倍镜下进行拍照,观察5个视野,观察细胞的形态和数量。
1.2.4 DAPI染色与TUNEL染色
各组细胞药物处理后培养24 h,对各组细胞进行DAPI与TUNEL杂色。在荧光显微镜下观察,观察5个视野,计数高倍视野下DAPI与TUNEL染色阳性的细胞数。
1.2.5 统计学方法
采用SPSS 13.0统计软件进行统计学处理,检测结果以均数±标准差()表示,组间比较采用方差分析及ANOVA检验。
2 结 果
2.1 谷氨酸处理组、依达拉奉干预组及正常对照组神经干细胞形态及数量比较
结果显示:谷氨酸组的细胞数量较正常对照组减少。依达拉奉组的细胞数量较谷氨酸组增多(图1、表1)。

图1 谷氨酸处理组、依达拉奉干预组及正常对照组神经干细胞形态及数量比较。①、③、⑤为10倍镜下所见;②、④、⑥为40倍镜下所见

表1 谷氨酸处理组、依达拉奉干预组及正常对照组神经干细胞形数量比较
2.2 谷氨酸处理组、依达拉奉干预组及正常对照组TUNEL阳性细胞比较
DAPI与TUNEL染色分别用于标记活细胞和凋亡细胞。结果显示:正常对照组出现少量TUNEL阳性细胞;与正常对照组比较,谷氨酸处理组TUNEL阳性细胞明显增多(P<0.05);与谷氨酸处理组比较,依达拉奉组的TUNEL阳性细胞明显少于谷氨酸组(P<0.05)。见图2、表2。
3 讨 论
本实验使用的DAPI(4',6-二脒基-2-苯基吲哚)是一种能够与DNA强力结合的荧光染料。当DAPI可以透过完整的细胞膜与双股DNA结合时,荧光显微镜观测蓝色至青绿色,示活细胞。TUNEL(原位末端转移酶标记技术)基因组DNA断裂时,暴露的3'-OH可以在TdT(Terminal Deoxynucleotidyl Transferase,末端脱氧核苷酸转移酶)的催化下加上荧光素(FITC)标记的dUTP。荧光显微镜观测呈黄绿色,示细胞凋亡。
本研究发现:兴奋性氨基酸谷氨酸对于神经干细胞有显著的损伤作用,其损伤作用可能通过诱导细胞凋亡产生,依达拉奉通过抑制谷氨酸诱导的凋亡过程达到保护神经干细胞的作用。
脑缺血后细胞死亡是一个多通道的过程,兴奋性氨基酸的过度活跃对于脑缺血后的细胞损伤有明显的放大作用。中枢神经系统发生缺血引发神经细胞死亡,由此释放的谷氨酸会导致谷氨酸受体大量激活,钙离子通过激活的谷氨酸受体大量流入细胞内,导致氧化应激反应的发生,其可导致更多的神经细胞损害[1]。但依达拉奉能否通过抑制兴奋性神经递质,如谷氨酸的神经损害目前尚无报道。研究发现在急性脑梗死发生后,大量的神经干细胞在脑室下区出现,这些神经干细胞的出现对于神经修复意义重大[6-9]。但由于谷氨酸等兴奋性氨基酸的过量释放,导致大量神经干细胞死亡,影响了脑组织的自然修复[5]。本研究证实了谷氨酸对于神经干细胞的细胞毒性。除此之外,本研究发现谷氨酸对于神经干细胞的细胞毒性源于谷氨酸对于神经干细胞凋亡过程的诱导作用。

图2 谷氨酸处理组、依达拉奉干预组及正常对照组TUNEL阳性细胞比较(DAPI染色用于标记活细胞,在荧光显微镜镜下显示蓝色至青绿色;TUNEL——原位末端转移酶标记技术,用于标记凋亡细胞,在荧光显微镜镜下显示黄绿色。图①~⑨均为40倍镜下所见)
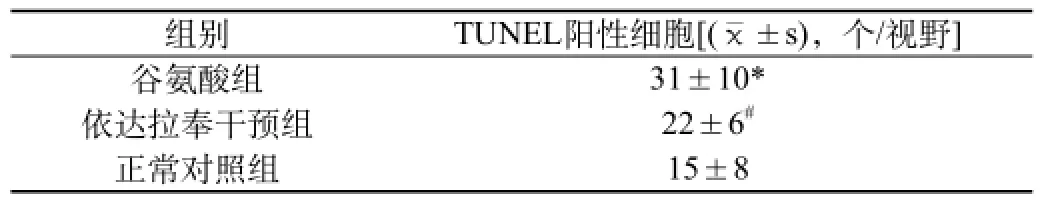
表2 谷氨酸处理组、依达拉奉干预组及正常对照组TUNEL阳性细胞比较
依达拉奉是目前临床试验证明唯一有效的自由基清除剂。对于急性脑梗死,其通过捕获自由基,抑制脑细胞(神经细胞,血管内皮细胞)的过氧化作用[10,11],从而达到减轻脑水肿和脑组织损伤的作用。由于其独特的清除自由基和减轻缺血再灌注的作用机制[12],适应证还扩大到心肌、肾脏和肺缺血再灌注,肝脏、肠缺血等。本课题组之前的研究[13]显示,对谷氨酸作用损伤的神经干细胞,依达拉奉可以抑制其caspase-3的表达,并减少细胞的受损的数量,但是否可以减少凋亡细胞的数量尚未明确。在这个研究基础上,本研究探讨依达拉奉保护神经干细胞的机制,以TUNEL染色作为确定凋亡细胞数量的标准。研究发现,谷氨酸组的神经干细胞数量减少细胞受到明显损害。而依达拉奉干预组的细胞数量较谷氨酸组显著增加,细胞损害较轻。TUNEL染色示依达拉奉干预组的凋亡细胞数量较谷氨酸组明显减少。表明依达拉奉干预可以减轻谷氨酸氧化应激反应导致的神经干细胞损伤,降低神经干细胞的凋亡。结合之前的实验结果,依达拉奉干预可抑制caspase-3的表达,阻断细胞凋亡的信号转导通路,减少细胞的凋亡,而起到神经保护的作用。
[1] Yamawaki M,Sasaki N,Shimoyama M,et al.Protective effect of edaravone against hypoxia - reoxygenation injury in rabbit cardiomyocytes[J].Br J Pharmacol,2004,142(3): 618.
[2] Ito K,Ozasa H,Horikawa S.Edaravone protects against lung injury induced by intestinal ischemia-reperfusion in rat[J].Free Radic Biol Med,2005,38(3): 369-374.
[3] Lendahl U,Zimmerman LB,mckkay RD.CNS stem cells express anew class of intermediate filament protein[J].Cell,1990,60(4):585-595.
[4] 潘良春,尹宗生,王伟,等.胚胎和新生大鼠神经干细胞培养与分化的特性比较[J].中国临床康复,2006,10(5):25-27.
[5] 崔俐,张巨,林卫红,等.谷氨酸对体外培养胎鼠神经干细胞的损伤作用[J].吉林大学学报,2009,35(3):451-455.
[6] Jin K,Sun Y,Xie L,et al.Directed migration of neuronal precursors into the ischemic cerebral cortex and striatum[J].Mol Cell Neurosci, 2003,24(1): 171-189.
[7] Zhang RL,Zhang ZG,Zhang L,et al.Proliferation and differentiation of progenitor cells in the cortex and the subventricular zone in the adult rat after focal cerebral ischemia[J].Neurosci,2001,105(1):33.
[8] Li Y,Chen J,Chopp M.Cell proliferat ion and differentiation from ependymal,subependymal and choroid plexus cells in response to stroke in rats[J].J Neurol Sci,2002,193(2): 137-146.
[9] Takasawa K,Kit agawa K,Yagita Y,et al.Increased proliferation of neural progenitor cells but reduced survival of new born cells in the contralateral hippocampus after focal cerebral ischemia in rat s [J].J Cereb Blood Flow Metab,2002,22(3): 299-307.
[10] Yamamoto T,Yuki S,Watanabe T,et al.Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia[J].Brain Res,1997,762(12):240.
[11] Mizuno A,Umemura K,Nakashima M.Inhibitory effect of MCI-186,a free radical scavenger,on cerebral ischemia following rat middle cerebral artery occlusion[J].Gen Pharmacol,1998,30(4):575.
[12] Doi K,Suzuki Y,Nakao A,et al.Radical scavenger edaravone developed for clinical use ameliorates ischemia / reperfusion injury in rat kidney[J].Kindey Int,2004,65(6):1714.
[13] 卢艺,张莹,褚晓凡,等.依达拉奉抗谷氨酸诱导神经干细胞凋亡作用的实验研究[J].海南医学杂志,2011,22(2):23.
Protective Effects of Edaravone on Neural Stem Cells Injury Induced by Glutamate
LU Yi, ZOU Liang-yu, CHU Xiao-fan, ZHANG Ying, FU Xue-jun
(Shenzhen People's Hospital of Second Clinical College of Jinan University, Shenzhen 518020, China)
Objective To investigate the protective effects of Edaravone on neural stem cells (NSCs) injury induced by Glutamate. Methods NSCs were cultured from 13.5 d SD rat embryo, and divided into 3 groups: Glutamate group (500 μmol/L), Edaravone group (500 μmol/L glutamate +500 ng/mL edaravone ) and control group. 24 h after treatment, number of NSCs were observed under an optical microscope. TUNEL staining positive cells were counted under fluorescence microscope. Results Compared with the control group, NSCs in the glutamate groups damaged severely and the NSCs number was significantly lower (P<0.05);while in edaravone group, NSCs in the glutamate groups damaged wildly and the NSCs number was significantly higher than that in the glutamate group (P<0.05). Compared with the control group, the number of TUNEL staining positive cell in the glutamate groups was significantly higher (P<0.05);while in edaravone group, the number of TUNEL staining positive cell was significantly lower than that in the glutamate group (P<0.05). Conclusion Edaravone has a protective effect against injury induced by Glutamate on NSCs via inhibition of the apoptosis process.
Neural stem cells; Apoptosis; Edaravone
R971
:B
:1671-8194(2014)04-0018-03
*通讯作者:E-mail:1049328794@qq.com
