鸭肠炎病毒囊膜糖蛋白gE基因序列分析及真核表达载体的构建
2014-05-29文晶亮李启红李俊平杨承槐李慧姣夏业才
文晶亮,李启红,李俊平,刘 丹,李 岭,杨承槐,李慧姣,夏业才
(中国兽医药品监察所,北京100081)
gE蛋白是疱疹病毒家族中较为重要的糖蛋白之一,由位于US区的US8基因编码。据报道疱疹病毒gE基因是疱疹病毒从视网膜、嗅觉上皮细胞、三叉神经节侵入中枢神经组织所必须的毒力基因,对疱疹病毒在体内毒力表达、侵袭神经核沿着神经传递起着决定性的作用,另外还能促进病毒在细胞之间扩散[1-4]。 目前对人疱疹病毒、伪狂犬病毒、牛疱疹病毒等疱疹病毒糖蛋白gE基因及其编码蛋白已有大量研究[5-7],而对鸭瘟病毒 gE基因及其编码蛋白尚未有深入的报道。因此,本研究PCR扩增了DEV的gE基因完整开放阅读框(gE)和去信号肽的gE基因(gE’),分别克隆至真核表达载体pCDNA3.1,转染 vero细胞,并应用 RT-PCR 和间接免疫荧光检测gE、gE’蛋白在vero细胞中的转录、表达,旨在探讨gE蛋白在真核细胞中的表达,为gE蛋白的功能研究、鸭瘟抗体检测奠定基础,为深入了解鸭瘟病毒感染的发病机理提供科学数据。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 鸭肠炎病毒AV1221株,由中国兽医药品监察所菌种保藏中心提供;vero细胞,由本实验室保存;E.coli DH5α感受态细胞,购于天根生化科技有限公司。
1.1.2 主要试剂 真核表达载体 pCDNA3.1,由本实验室保存;pMD18-T载体、Ex Taq DNA聚合酶、dNTPs、EcoRⅠ、XhoⅠ、MarkerⅣ、T4 DNA 连接酶,均购自大连宝生物工程有限公司;Lipofectamine 2000,购自 Invitrogen 公司;OPTI-MEM®I培养液,购自gibco®公司;FITC标记的兔抗鸡荧光二抗,购自美国sigma-aldrich公司;DMEM高糖细胞培养液、TBD标准胎牛血清购于赛墨飞世尔生物化学制品有限公司。
1.1.3 试剂盒 高纯度质粒小提中量试剂盒、琼脂糖凝胶DNA回收试剂盒购于天根生化科技有限公司。
1.1.4 血清 鸡抗DEV阳性血清,由本实验室制备;TBD标准胎牛血清,购于赛墨飞世尔生物化学制品有限公司。
1.2 方法
1.2.1 引物设计与合成 根据已发表的基因组序列,设计扩增鸭肠炎病毒AV1221株的gE基因完整ORF序列(gE)和去信号肽的gE基因(gE’)引物,由invitrogen公司合成。
针对gE的引物:
P1: 5’ -AAGAATTC ATGATGGTTACTTTTAT-3’,下划线部分为酶切位点EcoR I;
P2:5’-AACTCGAGTCAGATGCGGAAACTAGA-3’,下划线部分为酶切位点Xho I;
针对gE’的引物:
P11: 5’-AAGAATTCGACTATCATCAAGTGATT-3’,下划线部分为酶切位点EcoR I;
P22: 5’-AACTCGAGTCAGATGCGGAAACTAGA-3’,下划线部分为酶切位点Xho I;
1.2.2 DNA 模板提取 按参考文献[8]进行。
1.2.3 gE基因的克隆 PCR反应体系:病毒DNA 2 μL,dNTPs 2 μL,上游引物 P11 μL,下游引物 P21 μL,10×Ex Taq buffer 2.5 μL,Ex Taq DNA 聚合酶0.125 μL,ddH2O 16.375 μL,总体积 25 μL。
反应条件:94℃预变性3 min,94℃变性40 s,46.2 ℃退火 40 s,72 ℃ 延伸 1 min 30 s,30 个循环后,72℃延伸10 min。反应结束后,取3 μL PCR产物进行0.8%琼脂糖凝胶电泳鉴定。
1.2.4 去信号肽 gE 基因(gE’)序列的克隆 PCR
反应体系:病毒 DNA 2 μL,dNTPs 2 μL,上游引物P111 μL,下游引物 P221 μL,10 ×Ex Taq buffer 2.5 μL,Ex Taq DNA 聚 合 酶 0.125 μL, ddH2O 16.375 μL,总体积 25 μL。
反应条件:94℃预变性3 min,94℃变性40 s,47℃退火1 min,72℃延伸1 min 30 s,30个循环后,72℃延伸10 min。 反应结束后,取3 μL PCR产物进行0.8%琼脂糖凝胶电泳鉴定。
1.2.5 gE基因测序及序列分析 PCR产物用胶回收试剂盒回收后,分别连接到pMD18-T载体,转化DH5α,获得重组质粒 pMD18T-gE、pMD18T- gE’。将酶切及PCR鉴定正确的重组质粒pMD18T-gE、pMD18T-gE’送Invitrogen公司测序,并用生物信息学软件对测序正确的gE基因进行分析,预测gE基因编码蛋白的功能。
1.2.6 真核表达载体的构建 gE基因测序正确后,用限制性内切酶EcoRⅠ和XhoⅠ分别双酶切克隆质粒 pMD18-gE、pMD18-gE’和载体 pCDNA3.1。回收、纯化双酶切gE、gE’基因和pCDNA3.1线性质粒,并用T4 DNA连接酶使双酶切gE、gE’基因分别与 pCDNA3.1线性质粒连接,转化 E.coli DH5α 感受态细胞,挑取阳性克隆,提取质粒pCDNA3.1-gE、pCDNA3.1-gE’,进行酶切及 PCR 鉴定。
1.2.7 重组表达质粒转染vero细胞 在转染前20 h,消化vero细胞,转入6孔细胞板,每孔6×105个细胞,待细胞铺板密度在75%时进行转染。
Lipofectamine 2000/DNA复合物的制备:分别将 0.8 μg pCDNA3.1- gE、pCDNA3.1- gE’质粒分别稀释于不含血清和抗生素的opti-DMEM中,使混合液的终体积均为 50 μL,室温孵育 5 min;2 μL Lipofectamine 2000分别稀释于不含血清和抗生素的opti-DMEM中,使混合液的终体积均为50 μL,轻轻混匀,室温孵育5 min;将50 μL Lipofectamine 2000稀释液分别滴加到50 μL质粒稀释液中,边加边混匀;室温孵育20 min。
转染 vero细胞:分别将 100 μL Lipofectamine 2000/DNA复合物加入到6孔板中,轻轻摇动使其均匀混合,置37℃培养4 h,弃去上清,加入10%胎牛血清的M199培养基,置37℃培养24 h后,用1%胎牛血清的M199培养基换液,置37℃培养24 h。
1.2.8 mRNA检测 参照试剂盒操作说明,提取转染后的细胞总RNA,将RNA反转录成cDNA,参照Invitrogen M-MLV反转录酶的说明书操作:模板RNA 5 μL,反转录引物 1 μL,dNTP(10 mmol/L)1 μL,DEPC 水补加至 12 μL,100℃ 水浴 5 min,马上冰淬灭 1 min;短暂离心后加入 5×buffer 4 μL,DTT(0.1mol/L)2 μL,RNA 酶抑制剂 1 μL,轻轻混匀后 50℃水浴5 min;加入 M-MLV反转录酶1 μL,50 ℃水浴 50 min;70 ℃水浴15 min,冰淬灭;加入1 μL RNaseH,马上进行PCR反应。PCR反应参照 1.2.3 和 1.2.4。
1.2.9 表达产物的检测 应用间接免疫荧光法检测表达蛋白,方法如下:取出6孔细胞板,用pH为7.2的PBST溶液漂洗细胞1次,加入0.5 mL预冷的甲醇溶液,固定15 min;弃去甲醇溶液,室温放置2~5 min自然晾干;用PBST洗1次;加入100倍稀释的鸡抗DEV阳性血清,37℃孵育1 h,弃去DEV阳性血清,每孔用含0.05%吐温-20的PBST洗3次后,用PBST液洗2次;加500倍稀释的兔抗鸡荧光抗体,37℃温箱中避光孵育1 h,每孔用含0.05%吐温-20的PBST洗3次后,用PBST洗2次,在荧光显微镜下观察并照相。
2 结 果
2.1 gE基因的 PCR扩增 分别以 gE基因的P1/P2为引物、gE’基因的 P11/P22为引物,病毒 DNA为模板PCR扩增gE、gE’基因,扩增产物经0.8%琼脂糖凝胶电泳分析,可见约1400 bp的DNA片段,与预期片段大小相符(图1)。
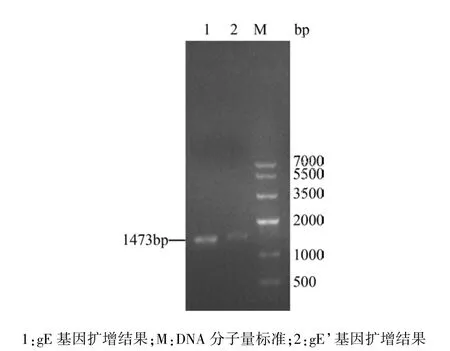
图1 gE和gE’基因的PCR扩增结果
2.2 gE及gE’基因的克隆及酶切鉴定 回收纯化后的gE、gE’PCR产物与pMD18-T连接,分别构建克隆质粒 pMD18T-gE、pMD18T-gE’,酶切、PCR 结果说明所克隆序列与目的片段大小相近(图2、图 3)。

图2 重组质粒pMD18T-gE酶切及PCR鉴定结果
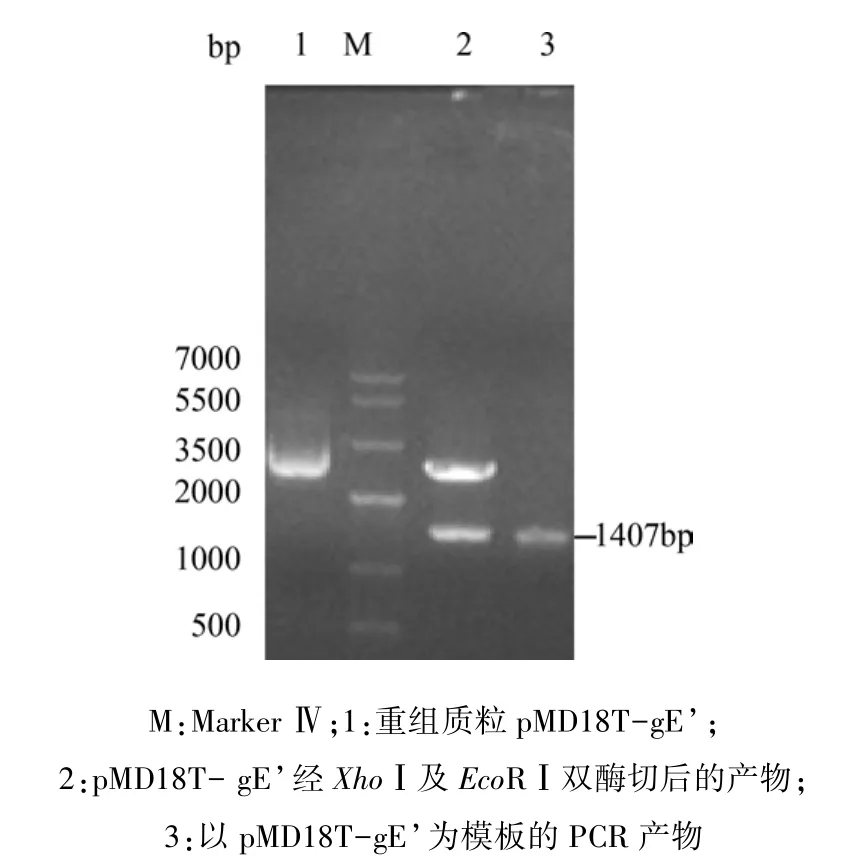
图3 重组质粒pMD18T-gE’酶切及PCR鉴定结果
2.3 gE基因序列分析及编码蛋白的功能预测
2.3.1 同源性分析结果 用NCBI网站的在线程序BLASTN对鸭瘟AV1221株gE基因序列与国内分离强毒 CHv 株 (GenBank:EU071044.1)、 国 内 疫 苗 株(GenBank:EU082088.2)和德国分离强毒 2085 株(GenBank:JF999965.1)基因序列进行比对,结果表明:鸭瘟AV1221株gE基因序列与国内分离强毒CHv株、国内疫苗株同源性均为100%,与德国分离强毒2085株同源性为99%,143位碱基变异(T-C),导致第48位氨基酸由苏氨酸(T)变成了异亮氨酸(I),此外,412位(G-A)和1351位(C-T)碱基同义突变。
2.3.2 信号肽预测结果 用CBS网站的在线程序SignalP4.1对gE氨基酸序列进行信号肽预测,结果显示:gE蛋白序列中预测到的C值、S值或Y值都大于临界值,推测gE蛋白第1~22位氨基酸为信号肽(图4)。
2.3.3 跨膜区的预测结果 本研究利用 TMHMM 2.0预测鸭瘟AV1221株gE蛋白的跨膜区,其结果显示:gE蛋白在397~419位氨基酸有一个跨膜区,1~396位氨基酸位于胞膜外(胞外区),420~490位氨基酸位于胞膜内(胞质区)(图5)。

图4 gE氨基酸序列推倒肽链信号肽预测结果
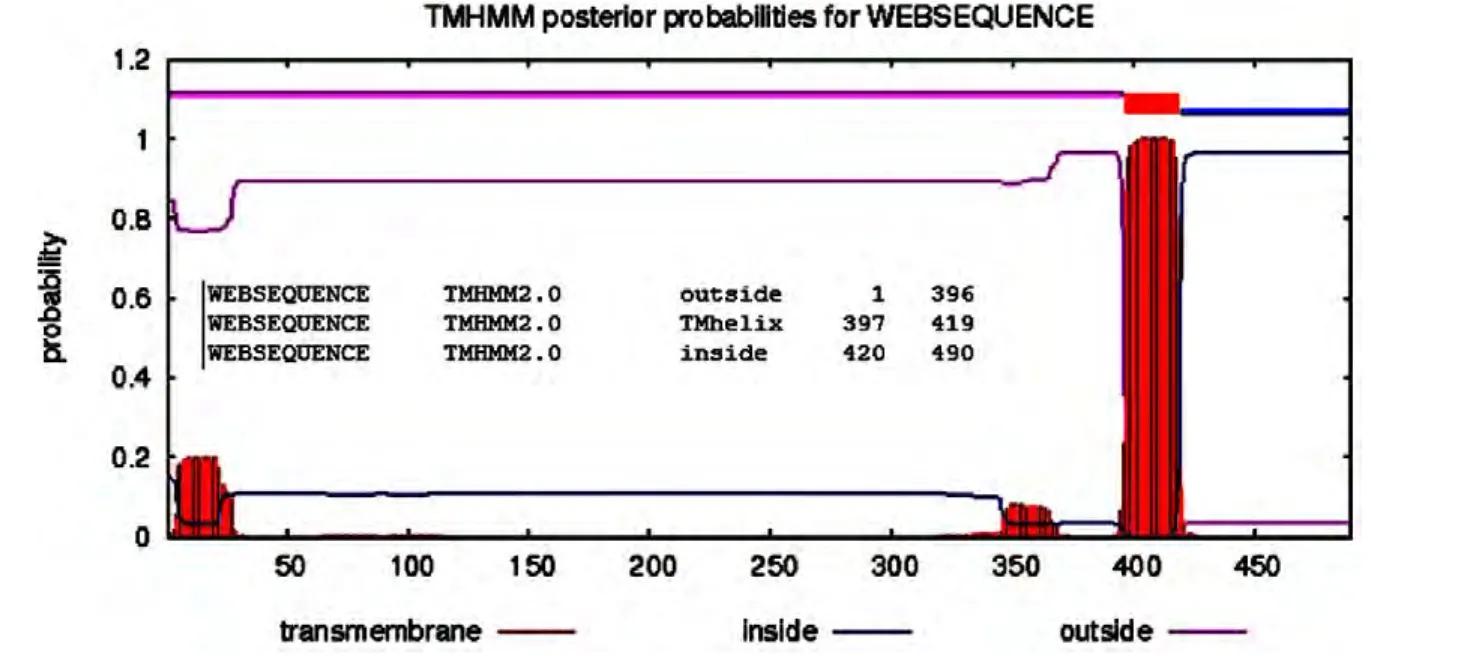
图5 gE氨基酸序列推倒肽链跨膜区预测结果
2.4 真核表达质粒的构建及鉴定 重组质粒pCDNA3.1-gE、pCDNA3.1-gE’经 EcoRⅠ及 XhoⅠ双酶切后分别得到约1400 bp和5400 bp的条带,PCR鉴定结果也获得了约1400 bp的条带,说明成功构建了重组真核表达质粒 pCDNA3.1-gE、pCDNA3.1-gE’(图 6)。
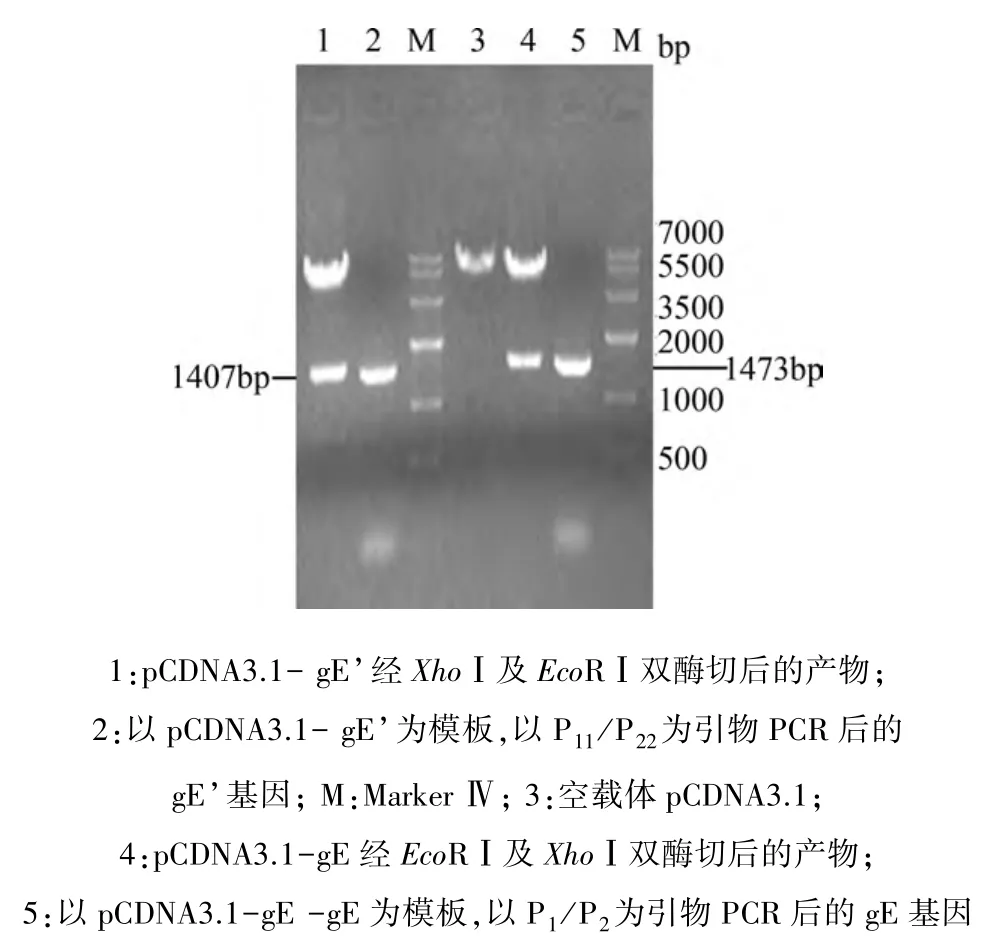
图6 重组质粒 pcDNA3.1-gE、pcDNA3.1-gE’酶切及PCR鉴定结果
2.5 PCR 鉴定转染结果 提取 pCDNA3.1-gE、pCDNA3.1-gE’转染后的 vero 细胞总 RNA,并以提取的细胞总RNA为模板,分别以gE基因的P1/P2、gE’基因的 P11/P22为引物进行 RT-PCR 扩增,得到了相应大小DNA片段(图7),而以提取的空载体pCDNA3.1转染的 vero细胞总 RNA为模板RT-PCR扩增后则未见相应条带,从转录水平上说明gE和gE’基因均在vero细胞获得表达。

图7 pCDNA3.1-gE、pCDNA3.1-gE’和 pCDNA3.1转染vero细胞RT-PCR结果
2.6 表达产物的免疫荧光鉴定 转染48h后,经用荧光显微镜观察,只有重组质粒pCDNA3.1-gE’转染的 vero细胞可见绿色荧光(图 8 A),而pCDNA3.1-gE、pCDNA3.1 转染的 vero 细胞中未见明显荧光(图8B,C),结果表明gE’基因在vero细胞中获得了正确表达,具有免疫原性,能与抗体结合。
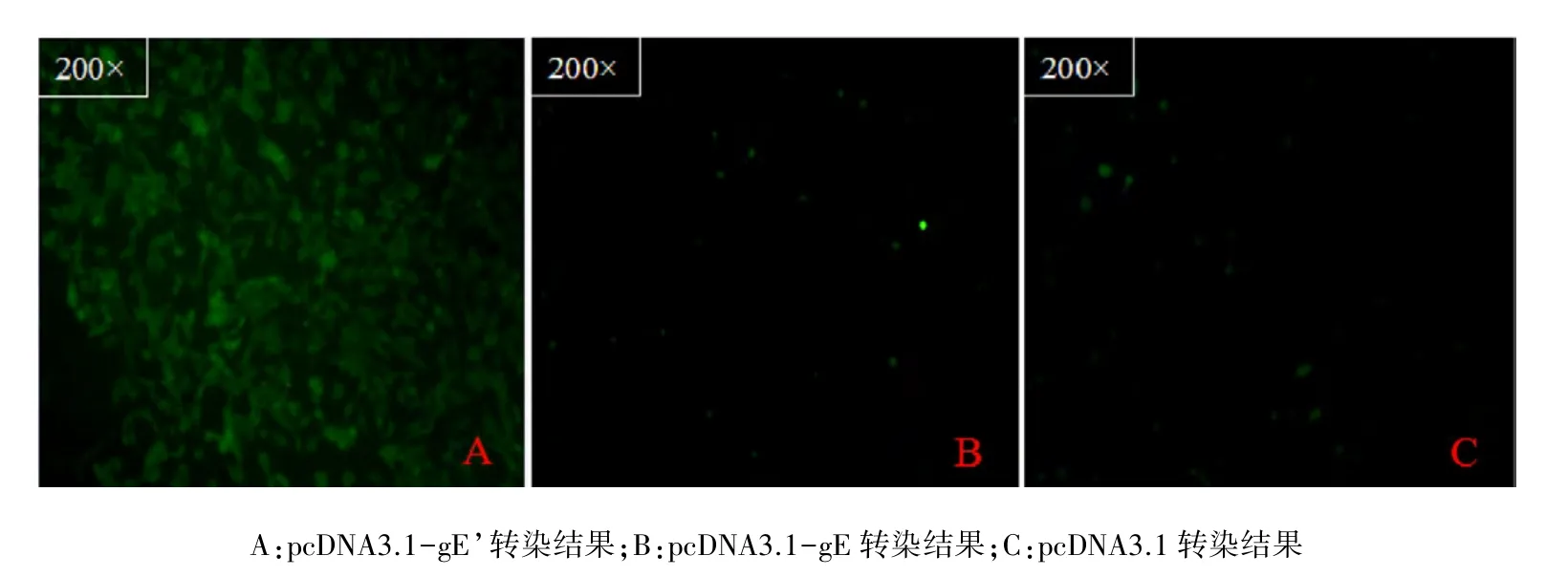
图8 真核表达载体转染vero细胞后间接免疫荧光检测结果
3 讨论与小结
本研究结果表明,鸭肠炎病毒AV1221株 gE基因完整的开放阅读框长为1473 bp,共编码490个氨基酸,其中第1~22位氨基酸为信号肽序列。其基因序列与国内分离强毒CHv株[9]、国内疫苗株[10]和德国分离强毒 2085 株[11]均具有较高同源性,说明鸭肠炎病毒AV1221株gE比较保守。而软件TMHMM 2.0预测表明gE蛋白是典型的囊膜糖蛋白,包括较长的胞外区(396个氨基酸)、跨膜区(23个氨基酸)和胞质区(71个氨基酸),这与常华[12]结果一致。
疱疹病毒gE蛋白表达载体的构建及表达是其功能研究的重要方面,Zhu等[13]将VZV gE构建在真核表达质粒pSVK3上,转染COS-7细胞,用间接免疫荧光方法检测到VZV gE蛋白在COS-7细胞中表达并定位于COS-7细胞的高尔基体。常华[12]利用间接免疫荧光方法检测到DEV gE蛋白可在感染鸭胚成纤维细胞的胞浆中表达。在本研究中,含信号肽的表达载体pCDNA3.1-gE在vero细胞内完成了转录过程,但却未能在vero细胞内检测到荧光,与上述研究结果并不一致,推测可能与所用毒株、宿主细胞不同以及存在信号肽有关。因此又构建了去信号肽的真核表达载体pCDNA3.1-gE’,转染vero细胞后完成了转录过程,并进行了表达,证实gE自身所具有的信号肽序列可以有效诱导gE蛋白分泌到细胞外,与软件TMHMM 2.0预测结果一致。实验表明,在真核表达体系中,信号肽的有无对gE蛋白的表达具有显著的影响。
本研究通过酶切和PCR方法证实,成功构建了真核表达质粒 pCDNA3.1-gE 和 pCDNA3.1-gE’,并在转录水平和蛋白水平上检测了pCDNA3.1-gE、pCDNA3.1-gE’在 vero细胞中的表达,下一步将通过G418抗生素筛选稳定表达gE的vero细胞系,为gE蛋白的体外表达、功能研究、鸭瘟抗体检测试剂盒的开发奠定了基础。
[1]Mettenleiter T C.Pathogenesis of neurotropic herpesviruses: role of viral glycoproteins in neuroinvasion and transneuronal spread[J].Virus Res, 2003, 92(2): 197-206.
[2]Brideau A D, Enquist L W, Tirabassi R S.The role of virion membrane protein endoeytosis in the herpesvirus life cycle[J].J ClinVirol, 2000, 17(2): 69-82.
[3]Tirabassi R S, Enquist L W.Role of envelope protein gE endo eytosis in the pseudorabies virus life cycle[J].J Virol, 1998, 72(6): 4571-4579.
[4]Ao J Q,Wang J W,Chen X H,et al.Expression of pseudorabies virus gE epitopes in Pichia pastoris and its utilization in an indirect PRV gE-ELISA[J].J Virol Methods, 2003, 114(2):145-150.
[5]Snyder A, Poleieova K, Johnson D C.Herpes simplex virus gE/gI and US9 proteins promote transport of both capsids and virion glycoproteins in neuronal axons [J].J Virol, 2008, 82(21): 10613-10624.
[6]Wang F, Tang W, McGraw H M, et al.Herpes simplex virus type 1 glycoprotein e is required for axonal localization of capsid,tegument, and membrane glycoproteins[J].J Virol, 2005, 79(21): 13362-13372.
[7]Tomishima M J, Enquist L W.A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins[J].J Cell Biol, 2001, 154(4):741-752.
[8]杨承槐,李俊平,李启红,等.含LacZ表达盒的鸭瘟病毒TK基因缺失转移载体的构建[J].中国兽药杂志,2013,47(1):7-9.
[9]Wu Y,Cheng A,Wang M,et al.Complete genomic sequence of Chinese virulent duck enteritis virus[ J].J Virol, 2012, 86(10): 5965.
[10]Li Y, Huang B, Ma X, et al.Molecular characterization of the genome of duck enteritis virus[J].Virology, 2009, 391(2):151-161.
[11]Wang J, Hoper D, Beer M, et al.Complete genome sequence of virulent duck enteritis virus(DEV)strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains[J].Virus Res, 2011, 160(1/2): 316-325.
[12]常 华.鸭瘟病毒gE基因功能初步研究[D].雅安:四川农业大学,2011.
[13]Zhu Z, Hao Y, Gershon M D,et al.Targeting of glycoprotein Ⅰ(gE)of varicella-zoster virus to the trans-goligi network by an AYRV sequence and an acidic amino-rich patch in the cytosolic domain of the molecule[J].J Virol, 1996, 70(10):6563-6575.
