家蚕山梨醇脱氢酶基因的转录水平特性分析
2014-05-29韦博尤唐顺明黄金山郝碧芳沈兴家
朱 娟 王 欣 韦博尤 唐顺明 黄金山 郝碧芳 沈兴家
(1江苏科技大学,江苏镇江 212003;2中国农业科学院蚕业研究所,农业部蚕桑遗传改良重点实验室,江苏镇江 202018;3广西壮族自治区蚕业科学研究院,广西南宁 530007)
家蚕山梨醇脱氢酶基因的转录水平特性分析
朱 娟1,2王 欣1,2韦博尤3唐顺明1,2黄金山1,2郝碧芳1,2沈兴家1,2
(1江苏科技大学,江苏镇江 212003;2中国农业科学院蚕业研究所,农业部蚕桑遗传改良重点实验室,江苏镇江 202018;3广西壮族自治区蚕业科学研究院,广西南宁 530007)
为了探究家蚕山梨醇脱氢酶基因(BmSDH)在家蚕各发育时期和组织的转录水平,根据家蚕二化性品种子代滞育性受亲代胚胎期催青条件调控的原理,利用半定量RT-PCR分析25.0℃常温明催青和17.5℃低温暗催青对家蚕品种“秋丰”各发育时期蚕体和组织中BmSDH转录水平的影响。结果显示,BmSDH-1、BmSDH-2a和BmSDH-2b在家蚕的各个发育阶段均有表达:在幼虫期5龄3 d,BmSDH-1在常温明催青组脂肪体中转录水平较高;BmSDH-2a和BmSDH-2b在常温明催青条件下的血液、脂肪体和卵巢中转录水平均高于低温暗催青;在蛹期3 d,BmSDH-2a和BmSDH-2b在常温明催青条件下血液和卵巢中的转录水平均低于低温暗催青;在次代卵产下后6~24 h期间,BmSDH-2a和BmSDH-2b的转录水平逐渐升高。因此,BmSDH-1和蚕卵滞育与否没有直接关系,而BmSDH-2a和BmSDH-2b与家蚕二化性品种卵滞育与否有重要的平行关系,为从分子水平阐明家蚕滞育的分子机制积累了试验数据。
家蚕;滞育;山梨醇脱氢酶;基因表达;半定量RT-PCR
滞育是由神经激素调节的、呼吸代谢速率缓慢的一种动态过程,是昆虫为躲避不良环境而中止发育的一种适应,也是昆虫生活周期与季节变化保持一致的一种基本手段[1]。昆虫滞育类型很多,其中蛹期滞育和卵滞育是比较典型的滞育方式[2-4]。对昆虫滞育机制的研究有利于经济昆虫的开发利用和农林害虫的防治;因此,昆虫滞育研究一直受到国内外学者的广泛关注,而家蚕(Bombyx mori)则是研究滞育机理的优良模式昆虫。
家蚕是卵滞育型昆虫[5]。家蚕卵内山梨醇含量与滞育的发动、持续与解除具有密切的平行关系[6-7]。随着滞育的发动,蚕卵中储存的糖原转化为山梨醇和70%的甘油[8-12],随着滞育的终止,山梨醇又转化为糖原[8,11-12]。目前的研究只发现山梨醇在稳定亚细胞的结构和功能上起作用[13-14],而且高浓度的山梨醇可能是抑制胚胎发育的原因[15-16]。山梨醇脱氢酶 (Sorbitol Dehydrogenase,SDH)是调节山梨醇代谢的关键酶,它催化山梨醇脱氢转化为糖原,从而改变昆虫的发育状态[17]。研究显示,家蚕在滞育过程中BmSDH的转录受到抑制,滞育卵经5℃低温长期冷藏或者短期冷藏并浸酸处理,可以解除这种抑制,从而使BmSDH表达,进而促使滞育卵内山梨醇的转化。非滞育卵BmSDH的转录则不受抑制,随着胚胎发育而适时表达[18]。作为与滞育有着密切关系的BmSDH,在家蚕卵期的表达情况已较为明确,但其在家蚕的其他时期和组织中的表达情况不甚了解。
本试验将家蚕二化性品种“秋丰”的活化越年蚕卵用蛾区半分法分成2组,分别进行常温(25.0℃)明催青和低温(17.5℃)暗催青处理,采用半定量RT-PCR方法,分析各发育时期蚕体组织中BmSDH基因的3种mRNA的转录水平,探讨常温明催青和低温暗催青对BmSDH转录水平的影响,为阐明家蚕二化性品种胚胎期的催青条件决定子代滞育性的分子水平机制提供试验依据。
1 材料与方法
1.1 试验材料
蚕品种:秋丰,二化性,3个卵圈,由本实验室保存。
主要试剂和仪器:RNAiso Plus,PrimeScriptTMRT reagents Kit(Perfect Real Time)为大连宝生物公司(TaKaRa)产品。A10型Milli-Q超纯水净化仪由美国Millipore公司生产;Mini-Sub Cell©GT型琼脂糖电泳装置由美国伯乐公司生产;Veriti 96孔型梯度PCR仪由美国ABI公司生产;G:BOX F3型凝胶成像仪由英国SYNGENE公司生产。
1.2 试验方法
1.2.1 试验设置和材料的准备 将已解除滞育的越年蚕卵每个卵圈一分为二(蛾区半分法),第1组进行常温明催青处理:温度25.0℃,相对湿度70% ~85%,光照10~12 h/d;第2组进行低温暗催青处理:温度17.5℃,相对湿度70% ~85%,保持黑暗。
孵化后的蚁蚕采用常规方法新鲜桑叶饲养,在家蚕的不同发育时期分别取蚁蚕,2~4龄的起蚕,5龄3 d的蚕,化蛹3 d的蛹,未交配的成虫(处女蛾),产卵后保护6、12、24 h的子代卵;其中,5 龄3 d的蚕、化蛹3 d的蛹和未交配的成虫各取血液、脂肪体、卵巢;取材后的样品于-70℃保存备用。
1.2.2 家蚕总RNA的提取及cDNA的合成 按RNAiso Plus说明书提取各发育时期蚕体和组织的总 RNA,用PrimeScriptTMRT reagents Kit(Perfect Real Time)将各发育时期蚕体和组织总RNA进行反转录,获得单链cDNA。
1.2.3 BmSDH-1、BmSDH-2a和 BmSDH-2b mRNA转录水平的半定量RT-PCR检测 参照参考文献[19]的方法设计引物(表1),以合成的各样本cDNA为模板,以家蚕Actin-3基因为内参,通过半定量RT-PCR检测BmSDH在家蚕各发育时期的水平。PCR反应程序:94℃预变性5 min;94℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共30 个循环;最后72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测,检测结果利用Gene tools凝胶图像处理系统进行分析计算,3个重复。

表1 引物及其序列
2 结果与分析
2.1 BmSDH在蚁蚕和2~4龄起蚕中的转录水平
分别以蚁蚕和2~4龄起蚕个体为材料,以1 μg总RNA为模板进行反转录(其他时期及组织相同),用半定量RT-PCR方法分析了BmSDH的转录水平。结果表明:从蚁蚕至各龄起蚕期,BmSDH-1转录水平逐渐升高;但BmSDH-2a和BmSDH-2b的转录水平无明显变化。不论是BmSDH-1,还是BmSDH-2a和BmSDH-2b,在2种不同催青条件(常温明催青组,低温暗催青组)处理后的转录水平均无明显差别(图1)。

图1 不同催青处理后Bm SDH在蚁蚕和各龄起蚕期中的转录水平
2.2 BmSDH在家蚕5龄3 d各组织的转录水平
分别以家蚕5龄3 d幼虫的血液、脂肪体和卵巢为材料,提取总RNA,用半定量RT-PCR的方法分析BmSDH在各组织中的转录水平。如图2所示,BmSDH-1在血液中的转录水平很低,几乎检测不到;而在脂肪体中,常温明催青组的转录水平高于低温暗催青组;BmSDH-1在卵巢中的转录水平也较低,且2种催青处理间没有明显变化。BmSDH-2a在血液、脂肪体和卵巢中的转录水平都很低,且常温明催青组高于低温暗催青组,说明BmSDH-2a在5龄3 d血液、脂肪体和卵巢中的转录水平受胚胎期催青条件的影响。BmSDH-2b在血液、脂肪体和卵巢中的转录水平也较低,且常温明催青组高于低温暗催青组,说明BmSDH-2b在5龄3 d血液、脂肪体和卵巢中的转录水平也受胚胎期催青条件的影响,但是它在脂肪体和卵巢中的转录水平略高于血液。
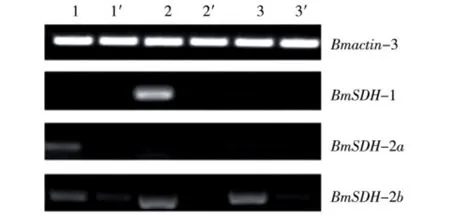
图2 不同催青处理后BmSDH在家蚕5龄3 d不同组织中的转录水平
2.3 BmSDH在蛹期3 d各组织的转录水平分析
分别以家蚕化蛹3 d蛹的血液、脂肪体和卵巢为材料,对BmSDH进行转录水平分析。如图3所示,在脂肪体中BmSDH-1在常温明催青处理的转录水平低于低温暗催青处理组,而血液和卵巢组织中BmSDH-1在2种不同催青条件下的转录水平无明显区别。BmSDH-2a在血液中的转录水平很高,且常温明催青处理组明显低于低温暗催青组;在脂肪体中其转录水平较低,且2种催青处理下的变化不明显;BmSDH-2a在常温明催青处理组卵巢中几乎未检测到,但在低温暗催青组中有很高的转录水平。同时,BmSDH-2b显示出和BmSDH-2a相同的变化特征,说明BmSDH-2a和BmSDH-2b与子代蚕卵滞育与否有密切的平行关系。在滞育卵中需要大量的山梨醇提高卵的抗寒能力,非滞育卵中需要BmSDH将山梨醇转化为糖原,为胚胎发育提供能量。这一结果从分子水平上证实以往推测的滞育激素抑制BmSDH的转录[18]。
2.4 BmSDH在家蚕成虫期各组织的转录水平
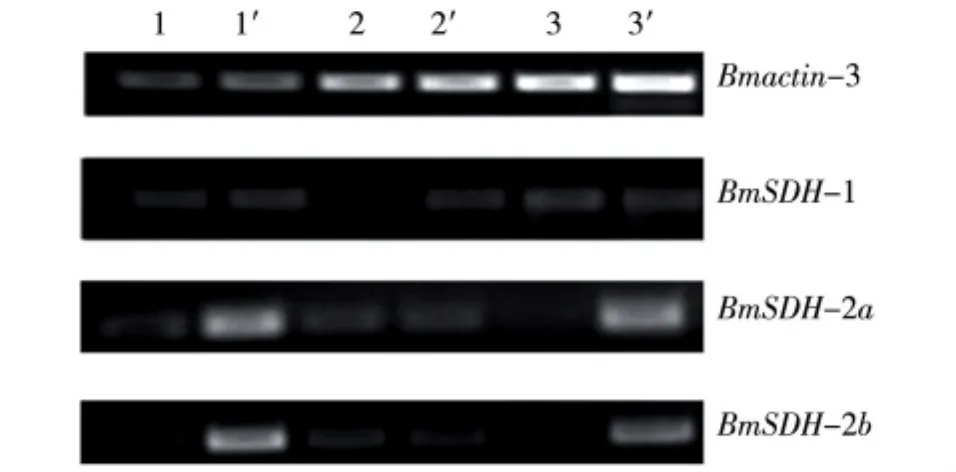
图3 不同催青处理后Bm SDH在蛹期3 d不同组织中的转录水平
以羽化1 d处女蛾的血液、脂肪体和卵巢组织为材料,通过半定量RT-PCR的方法分析BmSDH的转录水平。结果如图4所示:BmSDH-1在血液、脂肪体和卵巢组织转录水平都较低,尤其是在血液中最低;BmSDH-2a在血液和脂肪体中的转录水平较低,而在卵巢中的转录水平很高;不同催青处理对BmSDH-1和BmSDH-2a的转录水平基本没有影响;BmSDH-2b在不同组织和不同催青处理组中,转录水平均无明显变化。由此可见,成虫期BmSDH的转录水平与子代滞育与否没有直接的关联。
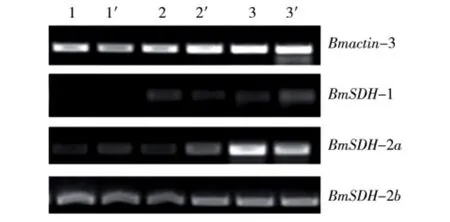
图4 不同催青处理后BmSDH在成虫期不同组织中的转录水平
2.5 BmSDH在子代卵中的转录水平
在光线明亮的条件下将雌蛾与雄蛾交配6~8 h,让其集中产卵,为减少试验误差,将产卵时间控制在30 min内,分别以不同催青处理产卵后6、12、24 h的子代卵为材料,分析BmSDH的转录水平。由图5可以看出,在胚胎期不同催青处理的家蚕所产的子代卵中,BmSDH-1的转录水平较低,其转录水平从产卵后6~24 h没有明显变化,2种不同催青处理间也没有明显差别。BmSDH-2a的转录水平随着产卵后保护时间的延长而逐渐提高,产卵后6 h的蚕卵未检测到转录,产卵后12 h的蚕卵达到较高水平,这一结果与滞育卵在产卵后36 h之内BmSDH-2a的转录水平逐渐升高[20]相一致。BmSDH-2b的转录水平也随产卵后保护时间的延长而升高;但BmSDH-2a和BmSDH-2b的转录水平在不同催青处理的子代卵中未见明显变化。
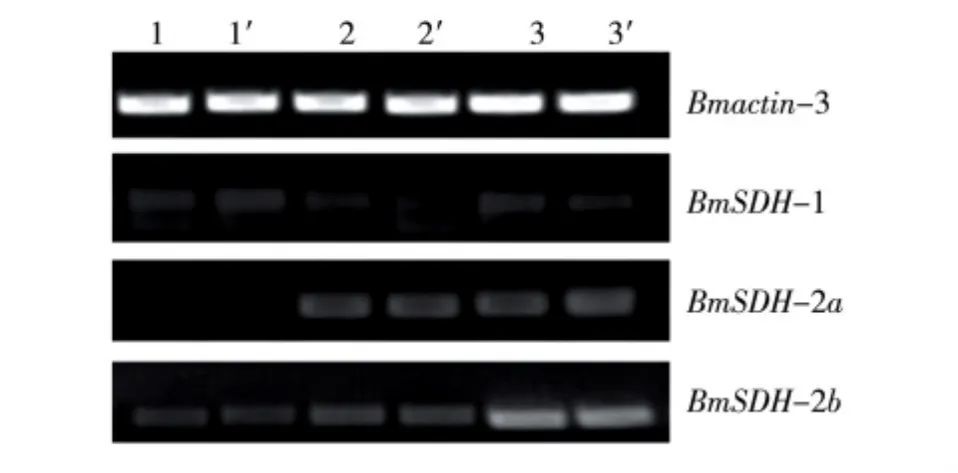
图5 不同催青处理后BmSDH在子代卵中的转录水平
3 讨论
家蚕卵内山梨醇含量与滞育开始、持续和解除的过程具有密切的平行关系[6-7],而SDH是调节山梨醇代谢的酶。之前的文献大都侧重于家蚕卵期的研究,而对家蚕其他时期和组织的研究未见报道。根据二化性品种胚胎期常温明催青和低温暗催青处理分别产滞育卵和非滞育卵的原理,本试验利用半定量RT-PCR方法,在mRNA水平上分析了滞育卵和非滞育卵形成前期BmSDH在不同时期和组织中的转录水平。试验结果表明:BmSDH的表达具有时空特异性,不同催青温度条件、不同发育时期和组织的转录水平存在差异。
在5龄3 d,BmSDH-1在常温明催青组的脂肪体中有较高的转录水平,说明其具有组织特异性;BmSDH-2a和BmSDH-2b在常温明催青条件下血液、脂肪体和卵巢中的转录水平均高于低温暗催青处理组。已有研究显示,常温明催青条件下5龄3 d的保幼激素的分泌水平远远高于低温暗催青[21],保幼激素可能与BmSDH-2a和BmSDH-2b的转录水平具有相关性,至于如何影响还需进一步研究。
在化蛹3 d,BmSDH-2a和BmSDH-2b在脂肪体中的转录水平较低,且不同催青处理之间无明显差别,在常温明催青条件下血液和卵巢中的转录水平均明显低于低温暗催青。胚胎期常温明催青处理发育而来的雌蛹,其咽下神经节分泌大量的滞育激素并通过血液输送到卵巢;而低温黑暗催青处理发育而来的雌蛹滞育激素水平很低[22],由此我们推断滞育激素可能参与BmSDH-2a和BmSDH-2b的转录调控。
在子代卵中,BmSDH-2a和BmSDH-2b的转录水平虽然在24 h内呈逐渐增强的趋势,但在2种催青处理间没有明显的差异。有学者认为,产卵后36 h内蚕卵需要一定的营养供给[20],BmSDH-2a和BmSDH-2b转录水平的逐渐升高,可能将一部分山梨醇由醇转化为单糖被胚胎利用。而BmSDH-1的转录水平较低,且不随时间的延长而变化,说明BmSDH-1的表达产物和家蚕卵滞育与否没有直接关系,其原因还需进一步的研究。
本试验结果为研究家蚕滞育的分子机理提供了新的试验数据,相信随着研究的不断深入,家蚕滞育的分子机制将更加明晰。
[1]Danks H V.Insect dormancy:an ecological perspective.Biological survey of canada(Terrestrial art hropods)[J].National Museum of Science,1987:114-122.
[2]Renfree M B,Shaw G.Diapause[J].Annual Review Physiology,2000,62:353-375.
[3]Denlinger D L.Regulation of diapause[J].Annual Review Entomology,2002,47:93-122.
[4]徐卫华.昆虫滞育的研究进展[J].昆虫学报,1999,42(1):100-107.
[5]Tauber M J,Tauber C A,Masaki S.Seasonal adaptations of insect[M].New York:Oxford University Press,1986:135-151.
[6]Niimi T,Yaginuma T.Biosynthesis of NAD-sorbitol dehydrogenase is induced by acclimation at5℃ in diapause eggs of the silkworm,Bombyxmori[J].Comparative Biochemistry and Physiology Part B,1992,102(1):69-73.
[7]Niimi T,Yamashita O,Yaginuma T.Developmental profile of the gene expression of a Bombyx homolog ofmammalian sorbitol dehydrogenase during embrogensis in non-diapause eggs[J].Comparative Biochemistry Physiology Part B,1993,106(2):37-42.
[8]Chino H.Carbohydratemetabolism in the diapause egg of the silkworm,Bombyxmori-II.Conversion of glycogen to sorbitol and glycerol during diapause[J].Journal of Insect Physiology,1958,2:1-12.
[9]Yaginuma T,Yamashita O.Polyolmetabolism related to diapause in Bombyx eggs:differentbehaviour of sorbitol from glycerol during diapause and post diapause[J].Journal of Insect Physiology,1978,24:347-354.
[10]Yaginuma T,Yamashita O.The origin of free glycerol accumulated in diapause eggs of Bombyx mori[J].Physiological Entomology,1980,5:93-97.
[11]Yaginuma T,KobayashiM,Yamashita O.Distincteffectof low temperatures on the induction of NAD-sorbitol dehydrogenase activity in diapause eggs of the silkworm,Bombyx mori[J].Journal of Comparative Physiology B,1990,160:277-285.
[12]Yaginuma T,Kobayashi M,Yamashita O.Effects of low temperatures on NAD-sorbitol dehydrogenase activity and morphogenesis in non-diapause eggs of the silkworm,Bombyx mori[J].Comparative Biochemistry and Physiology Part B,1990,97:495-506.
[13]Suzuki K,Fujita M,Miya K.Changes in super cooling point of the silkworm eggs[J].The Journal of Sericultural Science of Japan,1983,52:185-190.
[14]Storey K B,Storey JM.Freeze tolerance in animals[J].Physiological Review,1988,68:27-84.
[15]Horie Y,Kanda T,Mochida Y.Sorbitol as an arrester of embryonic development in diapausing eggs of the silkworm,Bombyxmori[J].Journal of Insect Physiology,2000,46:1 009-1 016.
[16]Iwata K,Fujiwara Y,Takeda M.Effects of temperature,sorbitol,alanine and diapause hormone on the embryonic development in Bombyxmori:in vitro tests of old hypotheses[J].Physiological Entomology,2005,30:317-323.
[17]王洪亮,仵均祥.麦红吸浆虫滞育期间海藻糖酶和山梨醇脱氢酶活性的变化[J].西北农林科技大学学报,2006,34(8):139-142.
[18]黄君霆.家蚕滞育分子机制的研究[J].蚕业科学,2003,29(1):1-6.
[19]Raquel OR,Akiko S,Kanako M,etal.Cloning of cDNAs encoding sorbitol dehydrogenase-2a and b,enzymatic characterization,and up-regulated expression of the genes in Bombyx mori diapause eggs exposed to 5 ℃[J].Insect Biochemistry and Molecular Biology,2011,41:378-387.
[20]Sasibhushan S,Rao CG P,Ponnuvel K M.Genome widemicroarray based expression profiles during early embryogenesis in diapause induced and non-diapause eggs of polyvoltine silkworm Bombyxmori[J].Genomics,2013,102:379-387.
[21]吕鸿声.中国养蚕学[M].上海:上海科学技术出版社,1990:176-178.
[22]王力刚,宋海涛,黄勇,等.催青温度对家蚕二化性品种滞育激素受体基因表达的影响及基因的结构特征[J].蚕业科学,2011,37(2):215-223.
S881.2
A
1007-0982(2014)01-0004-05
2014-03-23;
2014-03-30
国家自然科学基金(编号31172266);江苏省普通高校研究生科研创新计划项目(编号CXZZ12_0726)。
朱娟(1988—),女,江苏盐城,硕士研究生。
E-mail:zhujuan0647@sina.com
沈兴家,研究员,博士生导师
Tel:0511-85616543,E-mail:shenxjsri@163.com
