应激性高血糖对大鼠心肌缺血再灌注损伤的影响
2014-05-28贾永平忽海洋
白 莉,贾永平,忽海洋
无论是否伴有糖尿病(DM),急性心肌梗死(AMI)发病早期血糖水平升高都很常见。在ST 段抬高AMI(STEMI)患者中,应激性高血糖(acute hyperglycemia,SHG)发生率可高达50%[1],而 之 前 诊 断 为DM 的 患 者 仅 占20%~25%[2],一 项Meta分析结果表明,AMI时SHG 与患者病死率密切相关[3],入院血糖已成为院内充血性心力衰竭(CHF)和死亡的主要独立预测因子[4]。同时众多大型临床研究结果表明AMI患者合并高血糖时,即使接受抗凝药物、溶栓药物和早期冠脉介入治疗恢复血流灌注,其冠脉微循环障碍、心源性休克和猝死等并发症的发生率均较血糖水平正常的AMI患者显著增加,而SHG 对机体发生心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury,MIRI)时缺血期和再灌注期不同时期的影响及机制,有待进一步研究。本研究采用成年大鼠结扎冠状动脉前降支制作心肌缺血/再灌注模型[5],分别于缺血期和再灌注期静脉输注高糖观察心肌细胞的损伤程度和心肌梗死面积(IS)变化,进而探讨心肌缺血再灌注不同时期SHG 发生与MIRI之间的关系及其可能机制。
1 材料与方法
1.1 动物及试剂 健康成年SD 大鼠(北京实验动物中心提供)50只,2月~3月龄,体重250g~300g,正常饮食。乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所);微量注射泵(美国Harvard公司);HX-200动物呼吸机(成都太萌科技有限公司);血糖仪(德国罗氏公司);Evans蓝和氯化三苯基四氮唑(TTc,Sigma公司)。
1.2 MIRI的模型建立 取实验大鼠称重,以30g/L戊巴比妥钠(30mg/kg)腹腔注射麻醉,仰卧固定于鼠台,分离颈静脉以建立静脉通路,以程控微量注药泵输液给药。行气管切开,气管插管行呼吸机辅助呼吸(呼吸频率60 次/min,潮气量20mL/kg,吸呼比1∶2),四肢皮下插入针形电极描记心电图,沿胸骨左缘第3、4肋间行纵向切口,在左冠状动脉前降支起始部2mm 处,用6.0 丝线穿过心肌浅层,结扎阻断冠脉血流造成心肌缺血,30min后放松聚乙烯管和丝线,以造成再灌注模型。以心电图Ⅱ导联ST 段抬高为缺血模型形成,放松后抬高的ST 段下降1/2以上为MIRI造模成功。缺血30min,再灌注3h,再灌注开始后封闭胸腔(排净胸腔气体),恢复动物自主呼吸。
1.3 实验分组 将大鼠随机分为假手术组(SHAM)、高糖组(HG)、生理盐水对照组(CON)、缺血期高糖组(HGI)、再灌注期高糖组(HGR),每组10只。假手术组和HGI组、HG 组只在左冠状动脉前降支下穿线不结扎。HG 组:开始后一次性给予500 g/L葡萄糖1mL 静脉内注射,继而500g/L 高糖静脉内泵入,持续3.5h;CON 组:缺血开始后一次性给予生理盐水1mL 静脉内注射,继而持续静脉内泵入,至再灌注结束;HGI组:缺血开始后一次性给予500g/L葡萄糖1mL静脉内注射,继而给予500g/L葡萄糖持续静脉内泵入,再灌注开始后给予生理盐水静脉内泵入直至再灌注结束;HGR 组:缺血开始后给予生理盐水静脉输注,再灌注开始后一次性给予500g/L葡萄糖1mL静脉注射,继而给予500g/L葡萄糖持续静脉内泵入,至再灌注结束。各组静脉输液速度均为4mL/(kg·h)。
1.4 检测指标 分别于缺血前、缺血后25min、再灌注1.5h和3h从尾静脉取血,用血糖仪测血糖水平。再灌注结束后,打开腹腔,由腹主动脉取血3mL,常温放置2 0min后,3 0 0 0 r/min,离心5min,取血清300μL进行检测。严格按照试剂盒说明书进行操作检测LDH 水平。
1.5 伊文氏蓝-TTC双染法测定IS 再灌注3h结束后再次原位阻断冠状动脉血流,2%伊文氏蓝4mL 由颈动脉注入后迅速分布全身,迅速将心脏剪下,4 ℃生理盐水清洗后冻存于-20℃冰箱。1h后用心脏切片器垂直于心脏长轴将其切成1 mm厚的薄片,置于1%TTC(pH 7.4)溶液中,37 ℃孵育15min后置于4%的甲醛溶液过夜。次日,将已染色的心肌薄片按顺序放置于平板上,用配备有微焦距镜头的数码相机拍照,并输入计算机。采用单盲法分别将伊文蓝染色区(蓝染,非缺血区)、TTC染色区(红染,缺血区)以及非TTC染色区(白色,梗死区)用Image Pro Plus面积测算软件进行计算处理。总缺血面积以缺血区面积(AAR)占左室(LV)面积百分比表示(AAR/LV×100%),IS以心脏梗死范围(INF)占缺血区面积(AAR)的百分比表示(INF/AAR×100%)。
1.6 统计学处理 以SPSS 13.0 统计软件进行数据分析。数据以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用One-Way ANOVA 分析,P<0.05 为差异有统计学意义。
2 结 果
2.1 大鼠心肌缺血再灌注模型的制备 本实验采用戊巴比妥腹腔麻醉效果好,辅以合适的呼吸参数及稳定的呼吸机性能,术中呼吸道分泌物少,无麻醉意外发生。总计50 只大鼠,SHAM组及HG 组大鼠全部存活,CON 组大鼠死亡1 只,HGI组大鼠死亡3只,HGR 组大鼠死亡2 只,死亡的原因主要是严重的心律失常、分泌物呼吸道梗阻等。
2.2 各组血糖水平变化 缺血前各组间血糖水平差异无统计学意义;CON 组在缺血期血糖水平均略有降低,再灌注期血糖水平均略有升高,但两者之间差异无统计学意义。静脉输注高糖后,血糖水平迅速升高,与CON 组相比,HGI组缺血期血糖水平显著升高(P<0.05),再灌注期血糖水平逐渐下降。与CON 组相比,HGR 组再灌注期血糖水平显著升高(P<0.05)。详见表1。
表1 不同时间点各组的血糖水平mmol/L

表1 不同时间点各组的血糖水平mmol/L
与SHAM 组相比,1)P<0.01;与CON 组相比,2)P<0.01。
组别 缺血前 缺血25min 再灌注1.5h 再灌注3h SHAN 组5.1±0.7 4.9±0.6 5.2±0.4 5.3±0.4 HG 组 5.0±0.5 11.3±0.91) 11.1±0.61) 11.2±0.41)CON 组 4.9±0.4 4.8±0.3 4.9±0.2 5.1±0.3 HGI组 4.6±0.5 18.1±0.91)2) 8.7±0.61)2) 6.5±0.41)2)HGR 组 5.3±0.5 5.0±0.4 18.4±0.81)2) 19.1±0.71)2)
2.3 心肌酶谱检测结果 HG 组与SHAM 组相比,差异无统计学意义;MIRI各组LDH 水平显著高于SHAM 组,其中CON 组 是SHAM 组 的2.65 倍,HGI 组、HGR 组 分 别 为SHAM 组的3.41倍和2.81倍;与CON 组相比,HGI组LDH水平为1.29倍,差异有统计学意义,而HGR 组与CON 组相比,差异无统计学意义(P>0.05)。详见表2。
表2 不同处理组大鼠血清LDH 水平比较U/L
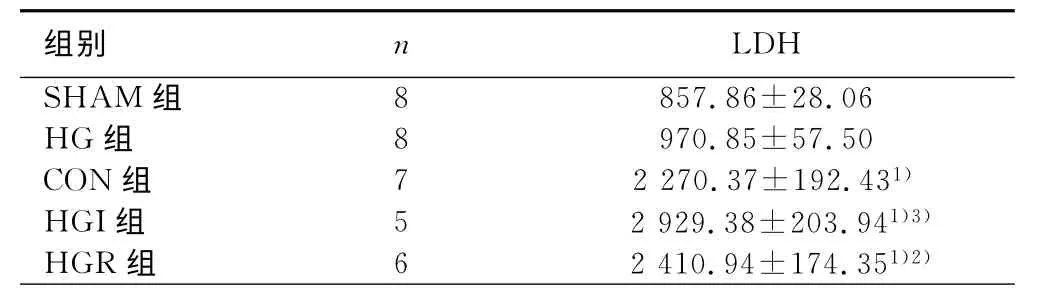
表2 不同处理组大鼠血清LDH 水平比较U/L
与SHAM 组相比,1)P<0.01;与CON 组相比,2)P<0.05,3)P<0.01。
2.4 不同处理组大鼠MIRI后IS比较 应激性高血糖可加重心肌细胞凋亡,扩大心肌梗死面积。CON 组、HGI组和HGR组间总缺血范围差异无统计学意义。大鼠发生MIRI时心脏出现明显的梗死区。与CON 组相比,HGI组的IS 明显扩大,差异有统计学意义(P<0.05),而HGR 组IS与CON 组相比略增大,但差异无统计学意义(P>0.05)。详见表3。
表3 不同处理组大鼠MIRI后IS比较 %

表3 不同处理组大鼠MIRI后IS比较 %
与CON 组相比,2)P<0.01。
组别IS CON 组36.53±3.06 HGI组 46.93±3.521)HGR 组 38.50±2.71
3 讨 论
大量临床研究发现,无论患者既往有无糖尿病,只要AMI时合并有高血糖存在,即使溶栓、介入等技术手段可以及时疏通闭塞血管实现缺血心肌的再灌注,心力衰竭及死亡的发生率依然显著高于正常血糖患者[6]。Lavi等[7]研究证实,STEMI患者即使接受PCI治疗,其入院血糖水平和院内死亡率呈显著正相关,急性高血糖仍是预后不佳的强烈预测因子。而发生急性高血糖的患者中,只有20%~25%既往有糖尿病史,这显然不能完全靠糖尿病引起动脉粥样硬化程度加重来解释,高血糖可能直接增加了心肌自身对MIRI的敏感性,导致损伤加重。目前研究普遍认为,AMI并发SHG 的主要机制是机体的应激反应致神经内分泌系统的全面激活及存在潜在的糖代谢紊乱[8]。
当细胞受损后,细胞内的LDH 漏出到细胞外,因此本实验通过测定血清中LDH 活性反映心肌细胞损伤的程度,同时采用伊文氏蓝-TTC双染法测定心肌梗死面积以明确不同时期的高血糖是否增加MIRI。在实验中,与SHAM 组相比,HG 组LDH 水平升高不明显,而行MIRI各组大鼠LDH 水平明显升高,IS扩大,其中HGI大鼠的LDH 活性最高,IS最大,HGR 组的LDH 水平及IS与CON 组比较差异统计学意义。这说明单独高糖刺激并不能引起心肌细胞的明显损伤,静脉输注高糖后,AMI大鼠心肌对MIRI的敏感性升高,缺血期的高血糖会造成更严重的心肌损伤。提示缺血期和再灌注期高血糖对心肌细胞损伤的影响或机体对抗应激的机制和反应过程不同。已有大量实验证明快速血糖升高会产生强烈的氧化应激反应[9]。而急性高血糖和MIRI可以通过线粒体诱发活性氧(ROS)的爆发性产生,过度的ROS生成触发不同的细胞功能障碍,包括脂质过氧化,DNA 突变,及细胞凋亡或坏死[10],当ROS的产生超过机体的清除能力,会导致细胞内氧化还原状态失衡,致细胞凋亡增加。推测缺血期SHG 诱发的增强的氧化应激可能会影响心肌细胞的氧化还原状态,进而削弱其抗氧化抗凋亡功能,造成更严重的心肌损伤。同时,高血糖可加重炎症反应,致血管内皮功能紊乱,引起内皮依赖性血管舒张功能减退及内皮细胞凋亡[11]。心肌梗死大小更多地取决于细胞凋亡的严重程度,随着缺血期血糖升高,心肌细胞缺血、缺氧加重,致使再灌注期冠脉微循环障碍发生率更高,并发致死性心律失常的几率明显增加[12],表现为实验中HGI组IS进一步扩大,并有3只大鼠死于恶性心律失常。
本研究发现缺血期高血糖可以增加大鼠心肌对MIRI的易感性而加重MIRI,这可能与高糖诱发的氧化应激效应加重MIRI大鼠活性氧的产生、高凝状态、内皮功能不全,以及加重炎症反应,致心肌氧化还原失衡等有关,进而影响冠脉舒张,加重再灌注期微循环障碍,使凋亡加重。但本实验未探讨MIRI发生SHG 时机体的抗氧剂系统的活性以及应对氧化应激的机制,从而在临床上可以有针对性地采取干预措施,降低SHG 对MIRI的危害,改善预后。
[1] Norhammar A,Tenerz A,Nilsson G,et al.Glucose metabolism in patients with acute myocardial infarction and rio previous diagnosis of diabetes mellitus:A prospective study[J].Lancet,2002,359(9324):2140-2144.
[2] Wahab NN,Cowden EA,Pearce NJ,et al.Is blood glucose an independent predictor of mortality in acute myocardial infarction in the thrombolytic era[J].J Am Coll Cardiol,2002,40(10):1748-1754.
[3] McCowen KC,Malhotra A,Bistrian BR.Stress-induced hyperglycemia[J].Crit Care Clin,2001,17(1):107-124.
[4] Zeller M,Steg P,Ravisy J,et al.Prevalence and impact of metabolic syndrome on hospital outcomes in acute myocardial infraction[J].Arch Intern Med,2005,65(10):1192-1198.
[5] 卫洪超,和庚戌,胡胜寿,等.建立一种标准化急性心肌梗死动物模型[J].中华实验外科杂志,2005,22:876-878.
[6] Capes SE,Hunt D,Malmberg K,et al.Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes:A systematic overview[J].Lancet,2000,355(9206):773-778.
[7] Lavi S,Kapeliovich M,Gruberg L,et al.Hyperglycemia during acute myocardial infarction in patients who are treated by primary percutaneous coronary intervention:Impact on long-term prognosis[J].Int J Cardiol,2008,123(2):117-122.
[8] Begieneman MP,van de Goot FR,Krijnen PA,et al.The basement membrane of intracardial capillaries is thickened in patients with acute myocardial infarction[J].J Vasc Res,2010,47(1):124-125.
[9] Monnier L,Mas E,Ginet C,et al.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperlycemia in patients with type 2diabetes[J].JAMA,2006,29(14):1681-1687.
[10] Takimoto E,Kass DA.Role of oxidative stress in cardiac hypertrophy and remodeling[J].Hypertension,2007,49:241-248.
[11] Kawano H,Motoyama T,Hirashima O,et al.Hyperglycemia rapidly suppresses flow-mediated endothelium-dependent vasodilation of brachial artery[J].J Am Coil Cardiol,1999,34(1):146-154.
[12] Heineke J,Kempf T,Kraft Tet al.Downregulation of cytoskeletal muscle LIM protein by nitric oxide:Impact on cardiac myocyte hypertrophy[J].Circulation,2003,107(10):1424-1432.
