草苁蓉乙醇提取物对NAFLD大鼠肝脏炎性因子表达的影响
2014-05-25何松美刘霞吴煜良刘旭明殷思纯龙尧
何松美,刘霞,吴煜良,刘旭明,殷思纯,龙尧
·实验性肝炎·
草苁蓉乙醇提取物对NAFLD大鼠肝脏炎性因子表达的影响
何松美,刘霞,吴煜良,刘旭明,殷思纯,龙尧
目的探讨草苁蓉乙醇提取物(BREE)对非酒精性脂肪性肝病(NAFLD)大鼠肝组织羟脯氨酸和炎性因子的影响。方法采用高脂饲料喂养构建大鼠NAFLD模型,大鼠被随机分为正常对照组、NAFLD模型组和BREE治疗组(500 mg·kg-1·d-1)。在用药8 w末,处死动物,留取血清,采用ELSIA法检测肝组织白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6水平;采用HE染色和免疫组化法分别观察大鼠肝脏病理学变化和检测肝组织NF-kB/p65表达。结果BREE治疗组大鼠血清ALT[(39.47±20.26)U/L]和AST[(46.48±18.52)U/L]水平较模型组显著下降[(79.32±19.05)U/L和(88.35±17.46)U/L,P<0.01],而血清还原性谷胱甘肽[(349.43±45.52)mg/L]水平较模型组明显升高[(265.38±28.57)mg/L,P<0.01];BREE治疗组大鼠肝组织NF-kB/p65阳性表达[(15.49±4.78)%]和羟脯氨酸含量[(14.28±3.08)mg/g]均较模型组显著下降[分别为(87.54±6.59)%和(35.47± 4.53)mg/g,P<0.01],同样,IL-1β、TNF-α和IL-6水平[分别为(34.51±5.61)pg/mL、(45.37±7.03)pg/mL)和(18.98±5.04)pg/mL]均较模型组显著降低[分别为(78.25±6.51)pg/mL、(85.64±6.25)pg/mL、(29.19±4.82)pg/mL,P<0.01];BREE处理组动物肝组织病理学损害程度明显减轻。结论BREE能明显改善NAFLD大鼠肝功能和肝组织胶原沉积,其机制可能与通过下调NF-κB/p65和炎症细胞因子表达有关。
非酒精性脂肪性肝病;草苁蓉乙醇提取物;核转录因子κB/p65;炎性细胞因子
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是指由肝细胞脂肪变性发展到炎症纤维化的一组疾病[1],通常原发于与胰岛素抵抗相关的肥胖、2型糖尿病、高脂血症、高血压等代谢紊乱性疾病[2]。研究报道[3],核转录因子-κB(nuclear factor-κB,NF-kB)、白介素1β(Interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和白介素-6(Interleukin-6,IL-6)等炎性因子引起的炎症反应是NAFLD发生发展中的关键事件,不仅可以引起脂肪性肝炎,还会进一步促进纤维化的进程。草苁蓉具有抗肿瘤、抗炎、清除自由基、抗脂质过氧化等作用[4~6]。草苁蓉(boschniakia rossica)可以通过抑制非酒精性脂肪肝大鼠体内氧化应激反应而起到保护肝脏的作用[7],但其对非酒精性脂肪性肝病炎症损伤有无抑制作用尚不清楚。因此,本文拟通过构建NAFLD大鼠模型,观察草苁蓉对大鼠肝脏NF-kB、IL-1β、TNF-α和IL-6水平的影响,探讨草苁蓉对NAFLD大鼠治疗的可能机制,为临床使用草苁蓉治疗NAFLD提供新的实验和理论依据。
1 材料与方法
1.1 实验动物、试剂与仪器Sprague-Dawley(SD)大鼠30只,雌雄各半,体质量(180±20)g,购自本校实验动物中心(许可证号:粤A2011108)。草苁蓉乙醇提取物(boschniakia rossica ethanol extract,BREE)购于安徽医科大学临床药理研究所;戊巴比妥钠(美国Sigma公司,批号:P3761);检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)及还原型谷胱甘肽(GSH)试剂盒(上海江莱生物科技有限公司);检测IL-1β、TNF-α和IL-6试剂(上海国药集团化学试剂有限公司);兔抗大鼠NF-kB/p65多克隆抗体(武汉博士德生物工程有限公司);检测羟脯氨酸(Hyp)试剂(南京建成生物工程研究所提供)。UV-300型紫外分光光度计(日本岛津);可调高速组织匀浆机(IKATM18 Basic,德国);电热恒温水浴箱(余姚东方电工仪器厂);超速冷冻离心机(BECKMAN,USA);EL30型酶标仪(美国Bio-Tek公司);奥林巴斯显微镜BX51(Image-Pro Plus6.0图象分析软件);7600型全自动生化分析仪(日本日立公司)。
1.2 NAFLD大鼠模型的建立取大鼠30只,适应性饲养1 w后,随机分为正常对照组10只和NAFLD模型组20只。模型建立方法参考文献[8],给予高脂饲料(88%基础饲料+10%猪油+2%胆固醇),8 w后造模成功。根据体质量随机分为模型组和草苁蓉处理组。给予草苁蓉组动物草苁蓉500 mg·kg-1,连续灌胃8 w,正常对照组和模型组均给予蒸馏水(10 mL·kg-1)灌胃。在用药8 w末,处死各组大鼠,处死前称体质量,给予3%巴比妥那300 mg·kg-1腹腔注射麻醉,打开腹腔,自心脏取血,离心、留取血清,置-20℃保存,备检。取部分肝脏,置中性甲醛液中固定,行病理学切片。剩余肝组织置于-80℃冰箱保存,备检。
1.3 血生化指标的检测采用Henry法测定AST和ALT;采用比色法测定GSH。
1.4 肝组织细胞因子测定取冻存肝组织,制成肝匀浆,离心,取上清,采用ELISA法测定肝组织IL-1β、TNF-α和IL-6水平。
1.5 肝组织NF-kB/p65蛋白表达的检测取肝组织,用10%中性缓冲福尔马林液固定,石蜡包埋,切片。将切片浸入0.1 mol/L PBS(pH 7.4)中浸泡、微波修复抗原;先后加兔抗大鼠NF-kBp65和山羊抗兔IgG,滴加链霉抗生物素-过氧化物酶溶液;滴加Strept avidin-biotin complex(SABC);二氨基联苯胺(DAB)显色,滴加苏木素轻度复染后,脱水、透明、中性胶封片。结果判断:以细胞核或细胞浆出现黄褐色细颗粒状着色为阳性细胞,在400倍显微镜下,每张切片随机选10个视野,数500个细胞,计算阳性率。
1.6 肝组织Hyp水平测定采用氯仿-T法测定,取肝组织50 mg,加950 ml/L乙醇脱脂0.5 d,于脱脂器中用丙酮脱脂2 d,取出,置10℃烤箱烘干,研磨成粉。再精确称取肝粉10 mg,放入加带塞试管内,加入6 mol/L盐酸0.3 mL,放在125℃烤箱水解5 h。自然冷却后,移入50 mL容量瓶,加6 mol/L氢氧化钠,调pH至6.0。用蒸馏水稀释至50 mL,过滤、取1.0 mL测定。各管加1.0 mL氯氨T溶液,摇匀,室温下放置20 min,继续加入1.0 mL过氯酸,5 min后加入1.0 mL 100 ml/L对二甲氨基苯甲醛溶液。65℃水浴,保温20 min,取出后冷却。20 min后在550 nm波长处比色。根据已知质量分数的Hyp,绘制标准曲线,确定肝组织Hyp水平。
1.7 统计学分析应用SPSS11.6统计软件进行单因素分析,计量资料以(±s)表示,两组间比较采用t检验,以P<0.05为有统计学意义。
2 结果
2.1 BREE对NAFLD大鼠血清ALT、AST和GSH水平的影响在治疗8周末,BREE治疗组大鼠血清ALT和AST水平均显著低于模型组(P<0.010),而血清GSH水平明显高于模型组(P<0.01,表1),提示BREE可明显改善NAFLD大鼠肝功能。
表1 各组大鼠血生化指标(±s)的比较
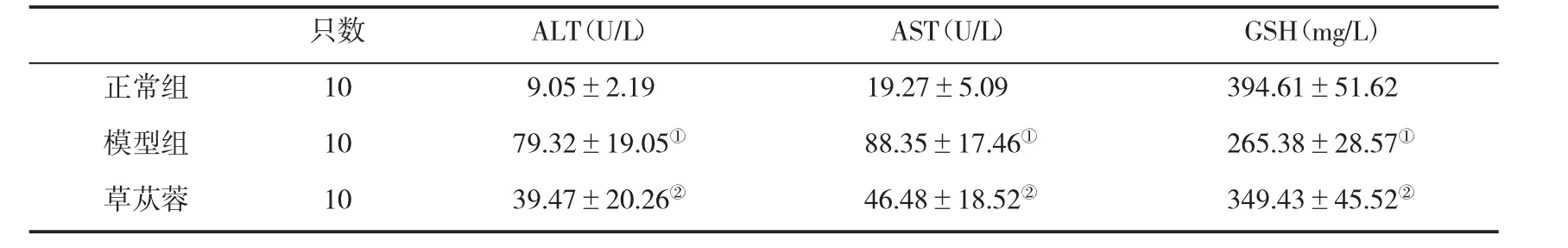
表1 各组大鼠血生化指标(±s)的比较
与正常组比,①P<0.01;与模型组比,②P<0.01
只数ALT(U/L)AST(U/L)GSH(mg/L)正常组109.05±2.1919.27±5.09394.61±51.62模型组1079.32±19.05①88.35±17.46①265.38±28.57①草苁蓉1039.47±20.26②46.48±18.52②349.43±45.52②
2.2 BREE对NAFLD大鼠肝组织IL-1β、TNF-α和IL-6水平的影响NAFLD模型大鼠肝组织IL-1β、TNF-α和IL-6水平均显著高于正常组(P<0.01);BREE处理组动物肝组织IL-1β、TNF-α和IL-6水平较模型组均显著下降(P<0.01,表2)。
表2 BREE对NAFLD大鼠肝组织IL-1β、TNF-α和IL-6水平(pg/mL,±s)的影响
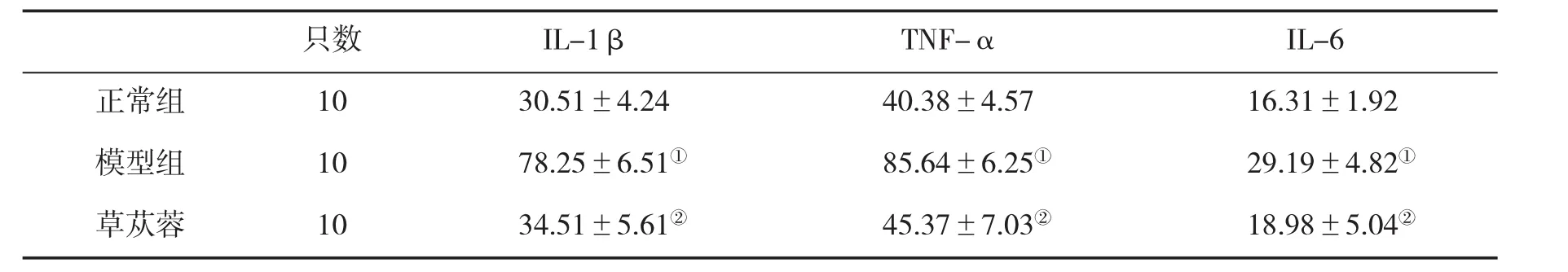
表2 BREE对NAFLD大鼠肝组织IL-1β、TNF-α和IL-6水平(pg/mL,±s)的影响
与正常组比,①P<0.01;与模型组比,②P<0.01
只数IL-1βTNF-αIL-6正常组1030.51±4.2440.38±4.5716.31±1.92模型组1078.25±6.51①85.64±6.25①29.19±4.82①草苁蓉1034.51±5.61②45.37±7.03②18.98±5.04②
2.3 BREE对NAFLD大鼠肝组织NF-κB/p65蛋白表达和Hyp水平的影响NAFLD模型组大鼠肝组织阳性染色细胞明显,NF-κB/p65蛋白阳性表达率和Hyp水平较正常组显著升高(P<0.01);BREE处理组动物肝组织内棕黄色颗粒较模型组明显减少,阳性表达率较NAFLD大鼠明显下降(P<0.01,表3)。
表3 BREE对NAFLD大鼠肝组织NF-κBp65和Hyp水平(±s)的影响

表3 BREE对NAFLD大鼠肝组织NF-κBp65和Hyp水平(±s)的影响
与正常组比,①P<0.01;与模型组比,②P<0.01
只数NF-κBp65(%)Hyp(mg/g)正常组1012.54±6.5912.54±3.06模型组1087.54±6.59①35.47±4.53①草苁蓉1015.49±4.78②14.28±3.08②
3 讨论
NAFLD是一类与酒精性肝病相似的肝脏组织学改变,但无过量饮酒史(摄入酒精<40 g/d)的临床病理综合征[9],是在脂肪沉积的基础上异常的细胞因子、脂质过氧化和氧化应激等参与的炎症反应形成的脂肪性肝炎,但其确切机制尚不清楚。既往认为,脂肪肝为良性病变,不会发展成肝纤维化、肝硬化,但大量临床肝活检研究证实NAFLD在脂肪性肝炎的基础上约40%~50%会发展为肝纤维化,15%~20%可发展为肝硬化,甚至会导致肝细胞癌的发生[10]。
祖国医学认为草苁蓉具有通络作用,可能有助于改善肝功能。研究提示,草苁蓉可明显改善二甲基亚硝胺诱导的大鼠肝纤维化[11]。草苁蓉对NAFLD大鼠肝脏的保护作用如何?本实验结果显示,用药8 w后,与NAFLD模型大鼠比,BREE处理组肝组织ALT和AST水平明显降低,GSH明显提高(P<0.01),说明BREE对NAFLD大鼠肝脏同样具有保护作用。
NF-κB在调节炎症反应的基因中起关键作用,是一种具有转录激活功能的蛋白质,是多种信号传导途径的汇聚点。当细胞处于静息状态时,NF-κB的P65亚基与其抑制蛋白IkB结合,覆盖P50蛋白的核定位信号,组成无活性的NF-κB/IkB,以p50-p65-IkBα或p50-p65-IkB三聚体的形式存在。当机体受到外界因素刺激时,IκB发生磷酸化,并从NF-κB二聚体上解离,暴露p50的核定位信号,NF-κB得以激活并移位进入细胞核,促进核转录,参与许多炎症因子如TNF-α、IL-6、CRP和TGF等基因的表达调控[12],产生生物学效应,而TNF-α和IL-1β不仅是NF-κB调节的产物,又能反过来激活NF-κB,加重机体炎症反应,从而加重胰岛素抵抗(IR)的肝脏损伤,引起糖尿病症状。研究发现,TNF-α可抑制葡萄糖转运,干扰胰岛素信号转导,导致IR,它还能促进脂肪细胞的脂肪分解及FFA的释放[13]。越来越多的证据表明炎症与IR相关,至少是IR的一部分机制。Boden et al[14]给大鼠输注脂肪乳/肝素,造成了明显的肝脏IR和肝脏NF-κB激活,与NF-κB相关的一些炎症因子如MCP-1、TNF-α、IL-1β和IL-6等明显升高,进一步激活炎症通路,炎症反应扩大,造成恶性循环。由上可知,NF-κB、TNF-α、IL-1β和IL-6在NAFLD的发展过程中起着重要作用。本实验结果证实,NAFLD模型大鼠肝组织细胞核内棕黄色颗粒明显比其他组增多且着色深、肝组织IL-1β、TNF-α和IL-6水平明显增高(P<0.01),BREE处理动物肝组织NF-κB/p65表达明显被抑制、肝组织IL-1β、TNF-α和IL-6水平明显降低(P<0.01),提示TGF可能通过直接或间接作用下调NF-κB/p65表达,降低肝组织IL-1β、TNF-α和IL-6的产生,从而对NAFLD大鼠发挥治疗作用,而高脂饮食诱导的NAFLD大鼠肝脏NF-κB的激活可能是产生肝脏和全身胰岛素抵抗的根源。
在NAFLD的发展过程中往往伴有不同程度的肝纤维化病变,肝纤维化的细胞外基质成分主要为胶原纤维,而羟脯氨酸常是胶原的特异氨基酸,在胶原蛋白的成分中约占14%,在非胶原蛋白中则很少。因此,测定肝组织Hyp含量可间接反映肝纤维化的程度[15]。本实验研究发现,与正常组比NAFLD模型大鼠肝脏Hyp含量明显增高(P<0.01);与NAFLD模型大鼠比,BREE处理动物肝脏Hyp含量明显减低(P<0.01),提示BREE可通过减少肝脏Hyp含量,减轻局部组织炎症,从而改善肝纤维化病变。
综上所述,BREE可能是通过直接或间接下调NF-κB/p65表达、降低肝组织IL-1β、TNF-α和IL-6水平、抑制肝脏Hyp的产生,从而具有保护肝细胞的作用,表现为ALT和AST水平降低,GSH水平升高。BREE能减轻NAFLD大鼠肝脏病理学变化,改善肝功能和糖脂代谢,发挥对NAFLD大鼠的保护作用。
[1]Patell R,Dosi R,Joshi H,et al.Non-alcoholic fatty liver disease(NAFLD)in obesity.J Clin Diagn Res,2014,8(1):62-66.
[2]Dey PK,Sutradhar SR,Barma TK,et al.Risk factors of non-alcoholic fatty liver disease.Mymensingh Med J,2013,22(4): 649-654.
[3]Malaguarnera M,Di Rosa M,Nicoletti F,et al.Molecular mechanisms involved in NAFLD progression.J Mol Med,2009,87(7):679-695.
[4]朴龙,张学武,金香子,等.草苁蓉提取物对衰老大鼠脑组织自由基的影响.中西医结合学报,2003,1(2):125-127.
[5]Yin ZZ,Jin HL,Yin XZ,et al.Effect of Boschniakia rossica on expression of GST-P,p53 and p21(ras)proteins in early stage of chemical hepatocarcinogenesis and its anti-inflammatory activities in rats.World J Gastroenterol,2000,6(6):812-818.
[6]李永宇,朴熙绪,尹宗柱,等.草苁蓉乙醇提取物对D-氨基半乳糖中毒大鼠急性肝损伤的保护作用.延边大学医学学报,2001,24:90-94.
[7]张炜煜,朴熙绪,金海燕,等.草苁蓉乙醇提取物对大鼠非酒精性脂肪性肝病的保护作用.世界华人消化杂志,2012,20(32):3087-3094.
[8]钟岚,范建高,王国良,等.肥胖、高脂血症性脂肪性肝炎模型的建立.实验动物科学与管理,2000,17(2):16-20.
[9]范竹萍.非洒精性脂肪性肝炎研究进展.国外医学消化分册,1998,18:20.
[10]尤鹏,非酒精性脂肪性肝炎发病机制的研究进展.中国医药导刊,2003,5(2):197-198.
[11]朴熙绪,黄红果,朴东明.草苁蓉乙醇提取物对二甲基亚硝胺诱导大鼠肝纤维化的治疗作用.世界华人消化杂志,2005,13(18):2205-2209.
[12]Mirza A,Liu SL,Frizell E,et a1.A role for tissue ransglutaminase in hepatic injury and fibrogenesis,and its regulation by NF-kap-paB.Am J Physiol,1997,272(2):G 281-288.
[13]陈红,孙明杰,彭娟.黄连解毒汤对糖尿病大鼠肝脏核因子-B肿瘤坏死因子表达的影响.中国实验方剂学杂志,2010,6(18):153-155.
[14]Boden G,She P,Mozzoli M,et a1.Free fatty acids produce insulin resistance and activate the proinflammatory nuclear factor-kappaBpathwayinratliver.Diabetes,2005,54(12):3458-3465.
[15]李映菊,汪煜华,刘玉美.白屈菜红碱对肝纤维化大鼠肝脏病理学和肝脏羟脯氨酸含量的影响.实用肝脏病杂志,2009,12(6): 167-170.
(收稿:2014-03-12)
(校对:陈从新)
Impact of boschniakia rossica ethanol extract on hepatic expression of inflammatory cytokines in rats with NAFLD
He Songmei,Liu Xia,Wu Yuliang,et al.Department of Infectious Disease,Peaple’s Hospital,Dongguan,523008,Guangdong Province,China
ObjectiveToinvestigatetheeffectofboschniakiarossicaethanolextract(BREE)on hydroxyproline(Hyp)and inflammatory cytokines in rats with non-alcoholic fatty liver diseases(NAFLD). MethodsThe model of NAFLD in rats was established by hight-fat diet administration.Rats were randomly divided into control,model and BREE treatment group(500 mg·kg-1·d-1).All rats were sacrificed to harvest serum and liver tissues at the end of eighth week.Serum levels of AST,ALT and reduced glutathione(GSH)were measured,and the levels of interleukin(IL)-1β,tumor necrosis factor(TNF)-α and IL-6 in liver tissues were detected by ELSIA.HE staining and immunohistochemistry were performed for evaluation of liver pathological changes and the expression of NF-kB/p65 in liver tissues,respectively.ResultsSerum levels of ALT[(39.47± 20.26)U/L]and AST[(46.48±18.52)U/L]in rats subjected to BREE treatment significantly decreased as compared to in the model group[(79.32±19.05)U/L and(88.35±17.46)U/L,respectively,P<0.01];Serum GSH levels in BREE-treated rats[(349.43±45.52)mg/L]significantly increased than in the model[(265.38±28.57)mg/L,P<0.01];The positive rates of NF-kB/p65[(15.49±4.78)%]and Hyp contents[(14.28±3.08)mg/g]in liver tissues in BREE-treated rats significantly decreased than in the model[(87.54±6.59)%and(35.47±4.53)mg/g,respectively,P<0.01];the IL-1β,TNF-α and IL-6 levels[(34.51±5.61)pg/mL,(45.37±7.03)pg/mL,(18.98±5.04)pg/mL,respectively]in liver tissues in BREE-treated rats were significantly lower than in the model[(78.25±6.51)pg/mL,(85.64±6.25)pg/mL,(29.19±4.82)pg/mL,respectively,P<0.01];BREEalsosignificantlyalleviated pathological changes in the liver.ConclusionsBREE significantly improves liver function and collagen deposition in rats with NAFLD by down regulation of NF-κB/p65 and inflammatory cytokines in the liver.
Non-alcoholic fatty liver disease;Boschniakia rossica ethanol extract;Nuclear transcription factor κB/p65;Inflammatory cytokines
10.3969/j.issn.1672-5069.2014.05.018
523008广东省东莞市人民医院感染病科(何松美,刘旭明,殷思纯);肿瘤科(吴煜良);广东医学院基础学院生理科学实验室(刘霞);广东医学院附属医院感染病科(龙尧)
何松美,女,34岁,硕士研究生,主治医师。主要从事病毒性肝炎及常见传染病的诊治研究。E-mail:270951394@qq.com
