水稻抗逆相关基因的分子进化分析
2014-05-25宋晓军谢凯斌张艳萍金萍
宋晓军,谢凯斌,张艳萍,金萍
1. 青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,青岛 266109;
2. 南京师范大学生命科学学院,比较基因组学与生物信息学实验室,南京 210023;
3. 南京师范大学教师教育学院,南京 210023
水稻抗逆相关基因的分子进化分析
宋晓军1,2,谢凯斌3,张艳萍1,金萍2
1. 青岛农业大学生命科学学院,山东省高校植物生物技术重点实验室,青岛 266109;
2. 南京师范大学生命科学学院,比较基因组学与生物信息学实验室,南京 210023;
3. 南京师范大学教师教育学院,南京 210023
植物在进化过程中为了适应外界环境,已经具有一套完整的抵抗外界特殊环境的调控系统。但是,关于水稻抗逆相关基因的分子进化方面的研究还未见报道。文章通过Plant Tolerance Gene Database数据库,获得22个水稻抗逆相关基因。利用比较基因组学和生物信息学方法对水稻抗逆相关基因的进化动态进行研究,结果表明水稻抗逆相关基因在低等植物中比较保守;随着植物的不断进化和生存环境的改变,其基因数量也随之增加。具有相似抗性功能的基因往往具有相似的基因结构和基序(motif)结构。文章还发现4个保守motif 的存在:HRDXK、DXXSXG、LLPR和GXGXXG(X代表任意氨基酸)。在GSK1、RAN2抗逆基因中发现了3个特有的motif结构:GSK1特有的P-rich motif,RAN2特有的G-rich motif和E-rich motif。推测这些保守的motif结构与基因的抗逆功能密切相关。进化速率分析结果表明,尽管植物抗逆性相关基因在进化过程中受到较强的纯化选择作用,但是仍然有50%的抗逆性相关基因存在正选择位点。这些正选择位点的存在有可能为基因适应外界环境变化提供了重要的物质基础。
水稻;抗逆相关基因;进化;选择压力
植物在生长发育过程中经受着各种生物和/或非生物逆境胁迫(干旱、盐碱、高温、低温及各种病虫害等)的影响,但通常情况下,植物都能够正常生长。这主要是因为植物在漫长的进化过程中形成了一整套自身防御体系,能够通过调节自身的各种生理生化活动以适应外界环境的胁迫,减少或消除逆境对植物本身造成的伤害[1,2]。植物对逆境胁迫的应答反应是一个多基因、多基因表达产物和多信号传导途径参与的复杂过程。其中,蛋白激酶(Protein kinase)是植物体内一类重要的调节因子,通过膜受体蛋白激酶感知外界环境胁迫信号,导致细胞内一些离子和分子浓度改变,如脱落酸(ABA)、Ca2+、Na+/K+和水杨酸(SA)等[3~8]。蛋白激酶存在于少数原核生物和绝大部分真核生物中。目前已研究的与植物非生物及生物胁迫应答有关的植物蛋白激酶主要有:受体蛋白激酶(Receptor-like kinase, RLK),主要参与抗旱、抗盐、抗寒等生物胁迫过程;钙依赖而钙调素不依赖的蛋白激酶(Calcium-dependent and calmodulin independent protein kinase, CDPK),主要参与抗旱、抗盐、抗寒等多种信号的传导及激素代谢过程;促分裂原活化蛋白激酶(Mitogen-axtivated protein kinase, MAPK),主要参与抗旱、抗盐、抗寒、以及抗病原反应和细胞周期调节等多种信号传导过程;蔗糖不发酵相关蛋白激酶(Sucrosenon-fermenting-1-related protein kinase, SnRK),主要参与渗透胁迫、抗盐、抗寒等的信号传导过程[9~14]。
目前,大量的研究结果发现在植物体内存在着抗逆相关的基因。冰草(Agropyron cristaturn)的水孔蛋白 MIP2A 可能控制水分从冰草的木质部薄壁细胞流向冰草的木质部导管腔内;野生马铃薯(Solanum chacoense)水孔蛋白ScPIP2a与果实成熟过程中细胞的扩张有关;向日葵(Helianthus angustifolius)的液泡水孔蛋白SunTIP7在干旱胁迫下能够大量表达[15~17]。另外,干旱能够造成植物体内的ATP含量降低,导致Rubisco活化酶活性的降低。为减小干旱胁迫对植物的伤害,Rubisco活化酶的表达会增加[18]。LEA 蛋白在寒冷、重金属、高盐、干旱等逆境刺激和植物胚胎发育后期的种子中均能大量积累[19,20]。近年来研究结果发现,水稻(Oryza sativa)株系中的LEA2蛋白有较强的抗脱水作用,水稻HVA1蛋白可防止干旱胁迫对细胞膜的损伤。大麦(Hordeum vulgare) HVA1蛋白(LEA3同源蛋白)与种子的脱水有关,且在干旱、盐胁迫等逆境环境诱导时 HVA1基因能够迅速地在幼苗中表达[21]。植物抗低温环境主要是脱水蛋白基因、超氧化物歧化酶(SOD)基因、脂肪酸去饱和酶基因、植物抗冻蛋白(AFP)基因等起作用[22]。研究结果表明,蜜桔(Citrus reticulata)CuCOR19基因(一种脱水蛋白)能够清除植物体内多余的羟基和过氧化物自由基,将蜜桔CuCOR19基因转化到烟草(Nicotiana tabacum)中可有效提高烟草的抗冻能力[23]。将拟南芥(Arabidopsis thaliana)FeSOD基因转到玉米(Zea mays)植株中能够使玉米的抗低温的能力显著增强。对植物抗低温的研究有助于降低低温对植物的伤害,通过转基因技术能够明显的提高农作物在低温环境下的产量[24]。当拟南芥幼苗处于高盐环境中时,P5CR基因和P5CS基因的表达水平将迅速升高。将乌头叶豇豆(Vigna aconitifolius)P5CS基因转入烟草中,发现转基因烟草植株脯氨酸含量明显增高,抗高盐环境的能力也明显提高[25]。
综上所述,植物对逆境环境的应答是一个错综复杂的过程,涉及到不同的基因和信号通路。但目前关于植物抗逆相关基因的起源与进化问题仍没有相关报道。本研究利用比较基因组学和生物信息学的方法,系统地探讨了水稻抗逆相关基因在不同类群植物(从藻类到被子植物)中的分布以及这些基因的起源与进化历程,使人们更好地了解植物在逆境存活的关键因素,有利于指导农业生产。本研究结果为进一步了解抗逆相关基因的功能与演化历程奠定了基础。
1 材料和方法
1.1 水稻抗逆基因的收集
本研究所使用的水稻抗逆基因来自于 Plant Tolerance Gene Database数据库(http://rich.yunda.org/ test/rg01/index.php)。共收集22条基因,其中包含抗旱、抗冻和抗寒相关基因。详细信息见表1。
1.2 水稻抗逆基因同源基因的搜索
使用Blastp和tBlastn算法搜索水稻抗逆基因的同源基因。首先以水稻的抗逆基因作为query,在莱茵衣藻(Chlamydomonas reinhardtii)、小立碗藓(Physcomitrella patens)、江南卷柏(Selaginella moellendorffii)和拟南芥基因组中搜寻水稻抗逆基因的同源基因。这5个物种的进化关系(图1)来源于NCBI数据库。然后利用搜索得到的最优基因序列在水稻基因组中进行同源搜索,如果两次Blast结果都是最优匹配,则认为是同源基因。此外,还要进行保守结构域的预测,要求结构域相同或相似。
1.3 抗逆基因的同源比对、保守motif预测和系统
发育关系的重建
利用CLUSTALX和MUSCLE软件对抗逆相关基因进行多序列比对,所有参数使用默认值,如有需要则进行手动的修改。使用MEME在线软件(http: //meme.nbcr.net/meme/cgi-bin/meme.cgi)对抗逆基因进行保守motif预测。其中最小长度为6 bp,最大长度为30 bp,寻找的最多motif数为15个,其他参数为默认值。使用MEGA5中提供的Neighbor-joining(NJ)算法对抗逆基因进行系统发育关系的重建,Bootstrap值设为1000次。
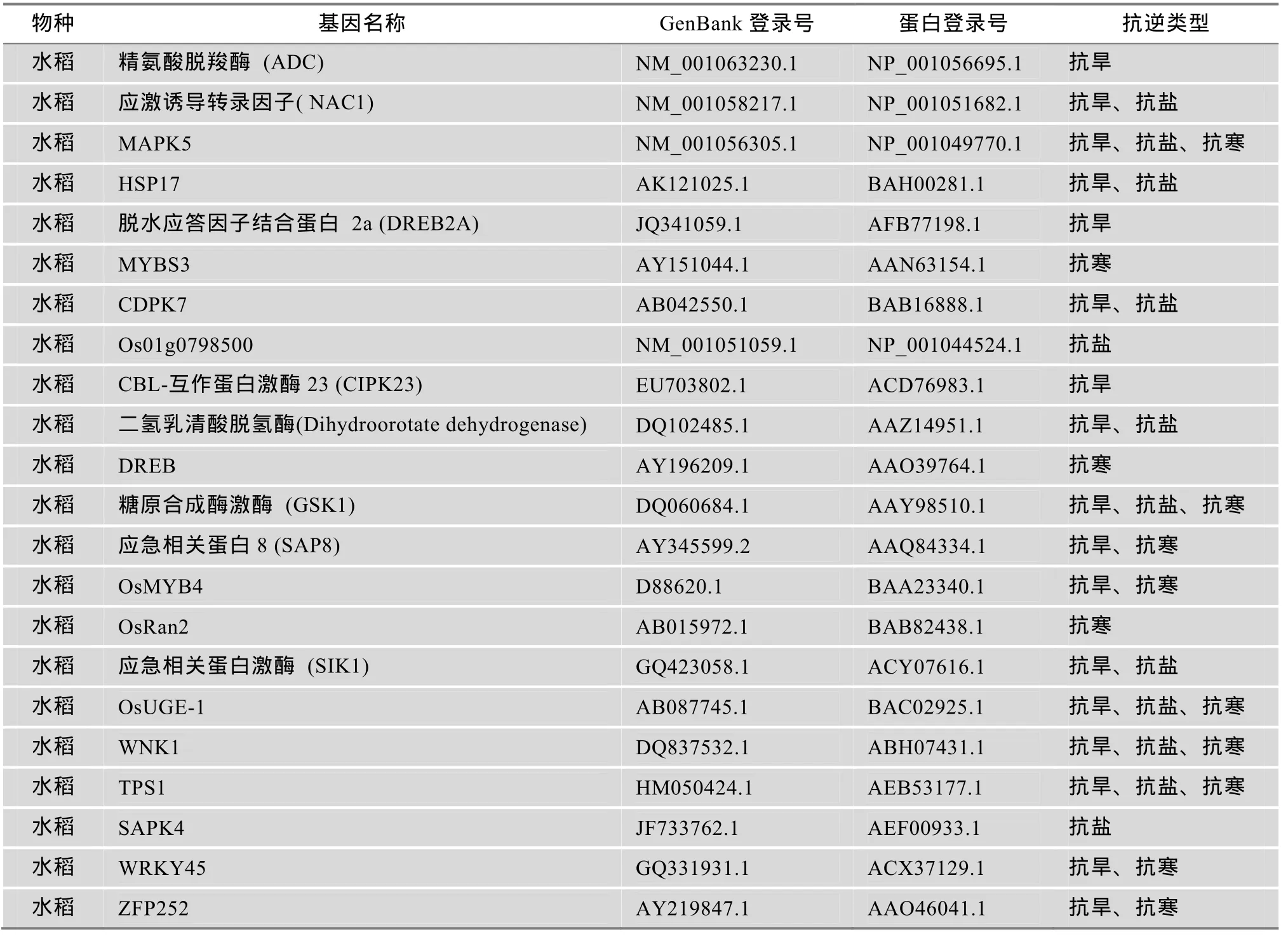
表1 水稻中抗性相关基因和蛋白的基本信息

图1 本研究所使用5个物种的系统发育关系
1.4 抗逆基因的进化速率分析
为了计算抗逆基因的进化速率,使用PAML软件包提供的codeml软件对5个物种的抗逆基因进行进化速率的计算。
基因的进化速率(ω)=非同义替代速率(dn)/同义替代速率(ds)
如果ω > 1,说明该基因受到正选择;ω = 1,说明该基因受到中性选择;ω < 1,说明该基因受到负选择或纯化选择。使用M0模型、M1a模型、M2a模型、M7模型、M8模型对抗逆基因的选择压力进行计算,并使用M1a vs. M2a和M7 vs. M8对抗逆基因序列中存在的正选择位点进行评估。利用2ΔL对它们的参数进行评估,并估算P值的范围。
2 结果与分析
2.1 抗逆基因在植物中的保守性
本文在Plant Tolerance Gene Database数据库中共收集了22条与水稻抗逆相关的基因,其中抗旱基因17条、抗寒基因11条和抗盐基因12条。同时发现,同一个抗逆基因可以同时具有多种抗逆作用(表1)。利用 Blastp和 tBlastn对莱茵衣藻、小立碗藓、江南卷柏和拟南芥基因组进行抗逆基因同源搜索,发现在藻类植物莱茵衣藻中存在 14条抗逆相关的基因,在苔藓植物小立碗藓中存在20条抗逆相关的基因,在蕨类植物江南卷柏、单子叶植物水稻、双子叶植物拟南芥中都存在22条抗逆相关的基因。在低等的藻类植物中,14条抗逆基因的功能包括抗旱作用、抗寒作用和抗盐作用,与高等植物水稻和拟南芥的抗逆功能的种类相似(表2)。因此,在低等植物中同样也存在对干旱环境、低温环境和高盐环境的生理调控机制,以适应极端环境下的生长发育。随着植物的进化以及植物生存条件的多样,植物抗逆基因的种类和数量都逐渐增加。
2.2 相似抗逆功能的基因具有相似特点
为了研究水稻抗逆相关基因的进化过程,本文使用 MEGA5软件对莱茵衣藻、小立碗藓、江南卷柏和拟南芥相应的抗逆相关的同源基因进行系统发育关系的重建。结果表明,具有相似抗逆性的基因更容易聚集在一起(图2)。但MYB、ZFP、WRKY45等基因没有聚集在相应簇中,可能的原因是:(1)该基因在进化中发生了较大的变化,使其序列发生了较大的变化;(2)该基因有可能具有其他抗性,只是现在还没有发现他们的新的抗性功能;(3)该基因没有得到全长,或者基因组测序和基因组注释有问题。但可以肯定的是,具有相同抗性的基因在进化上具有相似的氨基酸序列结构或者相似的空间结构。因此,为了研究抗逆基因间序列上的相似性,本文利用在线软件MEME(http://meme.nbcr.net/meme/cgi-bin/ meme.cgi)对所有抗逆相关的基因进行了保守 motif的预测和分析。结果发现,在这些基因中有4个比较保守的motif 存在:HRDXK、DXXSXG、LLPR和GXGXXG(X代表任意氨基酸)(图3)。其中HRFXK motif包含MAPK5、CIPK23、WNK1、SIK1、CDPK7、SAPK4、GSK1和RAN2共8个基因。这8个基因除SAPK4和RAN2外,都与抗旱、抗盐和抗寒至少两项功能相关。SAPK4与抗盐功能相关,RAN2与抗寒功能相关。由于它们具有相似的motif结构,因此可以推测SAPK4和RAN2有可能具有其他的抗逆功能。DXXSXG motif包含CDPK7、GSK1、MAPK5、SAPK4、CIPK23、WNK1和SIK1共7个基因。LLPR motif包含GSK1、CIPK23、MAPK5、SAPK4、CDPK7和WNK1共6个基因。GXGXXG motif包含GSK1、WNK1、CDPK7、MAPK5、Dihydroorotate dehydrogenase、SIK1、DREB2A、CIPK23和SAPK4共9个基因。这几个motif的具体功能还需要实验的进一步验证。
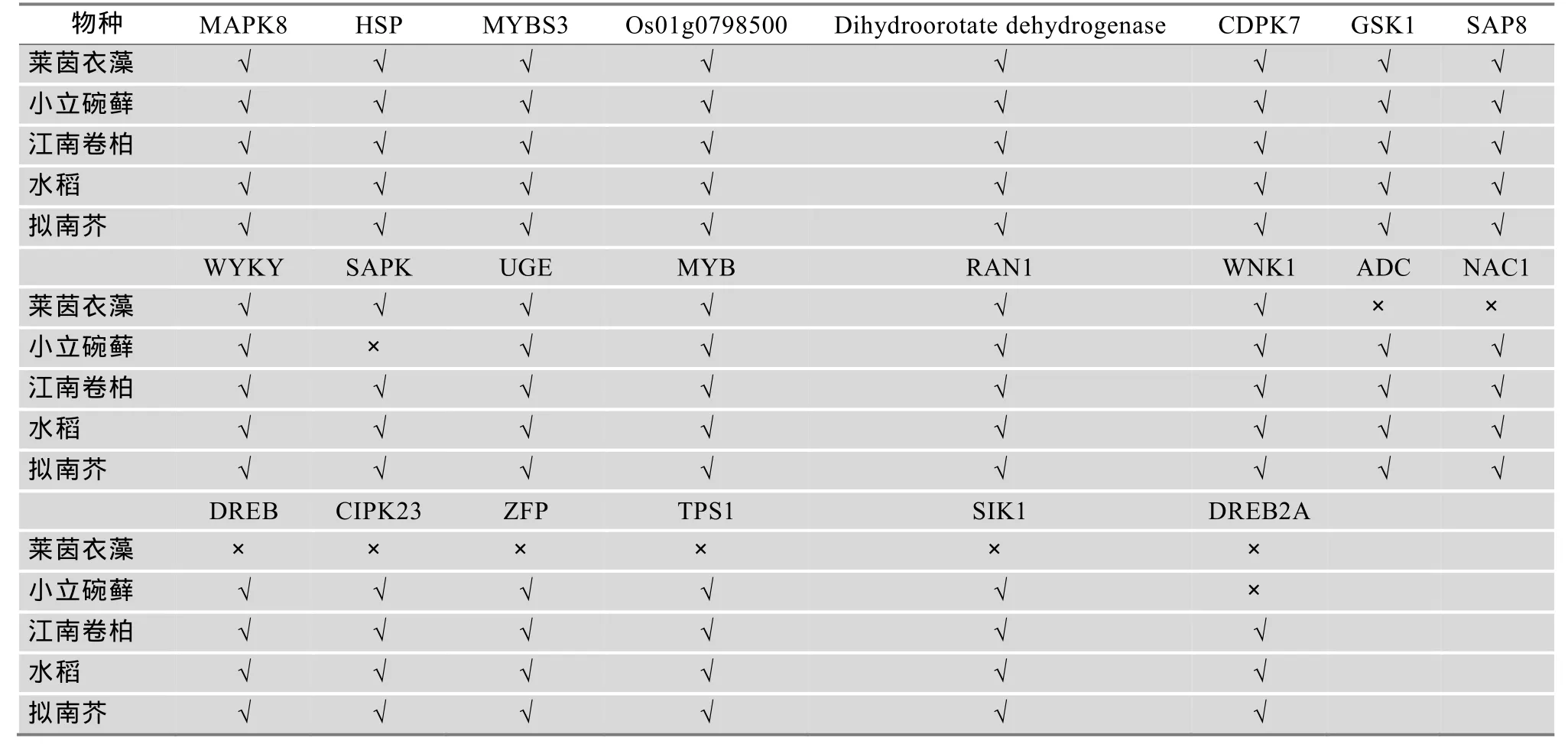
表2 其他物种中与水稻抗性相关基因同源的基因分布

图2 利用Neighbor-joining (NJ)法重建5个物种的抗逆相关基因的系统发育关系■:抗旱基因;△:抗寒基因;●:抗盐基因。Bootstrap值设为1000,置信值小于50的被删除。
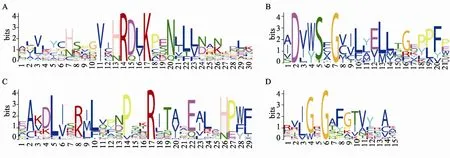
图3 利用MEME软件对所有抗逆相关基因的保守motif进行预测所得到的Weblogo比对图A:HRDXK motif;B:DXXSXG motif;C:LLPR motif;D:GXGXXG motif(X代表任意氨基酸)。其中最小长度为6 bp,最大长度为30 bp,寻找的最多motif数为15个,其他参数为默认值。
在motif预测和分析过程中发现了3个GSK1和 RAN2所特有的motif结构:P-rich motif、G-rich motif和E-rich motif(图4),从藻类植物到双子叶植物都非常保守。保守的motif结构往往与基因的特定功能之间有一定的直接关系,因此3个motif的存在可能与GSK1和RAN2基因某些特定的功能相关。

图4 抗逆基因GSK1、RAN2特有的motif结构A:GSK1特有的motif结构(P-rich motif);B:RAN2特有的motif结构(G-rich motif)。C:RAN2特有的motif结构(E-rich motif)。
2.3 抗逆相关基因中存在着正选择位点
为了探索植物抗逆相关基因在进化过程中受到的自然选择压力,本文使用 PAML软件包提供的 codeml软件对抗逆基因进行进化速率的研究。M0模型结果表明:抗逆相关基因在进化过程中受到较强的纯化选择,进化速率远远小于 1,说明这些抗逆基因都具有功能(图5)。其中,抗旱基因的进化速率从0.00163(Dihydroorotate dehydrogenase)到0.06242 (ZFP);抗盐基因的进化速率从0.00163(Dihydroorotatedehydrogenase)到 0.05768(Os01g0798500);抗寒基因的进化速率从0.00203(TPS1)到0.06242(ZFP)。

图5 植物抗逆性基因在进化过程中受到的选择压力A:抗旱基因在进化过程中的进化速率;B:抗盐基因在进化过程中的进化速率;C:抗寒基因在进化过程中的进化速率。

表 3 利用不同模型检测抗性相关基因正选择位点的数目
整条基因在进化过程中受到较强的纯化选择时,在这些基因中往往还存在着发生正选择的位点。因此,本文使用codeml软件的M1a模型、M2a模型、M7模型和M8模型对植物抗逆相关的基因进行正选择位点的分析。尽管不是所有的抗逆相关的基因都存在正选择的位点,但是本文找到了11条基因存在着正选择位点,占所有抗逆基因的50%(表3)。正选择位点往往与适应性进化、基因结构的改变、保守motif的进化、保守结构域的进化之间存在着重要的关系。
为了探索不同抗逆基因之间的进化速率,使用T检验对不同抗逆相关基因受到的进化速率进行统计学分析。结果表明,不同抗逆功能的基因受到的选择压力之间没有显著性的差异(抗旱基因与抗盐基因比较:P=0.44;抗旱基因与抗寒基因比较:P=0.33;抗盐基因与抗寒基因比较:P=0.38)。另外,在具有不同抗逆性种类数目的基因之间也不存在显著的差异(3种抗逆功能基因与2种抗逆功能基因比较:P=0.48;3种抗逆功能基因与1种抗逆功能基因比较:P=0.31;2种抗逆功能基因与1种抗逆功能比较:P=0.29)。这可能是由于这些抗逆相关的基因存在于基因组的不同位置,在进化上相对独立或者他们之间的相互影响较小造成的。
3 讨 论
植物在进化过程中为了适应外界环境必须要具有一套完整的抵抗外界特殊环境的调控系统。植物抗逆性相关基因的存在为植物适应某些极端的外部环境提供了保障。目前,大部分研究主要集中在植物抗逆相关基因或蛋白的结构与功能方面,很少涉及到植物抗逆性相关基因的进化研究。本研究基于Plant Tolerance Gene Database数据库信息,对22个与水稻抗逆相关的基因进行了分子进化分析。
同源性分析表明,从低等植物藻类开始,抗逆性相关基因就已经存在,在藻类植物莱茵衣藻中存在14条与水稻抗逆相关的同源基因。这个结果暗示植物抗逆性相关基因在进化上是比较保守的,随着物种生存环境的不断变化,植物在进化过程中又产生了新的抗逆性相关的基因。系统发生分析显示,植物具有相似抗逆性的基因更容易聚集在一起,而且抗逆性相关的基因家族随着植物从低等到高等的进化也在不断的扩大,以适应新的环境。
植物抗逆相关蛋白一般都具有特定的标志性的结构域,研究发现植物丝氨酸/苏氨酸蛋白激酶包含3个保守的motif,分别为:HRDXKXXN、GTXXYXAPE和DVXSXG[26,27]。脱水素蛋白是一类非常重要的冷调控蛋白,是植物胚胎发育后期丰富蛋白(Late embryogenesis abundant, LEA)。目前的研究表明,所有的脱水素蛋白分子中至少含有 1个以上的赖氨酸重复序列(K-segment)[28]。K-segment通常位于氨基酸序列的羧基端,它们有一个共同的序列 EKKGIMDKIKEKLPG[28~30]。脱水素蛋白除了含有1-11个重复的 K-segment外,还包含一个保守的区域 Y-segment(序列为V/TDEYGNP),它在氨基酸的氨基端和S-segment(成串的丝氨酸区域)附近,含有多个丝氨酸残基,可以通过磷酸化发挥功能[28,29]。本研究对22个水稻抗逆基因进行了保守motif的预测和分析。结果发现,具有相似抗逆功能的基因在基因结构上具有相似的特征。这些抗逆基因中有4个比较保守的motif 存在:HRDXK、DXXSXG、LLPR和GXGXXG (X代表任意氨基酸)(图3)。MAPK5、CIPK23、WNK1、SIK1、CDPK7、SAPK4、GSK1和RAN2等8个基因中包含HRFXK motif,这8个基因除了SAPK4和RAN2外,都与抗旱、抗盐和抗寒至少两项功能相关。由于它们具有相似的motif结构,推测SAPK4和 RAN2也应该与抗盐和抗寒功能相关。此外,CDPK7、GSK1、MAPK5、SAPK4、CIPK23、WNK1、SIK1等7个基因包含DXXSXG motif。GSK1、CIPK23、MAPK5、SAPK4、CDPK7、WNK1等6个基因包含LLPR motif。GSK1、WNK1、CDPK7、MAPK5、Dihydroorotate dehydrogenase、SIK1、DREB2A、CIPK23、SAPK4共9个基因包含GXGXXG motif。这些结果暗示具有相似抗逆性的植物基因在进化中出现了比较保守的motif结构,这些保守的motif结构有可能是基因演化出抗逆功能的基本单元。保守的 motif结构往往与基因的特定功能之间有一定的关联,因此本研究结果对进一步通过保守 motif结构在水稻基因组中寻找新的抗逆基因以及功能验证具有重要的启示。对这些保守motif功能的深入研究有助于更好的解释植物抗逆性基因的功能多样性和进化历程。
在进化过程中,植物基因往往受到较强的纯化选择作用。为了阐明水稻抗逆相关基因在进化过程中受到的自然选择压力,本文对水稻抗逆相关基因受到的进化速率进行了分析。结果表明,水稻抗逆相关基因在进化过程中受到较强的纯化选择,进化速率远远小于1(0.00163~0.06242),然而对水稻抗逆相关的基因进行正选择位点的分析发现,11个基因存在着正选择位点,占所有水稻抗逆基因的50%(表3)。正选择位点的存在为水稻抗逆基因对外界环境变化适应提供了重要的基础。
[1] Chaves MM, Pereira JS, Maroco J, Rodrigues ML, Ricardo CPP, Osório ML, Carvalho I, Faria T, Pinheiro C. How plants cope with water stress in the field? Photosynthesis and growth. Ann Bot, 2002, 89(7): 907-916.
[2] Smékalová V, Doskočilová A, Komis G, Šamaj J. Crosstalk between secondary messengers, hormones and MAPK modules during abiotic stress signalling in plants. Biotechnol Adv, 2014, 32(1): 2-11.
[3] Valliyodan B, Nguyen HT. Understanding regulatory networks and engineering for enhanced drought tolerance in plants. Curr Opin Plant Biol, 2006, 9(2): 189-195.
[4] Singh KB, Foley RC, Oñate-Sánchez L. Transcription factors in plant defense and stress responses. Curr Opin Plant Biol, 2002, 5(5): 430-436.
[5] Xing HT, Guo P, Xia XL, Yin WL. PdERECTA, a leucine-rich repeat receptor-like kinase of poplar, confers enhanced water use efficiency in Arabidopsis. Planta, 2011, 234(2): 229-241.
[6] Lee SK, Kim BG, Kwon TR, Jeong MJ, Park SR, Lee JW, Byun MO, Kwon HB, Matthews BF, Hong CB, Park SC. Overexpression of the mitogen-activated protein kinase gene OsMAPK33 enhances sensitivity to salt stress in rice (Oryza sativa L.). J Biosci, 2011, 36(1): 139-151.
[7] Munns R, Tester M. Mechanisms of salinity tolerance. Annu Rev Plant Biol, 2008, 59: 651-681.
[8] Tuteja N. Abscisic acid and abiotic stress signaling. Plant Signal Behav, 2007, 2(3): 135-138.
[9] Coello P, Hey SJ, Halford NG. The sucrose non-fermenting-1-related (SnRK) family of protein kinases: potential for manipulation to improve stress tolerance and increase yield. J Exp Bot, 2011, 62(3): 883-893.
[10] Wernimont AK, Artz JD, Finerty P Jr, Lin YH, Amani M, Allali-Hassani A, Senisterra G, Vedadi M, Tempel W, Mackenzie F, Chau I, Lourido S, Sibley LD, Hui R. Structures of apicomplexan calcium-dependent protein kinases reveal mechanism of activation by calcium. Nat Struct Mol Biol, 2010, 17(5): 596-601.
[11] Tör M, Lotze MT, Holton N. Receptor-mediated signalling in plants: molecular patterns and programmes. J Exp Bot, 2009, 60(13): 3645-3654.
[12] Liu Y, Li X, Tan H, Liu M, Zhao X, Wang J. Molecular characterization of RsMPK2, a C1 subgroup mitogen-activated protein kinase in the desert plant Reaumuria soongorica. Plant Physiol Biochem, 2010, 48(10-11): 836-844.
[13] Rodriguez MCS, Petersen M, Mundy J. Mitogen-activated protein kinase signaling in plants. Annu Rev Plant Biol, 2010, 61: 621-649.
[14] Taj G, Agarwal P, Grant M, Kumar A. MAPK machinery in plants: recognition and response to different stresses through multiple signal transduction pathways. Plant Signal Behav, 2010, 5(11): 1370-1378.
[15] Vera-Estrella R, Barkla BJ, Bohnert HJ, Pantoja O. Novel regulation of aquaporins during osmotic stress. Plant Physiol, 2004, 135(4): 2318-2329.
[16] O'Brien M, Bertrand C, Matton DP. Characterization of a fertilization-induced and developmentally regulated plasma-membrane aquaporin expressed in reproductive tissues,in the wild potato Solanum chacoense Bitt. Planta, 2002, 215(3): 485-493.
[17] Sarda X, Tousch D, Ferrare K, Legrand E, Dupuis JM, Casse-Delbart F, Lamaze T. Two TIP-like genes encoding aquaporins are expressed in sunflower guard cells. Plant J, 1997, 12(5): 1103-1111.
[18] Ali GM, Komatsu S. Proteomic analysis of rice leaf sheath during drought stress. J Proteome Res, 2006, 5(2): 396-403.
[19] Cheng ZQ, Targolli J, Huang XQ, Wu R. Wheat LEA genes, PMA80 and PMA1959, enhance dehydration tolerance of transgenic rice (Oryza sativa L.). Mol Breed, 2002, 10(1-2): 71-82.
[20] Goyal K, Walton LJ, Tunnacliffe A. LEA proteins prevent protein aggregation due to water stress. Biochem J, 2005, 388(Pt 1): 151-157.
[21] Straub PF, Shen QX, Ho TD. Structure and promoter analysis of an ABA-and stress-regulated barley gene, HVA1. Plant Mol Biol, 1994, 26(2): 617-630.
[22] Wisniewski M, Webb R, Balsamo R, Close TJ, Yu XM, Griffith M. Purification, immunolocalization, cryoprotective, and antifreeze activity of PCA60: a dehydrin from peach (Prunus persica). Physiol Plant, 1999, 105(4): 600-608.
[23] Hara M, Fujinaga M, Kuboi T. Radical scavenging activity and oxidative modification of citrus dehydrin. Plant Physiol Biochem, 2004, 42(7-8): 657-662.
[24] Duman JG, Olsen TM. Thermal hysteresis protein activity in bacteria, fungi, and phylogenetically diverse plants. Cryobiology, 1993, 30(3): 322-328.
[25] Kishor PBK, Hong Z, Miao GH, Hu CAA, Verma DPS. Overexpression of [delta]-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants. Plant Physiol, 1995, 108(4): 1387-1394.
[26] Stone JM, Walker JC. Plant protein kinase families and signal transduction. Plant Physiol, 1995, 108(2): 451-457.
[27] Dar AC, Shokat KM. The evolution of protein kinase inhibitors from antagonists to agonists of cellular signaling. Annu Rev Biochem, 2011, 80: 769-795.
[28] Close TJ. Dehydrins: a commonalty in the response of plants to dehydration and low temperature. Physiol Plant, 1997, 100(2): 291-296.
[29] Close TJ. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins. Physiol Plant, 1996, 97(4): 795-803.
[30] Campbell SA, Close TJ. Dehydrins: genes, proteins, and associations with phenotypic traits. New Phytol, 1997, 137(1): 61-74.
(责任编委: 张红生)
The molecular evolution of rice stress-related genes
Xiaojun Song1,2, Kaibin Xie3, Yanping Zhang1, Ping Jin2
1. Key Lab of Plant Biotechnology in Universities of Shandong Province, College of Life Science, Qingdao Agricultural University, Qingdao 266109, China;
2. Laboratory for Comparative Genomics and Bioinformatics, College of Life Science, Nanjing Normal University, Nanjing 210023, China;
3. College of Teacher Education, Nanjing Normal University, Nanjing 210023, China
In the processes of evolution, plants have formed a perfect regulation system to tolerate adverse environmental conditions. However, there has not been any report about the molecular evolution of rice stress-related genes. We derived a family of 22 stress-related genes in rice from Plant Stress Gene Database, and analyzed it by bioinformatics and comparative genome method. The results showed that these genes are relatively conservativein low organisms, and their copy numbers increase along with the environmental changes and the evolution. We also found four conserved sequence motifs and three other specific motifs. We propose that these motifs are closely associated with the function of rice stress-related genes. The analysis of selection pressure showed that about 50% rice stress-related genes have positive selection sites, although they were subject to a strong purifying selection. Positive selection sites might be very significant for plants to adapt to environmental changes.
rice; stress-related genes; evolution; selective pressure
2014-03-05;
2014-06-06
江苏省青年基金项目(编号:BK20130902)和江苏省普通高校研究生科研创新计划项目(编号:CXZZ13_0411)资助
宋晓军,博士,讲师,专业方向:功能基因组学与进化生物学。E-mail: sxjwyj@163.com
金萍,博士,讲师,专业方向:功能基因组学与进化生物学。E-mail: jinping8312@gmail.com
10.3724/SP.J.1005.2014.1027
时间: 2014-9-17 17:25
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140917.1725.004.html