海马神经元原代培养方法
2014-05-24肖兴莉杨朝鲜高小青陈秀泸州医学院附属医院神经内科神经生物教研室四川泸州646000
肖兴莉,杨朝鲜,高小青,陈秀(泸州医学院:附属医院神经内科;神经生物教研室,四川泸州646000)
海马神经元原代培养方法
肖兴莉,杨朝鲜1,高小青1,陈秀
(泸州医学院:附属医院神经内科;1神经生物教研室,四川泸州646000)
目的:掌握海马神经元的有效培养方法和细胞保存培养方法,利于细胞模型的建立。方法:取出出生1 d的SD大鼠海马,联合机械吹打法和胰酶消化法分离海马细胞,加入DMEM/F12+10%FBS制备细胞悬液,接种在玻璃培养瓶内1~2 d,收集上清细胞液、离心、重悬细胞;再接种在培养板上,培养1 d后,全液更换为Neurobasal+2%B27,以后每3 d半量换液。利用倒置相差显微镜观察细胞形态变化;利用NF-200、Neu-N抗体免疫荧光、免疫组化技术鉴定海马神经元;利用96孔板培养细胞,计数每个孔海马细胞比例;利用MTT法测定细胞活性。结果:接种在培养板上第1 d细胞贴壁,第3~4 d细胞长出突触,第7~8 d细胞突触生长迅速,第11~13 d细胞交织成网状,第15~20 d细胞生长旺盛,20 d后细胞形态开始改变。免疫荧光技术鉴定细胞突触呈红色,细胞核呈绿色;免疫组化技术鉴定突触和胞核都呈棕黄色。细胞纯度95~97.5%,细胞活性以15~17 d最高(93.94~95.13%),与其他时间点比较,P<0.01。结论:该方法简便可行,节约取材及时间,可获得纯度高、活性好的海马细胞,为后续研究提供实验基础。
海马神经元;原代培养;细胞保存培养
海马是大脑边缘系统的重要结构之一,参与内脏活动和情绪活动的调节,以及个人保存和种族保存的维持,同时与学习记忆活动密切相关,特别是近期记忆。海马是中枢神经系统神经形成的特殊结构[1]。近来研究证明,海马结构早期变化参与Alzheimer'sdisease(阿尔茨海默病,AD)、海马硬化症、痴呆等相关神经元退行性疾病的病理生理过程[2]。正是由于海马结构和功能的重要性,对于它的研究较多,但是在细胞水平和亚细胞结构方面的研究较少,本实验提供了一较好的细胞模型基础,为后续研究做准备。
1 材料与方法
1.1 材料
1.1.1 主要试剂和器材
大鼠抗NF-200单克隆抗体购自武汉博士德生物工程有限公司;兔抗Neu-N单克隆抗体购自武汉博士德生物工程有限公司;胎牛血清(FBS)购自Hyclone公司;胰蛋白酶购自Sigma公司;B27 Serum-Frrsupplement购自Gibco公司;DMEM/F12培养基购自Hyclone公司;多聚-D-赖氨酸(poly-D-lysine)购自Sigma公司;Neurobasal培养液购自Gibco公司;Goatanti-rabbit IgG(H+L)FITC conjugated购自北京博奥森生物技术有限公司,罗丹明标记山羊抗小鼠IgG购自北京中杉金桥;抗荧光淬灭封片液(强)购自碧云天生物技术研究所;MTT购自Sigma公司;青霉素-链霉素购自北京博奥森生物技术有限公司;培养板、培养瓶若干。
1.1.2 实验动物
新生24h的SD大鼠2只,购自泸州医学院实验动物中心。
1.2 主要试剂
1.2.1 主要试剂的配置
①细胞爬片液的配置:用购自Sigma公司的poly-D-lysine原液分装,以1∶10的比例用0.01mol/L的PBS液配置,4°C保存备用;②FBS的灭活:FBS用10m l的离心管分装备用,-20°C保存。用前先在37°C溶解,再在55°C~60°C下灭活30min;③细胞种植液和无血清培养液的配置:DMEM/F12+10% FBS+1%青霉素-链霉素;Neurobasal+2%B27+1%青霉素-链霉素;4°C保存备用;④一抗和二抗的配置:NF-200、Neu-N、Goatanti-rabbit IgG(H+L)FITC conjugated、罗丹明标记山羊抗小鼠IgG分别用0.01 mol/L的PBS稀释至1∶300、1∶100,一抗-20°C保存备用;二抗现用现配。
1.2.2 细胞爬片的制备
选择与培养板大小合适的盖玻片,清洗、泡酸过夜、消毒、烘干。分别放入培养板内,每个盖玻片上滴一滴爬片液、铺匀、37°C孵箱孵育过夜;次日吸出多余的爬片液,用无菌蒸馏水冲洗3遍,让其自然风干,至少4h,备用[3]。
1.2.3 取材
①消毒:用新生SD大鼠2只,先用酒精浸泡1 min,再用碘伏消毒;②固定、暴露、定位:左手固定头部,新生鼠头腹曲,首先用无菌眼科剪把皮肤和颅骨剪开,向前翻;暴露出全部大脑,在其中后1/3的地方轻轻剥离出像月牙状的对称海马组织(见图1);③清洗:放入盛有无菌PBS的培养皿中,剥离脑膜,清洗组织;④剪切、机械吹打、消化:干净后放入无菌的干燥培养皿内,用眼科剪剪碎成稀糊状,再吸入装有组织体积4倍的DMEM/F12培养液的离心管内,用吸管吹打50次左右,静置5min后,吸取上清液,剩下的沉淀再按照相同的比例加入DMEM/F12,再加入等体积的0.25%的胰酶,在常温下,边吹打边观察,液体变得均匀混浊后加入等体积的FBS终止消化。最后配平,1100 r/min离心,收集细胞沉淀。以上都要在冰上操作。
图1 分离出的新鲜海马组织
1.2.4 细胞悬液的制备和接种
收集的细胞加入细胞体积3倍的种植液,吹打混匀,用2%台盼蓝和白细胞计数板粗略检测活细胞浓度,接种在50ml的玻璃培养瓶中。
1.2.5 细胞差速贴壁
细胞接种在培养瓶1~2 d后,收集上清液、1100 r/min离心、收集细胞。同样加入细胞体积3倍的种植液,吹打混匀,用2%台盼蓝和白细胞计数板粗略检测活细胞浓度,1×104~1×105个/L接种300μl的细胞悬液在多聚赖氨酸包被好的24孔培养板上。培养1 d后,全量更换种植液为无血清培养液,此后每3 d半量换液,每天观察细胞的生长情况。
1.2.6 细胞保存培养
对于一次取材太多,为减少取材的次数,不让细胞浪费,可把培养瓶内的细胞在第一次收集后,又重悬细胞悬液,接种在新的培养瓶内,继续贴壁生长,4 d左右又可收集细胞悬液,继续前方法,把贴壁的细胞用胰酶消化收集、离心、重悬、接种在培养板上,如上方法培养。
1.2.7 细胞的鉴定
对生长成熟的海马神经元去除培养基,4%多聚甲醛固定细胞、0.3%Tritonx-100打孔、0.3%H2O2去除过氧化物酶、山羊血清封闭非特异性抗体、一抗NF-200、Neu-N 4°C过夜、荧光二抗闭光室温孵育1 h、免疫荧光检测。
1.2.8 细胞纯度检测
细胞纯度计算:利用96孔板培养细胞,一个孔表示一个视野,计数每个孔海马神经元的比例:每个孔海马神经元总数/每个孔细胞总数×100%,依次得到96个值;采用Excel绘图,直观的看出神经元的纯度百分比分布情况。
1.2.9 活性检测
采用MTT法测定细胞活性。细胞悬液接种在96孔板上,培养不同时间点的海马细胞,吸去培养液后,每个孔加入100~200μl 10%的MTT,培养4 h轻吸去MTT后加入等量的DMSO,在恒温水浴振荡器中震荡10 min,在酶联免疫检测仪上测定吸光度值(同时设定空白对照,即:未加入细胞)[3]。计算方法:细胞生存率=实验组吸光度/对照组吸光度值× 100%;重复10次。
1.3 统计分析
采用SPSS19.0统计分析软件,利用x±s计量分析。各组间比较采用单因素方差分析,用LSD法进行两两比较。按照α=0.05的水准判断是否具有统计学意义。
2 结果
2.1 细胞形态观察(如图2)

图2 不同时间点的细胞形态变化
2.2 NF-200、Neu-N免疫荧光鉴定和免疫组化鉴定(图3)

图3 海马神经元NF-200、Neu-N鉴定
2.3 细胞纯度检测
通过倒置相差显微镜观察96孔板成熟海马神经元(胞体圆、折光性强、立体感强、突起粗大),计算海马神经元的细胞纯度(图4)。
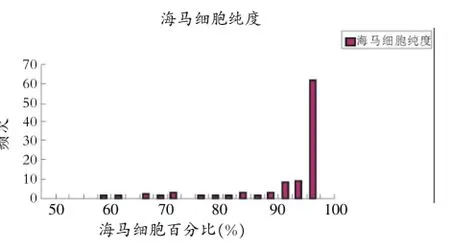
图4 SD大鼠海马细胞纯度频次分布
2.4 细胞活性情况
海马神经元在不同时间点细胞生存率不同,从1~15 d海马神经元生存率逐渐升高;15~17 d大概在平台期,以后细胞生存率降低,迅速凋亡见表1。
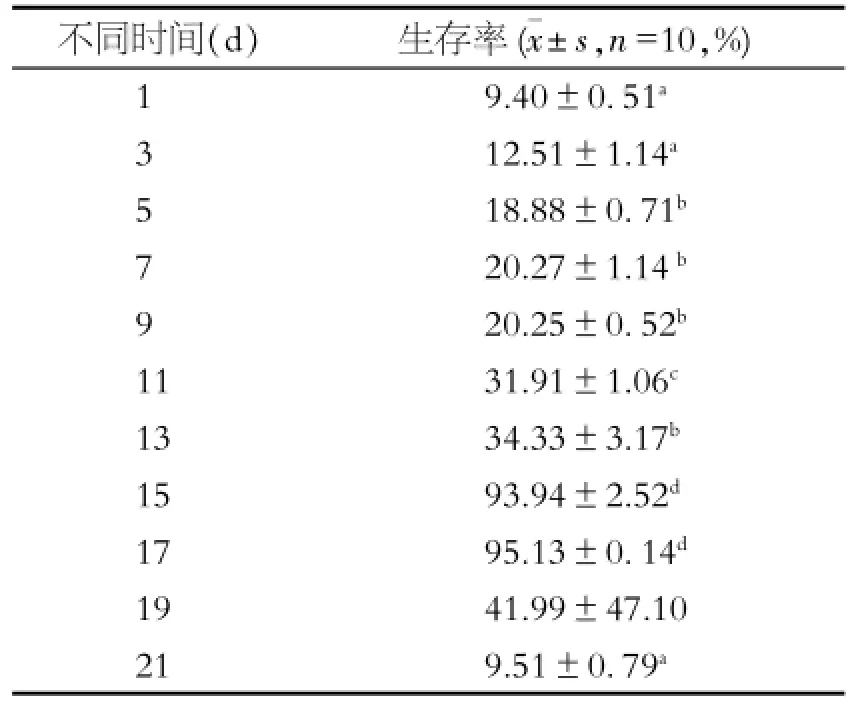
表1 不同时间点海马神经元活性情况
3 讨论
海马是大脑的重要结构之一,体积小、功能多样、位置隐蔽、分层复杂,包含有古皮层(3层)和新皮层(6层),主要有椎体细胞和细颗粒细胞组成,参与大脑边缘系统构成,在神经科学领域对于该系统的研究仍是热点和难点之一[1]。神经系统的任务是接收、发放、处理、存储和提取信息,这些任务都是通过其基本单位——神经细胞来完成。海马神经元就是重要的神经元之一[4]。由于神经元是形态各异、功能复杂、化学性递质繁多的特化细胞,这就决定了神经元培养的特殊性。由于海马组织由神经元和非神经元构成,取材的部位不能完全准确这些原因都会影响神经元的纯度。除此之外,海马细胞原代培养还有取材来源和培养调节苛刻、步骤繁琐、费时等情况。Neurobasal培养基是一种能满足新生和成体脑神经元细胞培养的特殊基础培养基,含有抑制胶质细胞生长的成分,B27是一种神经元生长及维持的添加剂,能够代替血清中的某些成分,故联合使用能提高神经元的纯度和活性。本实验利用成纤维细胞、胶质细胞比神经元贴壁快的原理,即差速贴壁法,能有效的提高神经元的纯度。同时利用玻璃培养瓶联合培养板培养,即细胞的保存培养:在一次取材多时,可以先让细胞在玻璃培养瓶内生长备用,从而解决一次取材少但又要多次取材的难题。
NF-200是神经纤维丝的一种,主要表达在胞浆和突触,参加构成神经细胞的骨架。Neu-N是一种特有的神经元DNA结合蛋白,分子质量46~48 kDa,它的功能还不是很清楚,但Soylemezoglu等研究证实:它是神经系统专有的细胞核调节分子之一[5],它们都是海马神经元特有的结构成分。本实验联合免疫荧光、免疫组化方法对神经元进行细胞核、轴突的鉴定,更具有说服力。
大部分的研究集中在动物组织层面,对于细胞及亚细胞结构的研究尚少。细胞培养的质量直接影响到研究的进展,也将影响到实验结果的真实性和可靠性。为此,本实验就提供了一种稳定、简单、细胞纯度和活性较高的细胞培养方法,为后续研究提供细胞基础。
1.李云庆.Basic Neuroscience[M].北京:高等教育出版社,2010,260~261.
2.Cheng Y,Yu Lc.Galanin Protects Am yloid-β-Induced neurotoxicity on primary cultured hippocampal neurons of rats[J].Journalof Alzheimer'sDisease,2010,10:1143~1157.
3.D.L.斯佩克特,R.D.戈德曼.CellA LaboratoryManual[M].北京:科学出版社2001,953~954.
4.郑志竑,林玲.神经细胞培养:理论与实践[M].北京:科学出版社,2002,4~29.
5.GillSK,IshakM,RyleteRJ,etal.Exposureofnuclearantigens in form alinfixed,paraffin embedded necropsy human spinal cord tissue:Detection of NeuN[J].Journal of NeuroscienceMethods,2005,148:26~35.
(2013-06-28收稿)
Primary culturemethod of hippocam pal neurons
Xiao Xingli,Yang Chaoxian1,Gao Xiaoqing1,Chen Xiu1
Department of Neurology,the Affiliated Hospital of Luzhou Medical College;1Department of Neurological Biology,Luzhou Medical College
Ob jective:To establish an effective culturemethod of hippocampalneuronsand preservable cells for the establishimentof cellmodels.Methods:SD rathippocampal neruons(born 1 day)were isolated bymechanical blow and pancreatic enzyme digestion.DMEM/F12+10%FBSsuspended hippocampalneuronswere inoculated on the glassculture vessels(1~2 days).The upper cellsuspensionwas collected,centrifugated,resuspended and inoculated on orifice plates forone day.Themedium was replaced by Neurobasal+2%B27 every 3 days.Inverted phase contrast microscopewasused toobservecellmorphologicalchangse.Hippocampusneuronalidentificationand cellactivitywere detected with immunocytochemistry and MTT.Resu lts:Hippocampal neuronswere adherent to orifice plates on the firstday.Thecellsynapsesgrew on the3th~4th day.Thecellsynapses reticulateon the11th~13th day.Thecellsgrew especially strongon the 15th~20th day and after the20th day therewas cellapoptosis.The cellsynapsewas red and nucleuswas green thatwas identified with immunofluorescent staining.The cell synapse and nucleuswere brownish yellowwith immunohistochemistry.Theneruon puritywas95%~97.5%.Thecellactivitywas thehighestin the15th~17th day(93.94%~95.13%)compared with other time growps(P<0.01).Conclusion:Our culturemethod is economical and can save a lot of time with simplicility and feasibity.The high purity and activity of hippocampal neuronsprovide theexperimentalbasisfor furtherstudy.
Hippocampalneurons;Primary culture;Preservablecellculture
R741
A
10.3969/j.issn.1000-2669.2014.02.014
肖兴莉(1987-),女,住院医师,硕士生,E-mail:245964222@qq.com
