Aβ1-42诱导HUVEC细胞凋亡最适浓度与时间选择*
2014-05-24蔡鹏飞刘明华冯林林刘俊红尤朝菲章卓泸州医学院科技处药学院药理教研室中药学本科00级四川泸州646000
蔡鹏飞,刘明华,冯林林,刘俊红,尤朝菲,章卓(泸州医学院:科技处;药学院药理教研室;中药学本科00级,四川泸州646000)
Aβ1-42诱导HUVEC细胞凋亡最适浓度与时间选择*
蔡鹏飞,刘明华1,冯林林2,刘俊红2,尤朝菲2,章卓1
(泸州医学院:科技处;1药学院药理教研室;2中药学本科2010级,四川泸州646000)
目的:探讨β样淀粉肽1-42(Aβ1-42)诱导人脐静脉血管内皮细胞株(HUVEC)细胞凋亡的最适浓度和时间。方法:体外培养HUVEC,将Aβ1-42分为5×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L 7个浓度,分别刺激0.5、2、6、12、24、48 h后,采用CCK-8法观察细胞活力,荧光显微镜观察Hochest33342/PI双染后细胞形态。结果:同阴性组比较,Aβ1-42浓度≥5μmol/L刺激48 h均可引起细胞活力明显下降(P<0.05)。5×10,5×102μmol/L刺激24 h可引起HUVEC细胞活力下降,但48h HUVEC细胞活力下降更明显(P<0.05)。Hochest33342/PI双染可见明显核浓缩和凋亡小体的产生,甚至出现死亡现象。结论:Aβ1-42刺激后引起HUVEC细胞活力下降呈时间与剂量依赖性,综合时间与剂量考虑,5×10μmol/L刺激24h可致理想的HUVEC细胞凋亡模型。
β样淀粉肽1-42;HUVEC细胞;细胞凋亡
β-淀粉样蛋白(β-amyloid protein,Aβ)异常沉积、细胞凋亡在阿尔茨海默病(Alzheimerdisease,AD)的发病中起着重要作用,β-淀粉样蛋白由39~43个氨基酸组成,聚集态的Aβ1-42可以导致神经细胞凋亡,损伤神经细胞[1]。血管内皮细胞衬覆于血管内壁,构成血管通透性的主要屏障,有调节细胞代谢产物、调节血管舒张、止血和趋化白细胞的作用[2]。β-淀粉样蛋白致阿尔茨海默病病人血管内皮产生炎症、凋亡在AD的发病中越来越受到重视[3],因此深入探索β-淀粉样蛋白致血管内皮细胞损伤与凋亡规律,寻找保护内皮的措施有重要意义。目前虽然有学者对Aβ1-42致人脐静脉血管内皮细胞(human umbilical vein endothelialcells,HUVEC)凋亡有少量研究,但是尚未对Aβ1-42引起HUVEC凋亡的最适时间和剂量进行研究,故本研究通过对体外培养的人脐静脉内皮细胞施以不同浓度Aβ1-42处理,检测在各时间点的细胞凋亡率,分析不同浓度Aβ1-42诱导内皮细胞凋亡的差异,为深入研究阿尔茨海默病血管内皮损伤的发病机理提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试剂
Aβ1-42(北京奥普森有限公司);HUVEC细胞(泸州医学院功能性食品与药品研究中心惠赠);Annexin V-FITC细胞凋亡检测试剂盒(Keygen公司,批号20101202);Hoechst 33342以及PI(Sigma,USA);RPMI1640培养基,胎牛血清(hyclone,USA);CCK-8试剂盒(碧云天生物技术研究所)。
1.1.2 仪器
超净工作台(苏州净化设备有限公司,SW-CJ-1F型);倒置相差显微镜(日本Olympus公司,CKX41型);CO2培养箱(日本Sanyo公司,MCO-15AC型);离心机(北京医用离心机厂,LG10-3A型);酶标分析仪(北京普朗新技术有限公司,DNM-9602型);流式细胞仪(美国BD公司,SBK-YLQX-003552型)。
1.2 方法
1.2.1 CCK-8法检测HUVEC细胞活性
将Aβ1-42溶于超净水,配成500μmol/L母液分装,-20℃冻存,使用前于37℃孵育1周,使其变为聚集状态。HUVEC细胞株培养液为RPMI1640+10%胎牛血清+青链霉素,5%CO237℃培养箱中培养。每3~4 d传代1次。倒置显微镜观察细胞生长情况。
取对数生长期的HUVEC细胞,0.25%胰酶制成单个细胞悬液,细胞浓度为1×105/L接种于96孔板,每孔90μl,培养24h待其贴壁后加药。每个浓度3个复孔,Aβ1-42组(Aβ1-42+细胞)分为5×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L7个浓度,阴性组(细胞+培养基)加等体积RPMI1640培养基,培养时间为0.5、2、6、12、24、48h,之后每孔加入CCK-810μl继续培养1 h,酶标仪450 nm波长下检测各孔吸光度值,以OD值反应细胞活力情况,连续重复3次。
1.2.2 Hochest33342/PI双染检测HUVEC细胞凋亡
HUVEC细胞培养同1.2.1,根据1.2.1结果,选择Aβ1-425、5×10、5×102μmol/L处理24 h后Hochest33342/PI双染检测HUVEC细胞凋亡。收集细胞悬浮于1ml培养基中,加入10μl Hochest 33342储存液(100mg/L,蒸馏水溶解),染色15min;将细胞置于冰上冷却后,离心,去上清,将细胞重悬于1m lPBS中,加人5μlPI储存液(1g/L,蒸馏水溶解),混匀,荧光显微镜观察。
1.2.3 统计学处理
实验数据以x±s表示,数据分析采用单因素方差分析,组间均值比较采用SNK法。P<0.05表示差异有统计学意义。统计学数据用SPSS13.0软件分析处理。
2 结果
2.1 不同浓度Aβ1-42在不同处理时间对HUVEC细胞活力影响
不同浓度Aβ1-42处理0.5 h与2 h对HUVEC细胞活性没有明显影响,与阴性组比较无统计学差异(P>0.05);5×102μmol/LAβ1-42在处理6、12、24、48h后抑制HUVEC细胞活性,同阴性组比较有统计学意义(P<0.05),其中48 h同阴性对照组比较有显著意义(P<0.01);5×10μmol/LAβ1-42在处理24h,48h后抑制HUVEC细胞活性,同阴性组比较有统计学意义(P<0.05);5μmol/LAβ1-42处理48h抑制HUVEC细胞活性,同阴性对照组比较有统计学意义(P<0.05)。5×10-4、5×10-3、5×10-2、5×10-1μmol/LAβ1-42在各时间段对HUVEC细胞活性无明显影响(P>0.05),见图1。

图1 Aβ1-42不同浓度和不同处理时间对HUVEC细胞活力影响
2.2 不同浓度Aβ1-42诱导HUVEC细胞24 h后细胞形态变化
Hochest33342/PI双染显示,阴性对照组细胞形态呈圆形,淡蓝色,无凋亡细胞。Aβ1-425、5×10、5×102μmol/L三组细胞均可见部分呈凋亡特征性改变,细胞核呈亮蓝色染色,随浓度增加凋亡细胞较多,还可见死亡细胞(红色),见图2。
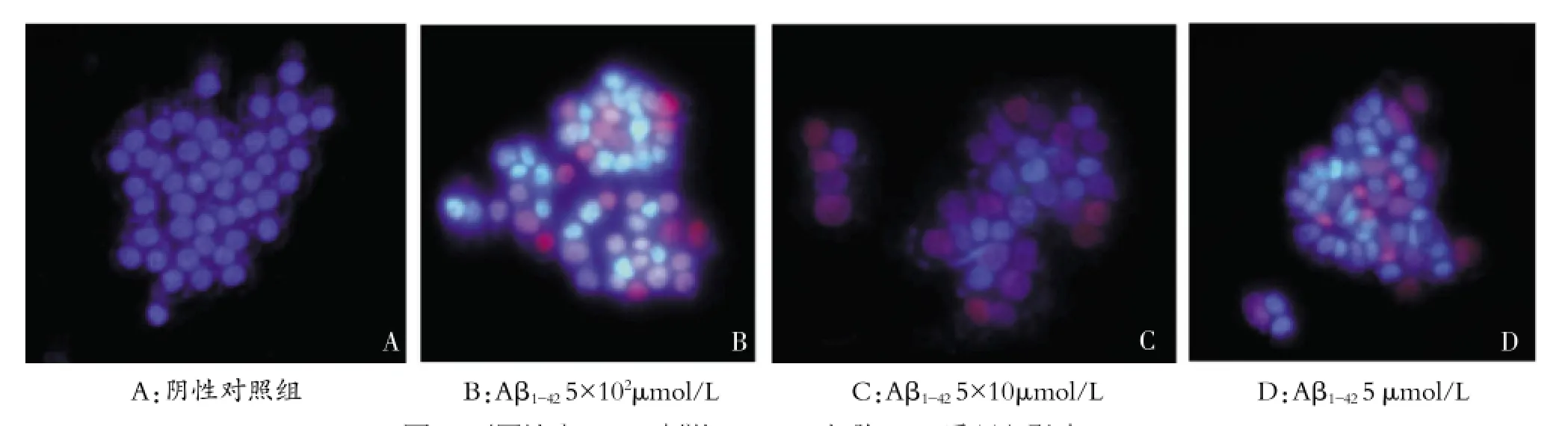
图2 不同浓度Aβ1-42刺激HUVEC细胞24 h后凋亡影响(×200)
3 讨论
阿尔茨海默病患者由于神经元营养的缺乏、缺氧、代谢物堆积、Aβ1-42沉积等出现血管内皮的损伤,Aβ1-42在毛细血管的沉积不仅造成毛细血管的闭塞,并可引起脑血流量的失调。用Aβ1-42损伤原代培养的脑微血管内皮细胞,可以造成内皮细胞连接遭到破坏,细胞连接蛋白受到损伤,毛细血管发生了变性和退化,失去了原来的形状[4-5]。Aβ1-42致HUVEC细胞凋亡可部分模拟阿尔茨海默病的血管内皮损伤,但是对于Aβ1-42刺激的时间与浓度却因实验室不同而存在差异,本实验目的在于筛选出Aβ1-42刺激HUVEC细胞建立损伤凋亡模型的最适浓度和时间。
在本实验中,选择了Aβ1-425×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L 7个浓度及0.5、2、6、12、24、48 h 6个时间点。实验结果显示随浓度增加和处理时间的延长,对HUVEC细胞活性影响较大。所有剂量在处理0.5h与2h后几乎对HUVEC细胞活性没有影响;5μmol/L处理48h可使HUVEC细胞活性受到影响。5×10μmol/L处理时间更短一些,24h可抑制HUVEC细胞生长;5×102μmol/L处理6 h即可抑制HUVEC细胞生长。从上述结果中我们可以看出,Aβ1-425×102μmol/L造模效果最佳,但剂量明显偏大,适合处理时间较短,经济充裕的实验;Aβ1-425×10μmol/L与5μmol/L较为合适,因此可以从经济和时间角度上可以考虑Aβ1-425×10μmol/L刺激24 h造模或者5μmol/L刺激48 h。从Hochest 33342/PI双染结果显示,Aβ1-425、5×10、5×102μmol/L刺激24 h后即可见部分呈凋亡特征性改变,5×10、5×102μmol/L凋亡细胞更多,5×102μmol/L则死亡细胞较多。
综上,Aβ1-42刺激后引起HUVEC细胞活力下降呈时间与剂量依赖性,本实验综合凋亡结果、经济性、时间等多种因素认为,Aβ1-425×10μmol/L刺激24h是致HUVEC细胞凋亡的理想剂量和时间。
1.Ma JF,W ang HM,LiQY,etal.Starvation triggersAbeta42 generation from humanumbilicalvascularendothelialcells[J]. FEBSLett,2010,584(14):3101~3106.
2.Yu H,Yang M,W ang Y,etal.p75NTR ismainly responsible for Aβtoxicity but not for its internalization:a primary study[J].NeurolSci,2012,33(5):1043~1050.
3.Belyaev ND,NalivaevaNN,Makova NZ,etal.Neprilysin gene expression requires binding of the amyloid precursor protein intracellular domain to itspromoter:implications for Alzheimerdisease[J].EMBO Rep,2009,10(1):94~100.
4.Thal DR,Capetillo-Zarate E,Larionov S,et al.Capillary cerebralamyloid angiopathy isassociated w ith vessel occlusionand cerebralblood flow disturbances[J].NeurobiolAging,2009,30(12):1936~1948.
5.SoniaM arco,Stephen D.Skaper Am yloid-peptide l-42 alters tight junction protein distribution and expression in brain m icrovessel endothelial cells[J].Neuroscience Letters,2006,401:219~224.
(2013-9-26收稿)
Screen of theoptim alconcentration and incubution tim eofAβ1-42in inducingapoptosisofHUVEC cell
CaiPengfei,LiuMinghua1,Feng Linlin2,Liu JunHong2,You Caofei2,Zhang Zhuo1
Department of Science and Technology;1Department of Pharmacology;2Undergraduate of Luzhou Medical CollegeChineseMateriaMedicaClass2010,LuzhouMedicalCollege
Objective:To screen the optimal concentration and incubation time ofβ-amyloid 1-42 in inducing apoptosis of Human umbilical vein endothelial cells(HUVEC).Methods:HUVEC were cultivated in vitro.β-amyloid 1-42 was diluted into 5×10-4,5×10-3,5×10-2,5×10-1,5,5×10,5×102μmol/L;the incubation time was set at 0.5,2,6,12,24 and 48 h.The cell viability was observed by CCK-8 and the cell morphology was observed by fluorescencemicroscopy after dyeing with Hochest33342/PI.Resu lts:Compared with negative control group,cell viability of all the groups with Aβ1-42≥5μmol/L after stimulating 48 hours was decreased significantly(P<0.05).The viability of HUVEC incubated with 5×10 and 5×102μmol/Lβ-amyloid 1-42 for 24 hours or 48 hourswas decreased significantly(P<0.05).The nuclear enrichmentand apoptotic body could be observed by Hochest33342/PI.Conc lusion:HUVEC cell viability decreased in a time and dose related way after incubated withβ-amyloid1-42.Considering of the time and dose comprehensively, incubation with 5×10μmol/Lβ-amyloid 1-42 for 24 hours can establish the idealmodel ofHUVEC apoptosis.
β-amyloid 1-42;HUVEC;Apoptosis
R967
A
10.3969/j.issn.1000-2669.2014.02.012
*四川省教育厅课题(102c099);泸州市科技局课题(2012s36)作者简介:蔡鹏飞(1981-),男,讲师,E-mail:35989298@qq.com
章卓(1979-),男,副教授,E-mail:zhhuozhang-100@163.com
