HPLC-ECD法测定大鼠脑组织中单胺类神经递质的含量Δ
2014-05-22韦姗姗陆雪萍彭玲芳屈会化孙晔王庆国北京中医药大学基础医学院北京100029北京中医药大学经典方剂的应用基础研究创新团队北京100029云南省药物研究所昆明650111
韦姗姗,陆雪萍,彭玲芳,屈会化,孙晔,王庆国#(1.北京中医药大学基础医学院,北京 100029;2.北京中医药大学“经典方剂的应用基础研究”创新团队,北京 100029;.云南省药物研究所,昆明 650111)
单胺类神经递质是重要的神经信息传递物质,广泛存在于中枢神经以及外周组织内,主要包括去甲肾上腺素(Norepinephrine,NE)、肾上腺素(Epinephrine,E)、5-羟色胺(5-Hydroxytryptamine,5-HT)等,目前认为精神类疾病与其关系密切[1]。市场上现有的抗抑郁药物主要是基于脑内单胺类神经递质水平过低的机制开发的[2]。因而准确测定脑组织中单胺类神经递质的含量对于抗抑郁药物的药效与机制研究具有重要的意义。目前关于脑内单胺递质的检测方法很多,其中高效液相色谱-电化学(HPLC-ECD)法是报道最多、应用最广的方法。现有文献中流动相主要采用等度洗脱,而NE极性较强,反相柱吸附能力较弱,因而出峰快;而5-HT极性较弱,出峰慢,若采用等度洗脱,存在NE峰分离度差或者5-HT出峰时间过长的问题。因此根据本实验室的条件,笔者建立了一种实用、灵敏、简便的HPLC-ECD梯度洗脱方法,能快速同时测定大鼠不同脑区内NE和5-HT的含量,为进一步研究单胺类神经递质奠定方法学基础。
1 材料
1.1 仪器
e2695高效液相色谱仪及2465电化学检测器(美国Waters公司);5810R高速冷冻离心机(德国Eppendorf公司,离心半径:9.5 cm);AG285电子分析天平(瑞士Mettler Toledo公司);超纯水仪(美国Millipore公司)。
1.2 药品与试剂
NE标准品(哥伦比亚Matrix Scientific公司,批号:037692,供含量测定用);5-HT标准品(批号:91M5163V,供含量测定用)和内标2,5-二羟基苯甲酸(DHBA,批号:MKBG3214V)均购自美国Sigma公司;甲醇为色谱纯,其他试剂均为分析纯,水为高纯水。
1.3 动物
SD大鼠15只,♀,SPF级,体质量300~350 g,由广东省实验动物中心提供,许可证号为:SCXK(粤)2008-0002。
2 方法与结果
2.1 溶液的制备
2.1.1 蛋白沉淀液。取浓高氯酸溶液和乙二胺四乙酸(EDTA)适量,稀释为含高氯酸0.1 mol/L和EDTA 0.1 mmol/L的蛋白沉淀液。
2.1.2 标准品溶液。精密称取NE、5-HT标准品适量,以蛋白沉淀液溶解,分别配制成质量浓度为21 μg/ml和5 μg/ml的贮备液,临用前用蛋白沉淀液稀释成NE质量浓度为0.084、0.252、0.42、0.84、2.1、4.2 μg/ml,5-HT质量浓度为0.005、0.01、0.02、0.1、0.2、0.25 μg/ml的系列标准品溶液。
2.1.3 内标工作液。精密称取DHBA适量,用蛋白沉淀液溶解配制成质量浓度为4 mg/L的溶液。
2.1.4 样品溶液。大鼠脱颈椎处死,开颅迅速取出整个脑组织,分离各脑区,用适量0.9%氯化钠注射液(生理盐水)冲洗,用吸水纸吸干,称质量,以一定比例加入蛋白沉淀液,冰浴下手动匀浆,取匀浆液14000 r/min低温离心30 min,取上清液再14000 r/min低温离心25 min,取一定量上清液按比例加入一定量的内标工作液,即得。
2.2 色谱条件
色谱柱为DIKMA C18(250 mm×4.6 mm,5 μm);流动相:缓冲盐溶液[100 mmol/L醋酸钠、3 mmol/L庚烷磺酸钠、0.2 mmol/L乙二胺四乙酸二钠(EDTA-2Na)、85 mmol/L柠檬酸]-甲醇,梯度洗脱,流速:1.0 ml/min;工作电压:+0.7 V;柱温:25℃;进样量:20µl。流动相洗脱程序见表1。
2.3 系统适用性研究
取NE和5-HT混合标准品溶液+内标、空白溶剂(蛋白沉淀液)进样测定,记录色谱;另取大鼠大脑皮层样品、小脑样品、海马样品、下丘脑样品、嗅球样品,按“2.1.4”项下方法制成溶液,进样测定,记录色谱。结果标准品和脑组织中的各峰形对称,内源性杂质无干扰,NE、内标、5-HT的保留时间分别约为5、8、18 min,NE、5-HT达到良好分离。色谱图见图1。
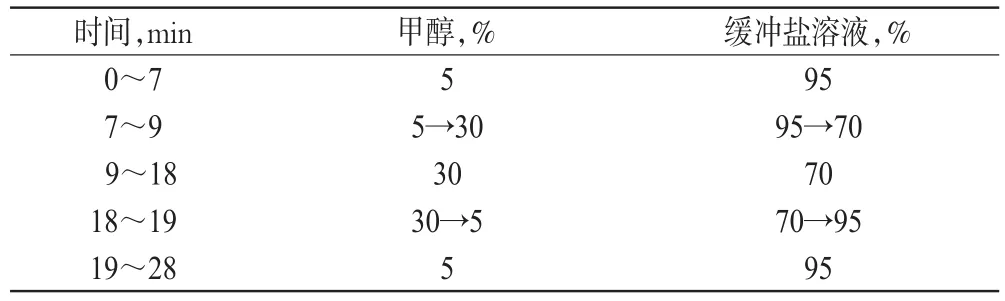
表1 流动相梯度洗脱程序Tab 1 Gradient elution conditions
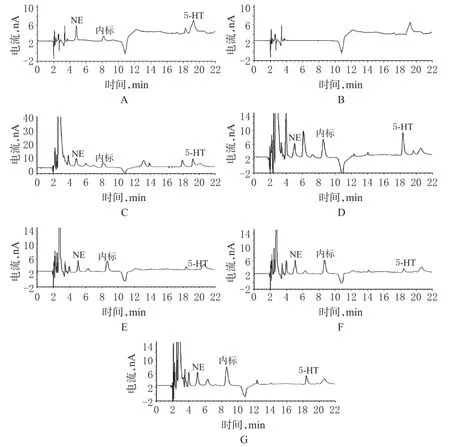
图1 高效液相色谱图A.标准品+内标;B.空白溶剂;C.大脑皮层样品;D.小脑样品;E.海马样品;F.下丘脑样品;G.嗅球样品Fig 1 HPLC chromatogramsA.standard substance+internal standard;B.blank solvent;C.pallium sample;D.cerebellum sample;E.hippocampus samples;F.hypothalamus sample;G.apophysis mamitlaris sample
2.4 线性范围考察
由于脑组织中原本就含有NE、5-HT,故不能直接用脑组织进行线性范围考察。故用蛋白沉淀液将标准品溶液稀释成含 NE 0.084、0.252、0.42、0.84、2.1、4.2 μg/ml,含 5-HT 0.005、0.01、0.02、0.1、0.2、0.25 μg/ml的系列混合标准品溶液,按比例加入内标溶液,进样测定。以质量浓度(x)为横坐标、标准物质的峰面积与内标峰面积的比值(y)为纵坐标进行回归分析。得NE回归方程为y=5.292x-0.1474(r=0.9999),检测质量浓度线性范围为0.084~4.2 μg/ml;5-HT回归方程为y=59.057x-0.1303(r=0.9991),检测质量浓度线性范围为0.005~0.25 μg/ml。
2.5 提取回收率试验
取一定量的NE标准品2份,其中1份加入全脑样品溶液,处理后测得NE峰面积记为A1;1份加入蛋白沉淀液并稀释至相同浓度,测得NE峰面积记为A3;另外测得全脑样品溶液(未加标准品)的NE峰面积记为A2;计算NE提取回收率=(A1-A2)/A3×100%。同法测得5-HT的提取回收率,结果见表2。
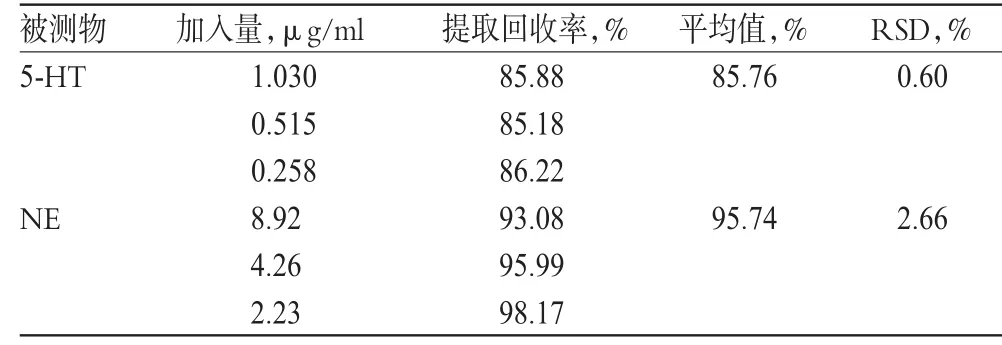
表2 提取回收率试验结果(n=3)Tab 2 Results of extraction recovery tests(n=3)
2.6 加样回收率试验
因NE、5-HT为内源性物质,故用加入法测定回收率,即向已知浓度的全脑样品溶液中加入一定量的NE、5-HT标准品溶液,处理后进样测定,计算方法回收率=(测得量-样品含量)/加入量×100%,结果见表3。
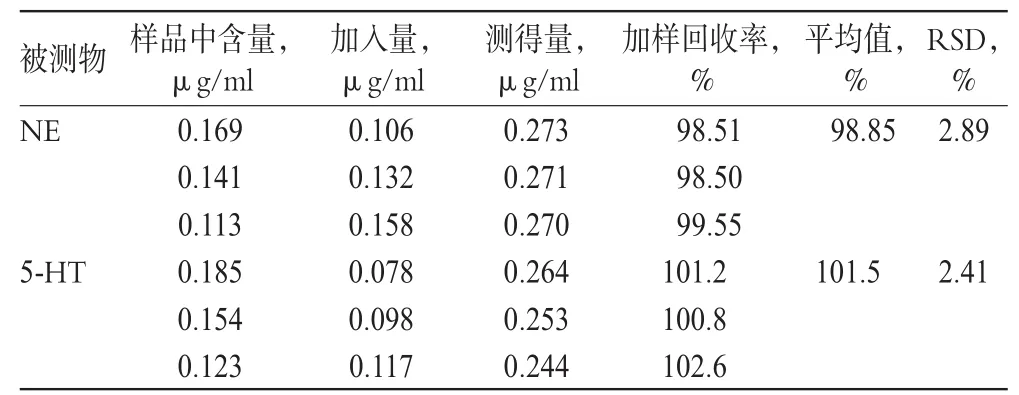
表3 加样回收率试验结果(n=3)Tab 3 Results of recovery tests of added index(n=3)
2.7 精密度试验
取同一份全脑样品,加入NE、5-HT标准品溶液制备成高、中、低3种质量浓度的样品溶液,分别于同日内0、2、4、6、8 h重复测定5次,考察精密度。结果NE的RSD=2.76%(n=5),5-HT的RSD=3.00%(n=5),表明本方法精密度良好。
2.8 稳定性试验
将已知NE、5-HT质量浓度的样品溶液3份,分别置于常温下存放,于处理后第1、2、3天测试其含量,考察样品稳定性。结果NE的RSD=1.87%(n=3),5-HT在第2天含量有大幅下降,表明脑组织中NE在常温下至少能稳定3 d,而5-HT仅能稳定1 d。
2.9 样品含量测定
根据“2.1.4”项下的制备方法,分别制备6只大鼠的大脑皮层样品溶液、小脑样品溶液、海马样品溶液、下丘脑样品溶液、嗅球样品溶液,测定其中NE、5-HT含量,结果见表4。
表4 NE、5-HT在大鼠不同脑区中的水平(,mg/g,n=6)Tab 4 The levels of NE and 5-HT in different parts of brain in rat(s,mg/g,n=6)

表4 NE、5-HT在大鼠不同脑区中的水平(,mg/g,n=6)Tab 4 The levels of NE and 5-HT in different parts of brain in rat(s,mg/g,n=6)
被测物NE 5-HT嗅球0.864±0.100.086±0.04大脑皮层0.411±0.120.383±0.21小脑0.343±0.140.059±0.04海马1.654±0.800.135±0.09下丘脑3.062±1.510.206±0.12
由表4结果可知,NE在下丘脑中含量最高,海马次之,小脑最低;5-HT在大脑皮层中含量最高,下丘脑次之,小脑最低。说明单胺类神经递质在♀大鼠脑中分布不均一,与张燕等[3]报道一致。
3 讨论
单胺类神经递质结构不稳定,极易分解,且脑组织样品量少,成分复杂,神经递质含量极微。因此建立一套完整、详细、可重复的含量分析方法尤为重要。
根据文献[4-7],笔者先后进行了4种不同流动相[(1)缓冲盐溶液(无水乙酸钠2.0 g、柠檬酸5.5 g、EDTA-2Na 60 mg、NaCl 584.4 mg、1.0 mmol/L庚烷磺酸钠2 ml制成500 ml)-甲醇(97∶3);(2)缓冲盐溶液(0.1 mol/L磷酸二氢钾、0.01 mol/L庚烷磺酸钠、0.1 mol/L EDTA-2Na,用0.1 mol/L磷酸调pH为3.6)-甲醇-乙腈(78∶19∶3);(3)缓冲盐溶液(0.1 mol/L磷酸二氢钠、0.85 mmol/L庚烷磺酸钠、0.5 mmol/L EDTA-2Na,用0.1 mol/L磷酸调pH为3.4)-甲醇(94∶6);(4)“2.2”项下流动相]的实验摸索。前3种流动相出现了NE峰未能有效分离或者5-HT峰有明显拖尾现象的现象,最终确定采用“2.2”项下流动相。结果表明,在此流动相条件下,NE、5-HT及内标均可达到有效的分离。实验发现,增大甲醇的比例不改变各物质的出峰顺序,而且可以明显缩短各物质的保留时间,尤其是对5-HT影响较大,但甲醇比例过大多会使NE出峰过早,与杂质峰重叠,影响分析结果。于是笔者改变了以往文献等度洗脱的方法,采用梯度洗脱,既可使各物质保持良好的分离度,又可以缩短5-HT的保留时间。
在标准品溶液稀释液的选择上,本实验分别考察了蛋白沉淀液、0.1 mol/L HCl以及流动相,发现采用流动相及HCl后色谱峰干扰大,因此,最终确定标准品溶液稀释液为蛋白沉淀液。
多数文献选用0.1 mol/L的高氯酸作为蛋白沉淀液,因其除蛋白质峰效果最好、杂质最少,但未明确加入量。若蛋白沉淀液加入过多,会使峰形过于低平,且高氯酸浓度过高会引起神经递质氧化分解;若加入过少,蛋白质会对峰形产生干扰或无法匀浆。经过反复试验,确定加入比例为:>100 mg的组织按1 mg ∶2.5 μl的比例加入,<100 mg的组织按200 μl加入。这样既能有效沉淀蛋白,又不干扰峰形。
在操作过程中应尽量避光及在冰水浴中低温下操作。样品经前处理后应立即检测或分装保存在-80℃的冰箱中。含量分析时,如果具备进样器控温模块,应将温度调节至4℃为佳;如无此模块,则NE在常温下至少能稳定3 d,而5-HT只能稳定1 d。
[1]陈洁,黄宏平.应激导致抑郁症与单胺类递质系统稳态[J].生物学杂志,2013,30(1):78.
[2]张广芬,周志强,乔慧芬.抗抑郁药研究新方向[J].临床精神医学杂志,2012,22(3):203.
[3]张燕,王洪斌,杨海霞,等.荧光分光光度法测定大鼠不同脑区单胺类神经递质[J].东北农业大学学报,2010,41(1):93.
[4]王娜,吴红海,侯艳宁.高效液相色谱-电化学法测定大鼠不同脑区的单胺类神经递质[J].华北国防医药,2006,18(3):162.
[5]Wang W,Hu X,Zhao Z,et al.Antidepressant-like effects of liquiritin and isoliquiritin from glycyrrhiza uralensis in the forced swimming test and tail suspension test in mice[J].Prog Neuropsychopharmacol Biol Psychiatry,2008,32(5):1179.
[6]Zhao Z,Wang W,Guo H,et al.Antidepressant-like effect of liquiritin from glycyrrhiza uralensis in chronic variable stress induced depression model rats[J].Behavioural Brain Research,2008,194(1):108.
[7]谭炳炎,郑琳,冯翔.高效液相色谱-电化学法测定大鼠血液和脑组织中单胺类物质的含量[J].分析测试学报,2006,25(2):90.
