不同培养模式对微藻Chlorella vugaris代谢与蛋白质组分的影响
2014-05-21李昌灵杨海麟李宇佶
李昌灵 , 杨海麟 , 李宇佶 , 王 武 *
(1.江南大学 教育部工业微生物技术重点实验室,江苏 无锡 214122;2.怀化学院 生命科学系,湖南 怀化418008)
小球藻属绿藻门 (Chlorophyta),小球藻属(Chlorolla),是一类普生性单细胞微藻[1]。小球藻广泛分布于淡水和海水中。小球藻除利用光能和无机碳(如CO2和碳酸盐等)进行光合自养以外,还可利用一种或多种有机物作为能源和碳源在黑暗中生长[2-3],即进行异养发酵。小球藻富含油脂、蛋白质、碳水化合物、维生素、食用纤维、微量元素和其它生物活性物质[4],具有降血压、降血脂,抗动脉粥样硬化,增强免疫力,抗肿瘤以及抗病毒感染等保健功能[5]。小球藻为具保健功能的健康食品,其促进健康主要营养组分之一为蛋白质或氨基酸[6]。蛋白质质量分数是评价小球藻营养价值的主要因素之一。小球藻细胞中蛋白质质量分数为16.0%~58.0%,且不同营养因素及培养条件影响蛋白生物合成[7-8]。小球藻生长和细胞组分(如,蛋白和油脂等)不仅受到培养基中营养元素调控,而且受到环境条件影响。目前,营养方式对小球藻油脂合成研究较多[2,9-10]。而营养方式影响小球藻细胞生物合成蛋白及氨基酸的研究报道较少。作者研究考察3种发酵方式对小球藻细胞生长、蛋白质及氨基酸合成的影响,以探索通过改变营养方式调控小球藻胞内蛋白含量及氨基酸组分的实现手段。
1 材料与方法
1.1 材料与仪器
小球藻(Chlorella vugaris)藻株 C9-JN2010:作者所在实验室从海水中分离并经过人工选育获得;培养基为修改Chu's Medium (MCM)培养基组分(mg·L-1)[11];Nile red Sigma-Aldrich 公司产品;过硫酸钾:爱建德固赛(上海)引发剂有限公司产品。
YXQ-LS-50S1型立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂产品;ZHWY200B型摇床:上海智城分析仪器制造有限公司产品;DHP-2000型电热恒温培养箱:天津市华北实验有限公司产品;水平层流净化工作台:苏州洁净技术研究所产品;分析天平:梅特勒-托利多仪器有限公司产品;F-4600荧光分光光度计,U3900紫外分光光度计:日立公司产品;1100 HPLC:美国安捷伦公司产品。
1.2 实验方法及步骤
1.2.1 种子培养方法 挑取平板上培养藻株至含有1.0 mL dd H2O的2 mL离心管中,混合均匀。分别取适量藻接种于含有50.0 mL MCM培养基的250 mL三角烧瓶中,置于恒温光照摇床中振荡培养(培养条件为:25±1 ℃,光照强度 4 000 lux,光暗周期为 16 h∶8 h,pH 为 7.0)。
1.2.2 自养、混养与异养培养实验 分别在1.0 L MCM中添加2.0 g NaHCO3进行自养培养和添加5.0 g葡萄糖进行异养及混养培养。将藻种接种于装有150 mL MCM的500 mL摇瓶中,调整pH为7.0,初始接种量干重为0.155 g/L,于温度为25±1℃,光强为4 000 lux,光暗周期为16 h∶8 h条件下自养和混养培养4 d。异养时用黑布包裹好避光培养。每天取样一次,进行相关参数的检测。
1.2.3 生物量及比生长速率检测 藻生物量及比生长速率采用修改的Wang[12]等方法测定。取藻液用无菌水进行10倍梯度稀释,于680 nm波长测定稀释样品吸光值,另取各稀释藻样8 000 r/min离心5 min后,收集沉淀于恒温箱80℃干燥至恒重并称干重,并建回归方程,并分别根据式1和式2计算其生物量和μ。

式(2)中:X1是第一次取样时(t1)生物量,X2是第二次取样时(t2)生物量。
1.2.4 蛋白质质量分数及氨基酸分析 HPLC法测定蛋白质含量及氨基酸组成分析。色谱条件为:采用OPA FUOC柱前衍生化,柱温 40℃(250×4.6 mm,5 um,ODSHYPERSIL),流动相为A相和B相(表1),流量为1.0 mL/min,分别于338 nm和262 nm(Pro,Hypro)检测。

表1 氨基酸分析仪所用流动相Table 1 Mobile phase for analysis of amino acids by HPLC
1.2.5 氮质量浓度测定 采用APP-UV法(GB11894-89)测定总氮。收集40 mL藻液于8 000 r/min离心5 min,取上清,分别在波长220 nm和275 nm测定吸光值,根据标准曲线建立回归方程,氮质量浓度(mg/L)=5.966 6(A220nm-2*A275nm)-0.035 8,r2=0.999 6),计算氮质量浓度。
1.2.6 磷质量浓度测定 采用钼酸铵分光光度法(GB11893-89)测定总磷含量。收集40 mL藻液于8 000 r/min离心5 min,取上清,于波长690 nm测定吸光值,根据标准曲线建立回归方程,磷质量浓度(mg/L)=0.646 5 A690nm-0.008 5,r2=0.999 6,计算磷质量浓度。
1.2.7 总糖测定 培养液中总糖浓度测定采用3,5-二-硝基水杨酸-分光光度法[13]。收集40 mL藻液于8 000 r/min离心5 min,取上清,按总糖测定方法标准步骤操作,于540 nm下测定吸光值,根据标准曲线建立回归方程,糖质量浓度 (mg/L)=1.07 A540nm-0.043 9,r2=0.999 8,计算 Glc 质量浓度。
1.2.8 数据分析 采用Excell和Origin软件进行统计分析,每个实验重复3次。
2 结果与分析
2.1 自养、异养、混养模式对小球藻生长的影响
分别于异养、混养及自养方式下培养小球藻,其生长效果见图1。3种培养方式对小球藻生长影响较大。异养条件下,小球藻在96 h进入稳定期,后期由于有机碳源不足导致细胞开始死亡。而混养条件下,在96 h培养基中有机碳含量接近零,后期藻生物量不降反升。相比较,自养小球藻利用无机碳的速率较慢导致细胞生长速度也更慢。在混养条件下,藻细胞更容易积累生物量,在168 h生物量可达1.5 g/L,而自养条件下藻生物量最低仅为0.73 g/L。同样,藻细胞在混养时,比生长速率和生物量产率在 96 h均最高, 分别为 0.526 d-1和 0.318 mg/(L·d)。混养时生物量最高,为自养时的2.16倍。作者结果支持混养小球藻能更有效积累生物量[9,14]。小球藻在光暗条件转换过程中,能快速切换自养到异养代谢,反之亦然[15]。

图1 自养、混养和异养培养模式对C.vulgaris C9-JN2010的生长的影响Fig.1 Effect of autotrophic,heterotrophic and mixotrophic culturemodelson growth ofChlorella vulgaris C9-JN2010
混养方式下小球藻生物量积累更高,可能混养条件下藻细胞既可通过异养途径快速利用葡萄糖进行生长繁殖,当培养基中糖不足时,又可通过光合自养固定空气中CO2,进一步合成细胞生长繁殖所需糖类、氨基酸、蛋白质及核酸等有机物从而促进藻生物量积累。微藻自养培养时主要通过获取光能用于自身生长,而光能不足难以维持细胞最优生长。在没有光照时异养培养,适宜的碳源对藻获得高生物量非常重要。Haass和Tanner报道了小球藻拥有一套诱导型己糖运输途径利用葡萄糖[16]。大量研究表明Chlorella sp.不但能够利用单糖(如,葡萄糖、果糖、半乳糖和甘露糖等),而且能够利用二糖(如蔗糖和乳糖),而不同糖的利用速率不一导致藻细胞产率和生物量浓度的差异较大[17-20]。一般异养小球藻生物量约为自养的3-5倍[10,19]。甚至有研究报道小球藻异养时还能利用甘油,主要在藻细胞生长后期,培养基中速效糖被消耗完之后会诱导微藻代谢机制发生改变,藻细胞会利用甘油、一些有机酸,甚至是复杂糖类作碳源[21]。混养时微藻可同时进行异养和自养或单独进行异养或自养[22],当有机碳出现可改变小球藻异养和自养的代谢途径[23]。因而,混养不是光合自养与异养简单的结合。此外,Cheirsilp和Torpee研究发现光照也可促进藻细胞生长积累生物量[24]。
2.2 不同培养模式下小球藻叶绿素质量分数与C/N利用效率比较
不同培养方式显著影响藻细胞叶绿素含量,见图2。在0~24 h,异养、混养和自养培养方式下,叶绿素含量均随着藻细胞生长增加,在24 h均达到最高值分别为 20.8、25.6、32.1 mg/g。24 h 后,叶绿素含量开始下降,尤其是异养条件下,于168 h降为最低是3.8 mg/g,在自养条件下叶绿素下降较慢,最终稳定在25 mg/g左右。研究报道自养有利于叶绿素合成,而混养和异养不利于叶绿素积累[24-26]。Boussiba和Vonshak认为氮是用于连续合成色素蛋白质所必需的元素[27]。产生以上现象的主要原因为:一方面,小球藻细胞在光合自养时,碳利用主要通过光合途径卡尔文循环途径固定CO2,进一步形成合成各种所糖类、需氨基酸和蛋白质及核酸等,需要合成大量光合色素来捕获足够能量。若氮源限制出现后,异养和混养能直接利用培养基中葡萄糖等碳源生长繁殖,不需要光合作用固定CO2而抑制光合色素合成;另一方面,自养光合色素合成需要大量氮,培养基中氮含量过低不利于色素合成[28]。
3种培养方式下,小球藻对Glc和氮的利用效果见图3和表2。混养时小球藻利用糖和氮速率最快,在120 h时糖浓度接近零,其糖利用率和消耗速率分别为 99.7%和 0.598 g/(L·d)。 至 96 h,氮质量浓度降为0.5左右,其利用率与利用速率分别为99.9%和 13.98 mg/(L·d)。
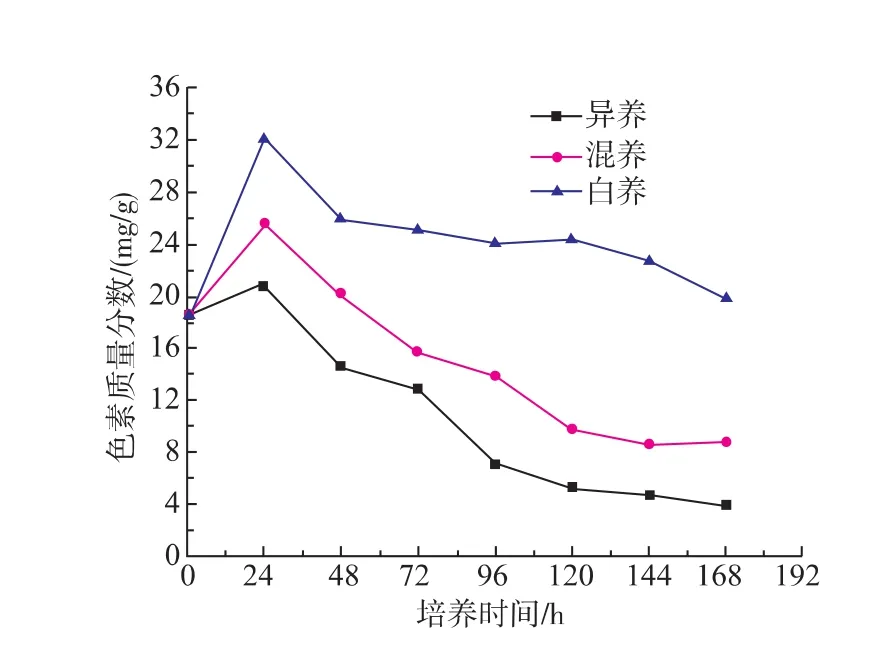
图2 自养、混养和异养培养模式对C.vulgaris C9-JN2010胞内光合色素质量分数的影响Fig.2 Effect of autotrophic,heterotrophic and mixotrophic cultures models on content of chlorophyll in cell C.vulgaris C9-JN2010

表2 自养、异养及混养条件下C.vulgaris C9-JN2010利用葡萄糖和氮效率Table 2 Efficiency of consuming Glc and nitrogen in the culture media by C.vulgaris C9-JN2010 in autotrophic,heterotrophic and mixotrophic cultures models


图3 自养、异养及混养培养模式下C.vulgaris C9-JN2010消耗糖与氮的曲线Fig.3 Curves of consuming glucose and nitrogen by C.vulgaris C9-JN2010 in autotrophic,heterotrophic and mixotrophic cultures models
2.3 3种培养方式对藻体蛋白质质量分数及氨基酸组分的影响
小球藻C9-JN2010在自养条件下蛋白质质量分数最高为52.1%,但蛋白产率却在混养时最高为0.097 g·L-1·d-1(表 3)。自养小球藻蛋白质含量高于Mitra[9]等人报道,而混养与异养则稍低。一般地,小球藻内蛋白质、油脂及糖质量分数分别为51%~58%、14%~22%和12%~17%[5]。主要原因是自养培养时,藻生物量过低导致最后蛋白质产量低。当氮缺乏而碳充足时,微藻细胞通过碳代谢进入乙酰辅酶A使脂肪酸积累被激活,或碳参与把糖类或蛋白质转化为脂肪酸[29-30],导致蛋白质质量分数降低。
3种培养方式下,小球藻均含18种氨基酸,且8种必需氨基酸比例高,约占总氨基酸质量分数的40.0%(表3)。另外,在异养和混养条件下小球藻所有氨基酸比例基本相似,与自养时相比,其中Cyss、Thr、Tyr和 Met差异显著,Cys-s质量分数分别高为 78.57%, 而 Thr、Tyr及 Met分别低 21.6%、27.59%和33.33%(表4)。可能原因为不同培养方式下碳利用方式和途径不同导致小球藻一些氨基酸代谢产生差异。García等认为混养条件下细胞内光合成分含量依赖于异养/自养代谢的比重[31]。

表3 自养、异养及混养培养模式下培养藻细胞蛋白质质量分数及产率Table 3 Content and productivity of protein from the algae biomass cultivated in autotrophism,heterotrophism and mixotrophism
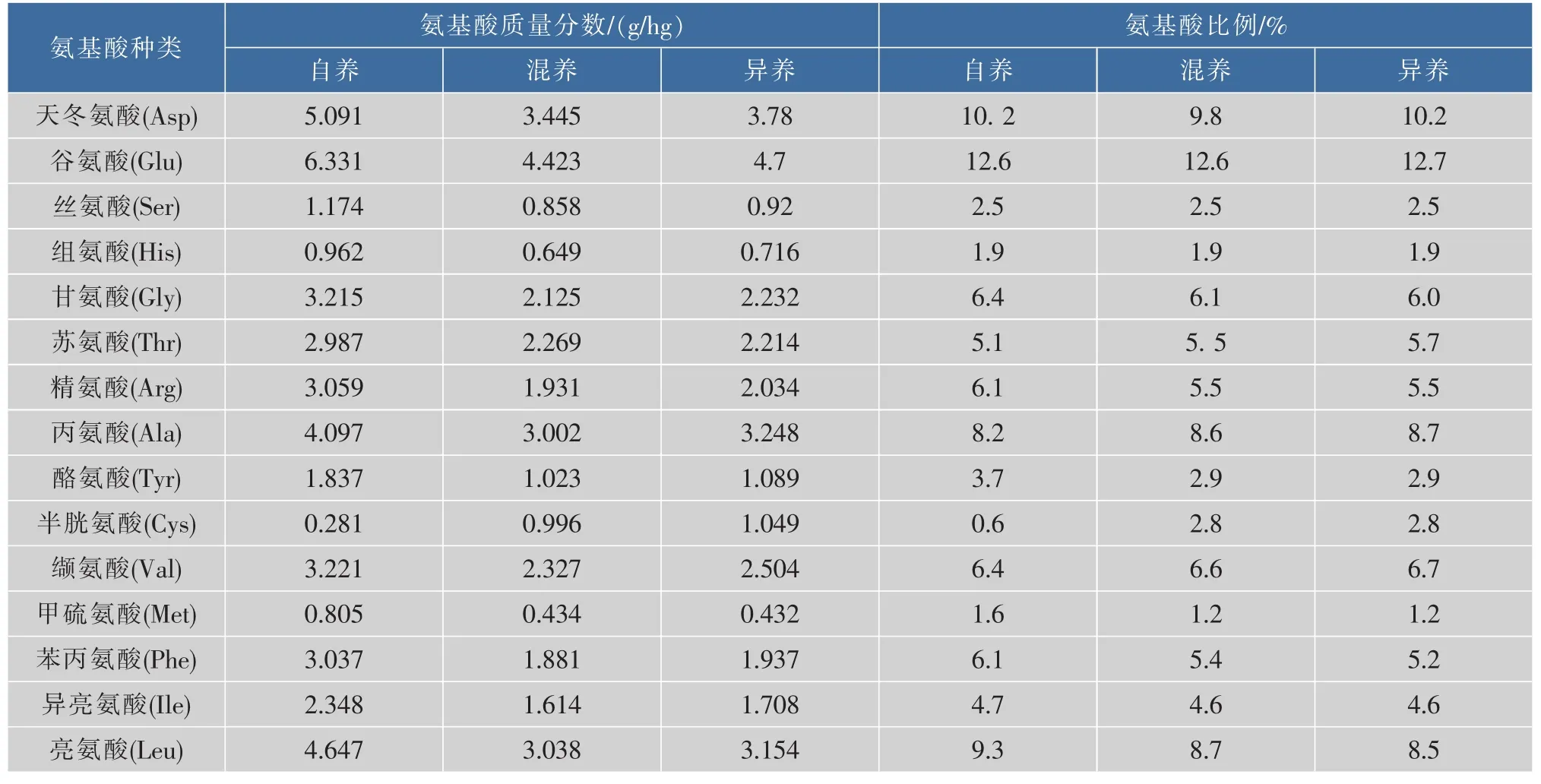
表4 自养、异养及混养培养模式下藻细胞氨基酸质量分数及组成Table 4 Content and components of amino acids from the algae cell cultivated in autotrophism,heterotrophism and mixotrophism

续表4
3 结语
考察了自养、异养及混养条件下小球藻蛋白质及氨基酸合成效果。混养藻细胞生长更佳,生物量高达1.5 g/L,为自养时2.16倍,而自养时更有利于色素和蛋白质合成,其质量分数分别高达25 mg/g和52.1%。自养藻蛋白质质量分数高于Mitra[9]等人报道,而混养与异养则稍低,但混养时蛋白质产率却最高为0.097 g/(L·d)。3种方式培养小球藻均含18种氨基酸,且必须氨基酸质量分数超过40.0%。异养和混养小球藻各氨基酸比例基本相似,与纯自养培养小球藻相比,Cys-s、Tyr和Met比例差异最显著,为作者首次报道。自养能有效提高蛋白质含量,而混养可显著提高蛋白质产率。营养方式显著影响小球藻蛋白质合成及氨基酸组成,籍此可营养方式是小球藻实现一些重要氨基酸积累策略。后续将优化混养小球藻蛋白及氨基酸合成代谢调控策略,预期获得更高的蛋白质产率和提高一些氨基酸质量浓度。
[1]NAKAJIMA T,SANO,MATSUOKA H.Auto-/heterotrophic endosymbiosis evolves in a mature stage of ecosystem development in a microcosm composed of an alga,a bacterium and a ciliate[J].Biosystems,2009,96(2):127-135.
[2]TAMARYS HA,WEI W,ROGER R,et al.Mixotrophic cultivation of Chlorella vulgaris and its potential application for the oil accumulation from non-sugar materials[J].Biomass Bioenergy,2011,35(5):2245-2253.
[3]余云龙,邹华,张强,等.黑暗条件下普通小球藻处理废水的研究[J].食品与生物技术学报,2012,31(9):938-943.YU Yunlong,ZOU Hua,ZHANG Qiang,et al.Study on wastewater treatment by Chlorella vulgaris under dark condition[J].J Food Sci Biotechnol,2012,31(9):938-943.(in Chinese)
[4]BECKER W.Microalgae in Human and Animal Nutrition[M].Oxford:Blackwell,2004:312-351.
[5]SPOLAORE P,JOANNIS-CASAN C,DURAN E,et al.Commercial applications of microalgae[J].J Biosci Bioeng,2006,101(2):87-96.
[6]PULZ O,SCHEINBENBOGAN K.Photobioreactors:design and performance with respect to light energy input[J].Adv Biochem Eng/Biotechnol,1998,59:123-152.
[7]ANDRZE B.Effect of brassinosteroids on nucleic acids and protein content in cultured cells of Chlorella vulgaris[J].Plant Physiol Biochem,2000,38(3):209-215.
[8]HE PJ,MAO B,SHEN CM,et al.Cultivation of Chlorella vulgaris on wastewater containing high levels of ammonia for biodiesel production[J].Bioresourc Technol,2013,129:177-181.
[9]MITRA D,LEEUWEN JV,LAMSAL B.Heterotrophic/mixotrophic cultivation of oleaginous Chlorella vulgaris on industrial coproducts[J].Algal Res,2012,1(1):40-48.
[10]HEREDIA-ARROYO T,WEI W,HU B.Oil accumulation via heterotrophic/mixotrophic Chlorella protothecoides[J].Appl Biochem Biotechnol,2010,162(7):1978-1995.
[11]WANG L,MIN M,LI YC,et al.Cultivation of green algae Chlorella sp.in different wastewaters from municipal wastewater treatment plant[J].Appl Biochem Biotechnol,2010,162(4):1174-1186.
[12]MILLER GL.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[13]GROBBELAAR JU.Algal Nutrition[M].Oxford:Blackwell,2004.
[14]LIANG YN,SARKANY N,CUI Y.Biomass and lipid productivities of Chlorella vulgaris under autotrophic,heterotrophic and mixotrophic growth conditions[J].Biotechnol Lett,2009,31(7):1043-1049.
[15]CHEN Y,QIANG H,KAZUYUKI S.Energetics and carbon metabolism during growth of microalgal cells under photoautotrophic,mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions[J].Biochem Eng J,2000,6(2):87-102.
[16]HAASS D,TANNER W.Regulation of hexose transport in Chlorella vulgaris[J].Plant Physiol,1974,53(1):291-302.
[17]WANG B,LI Y,WU N,et al.CO2bio-mitigation using microalgae[J].Appl Microbiol Biotechnol,2008,79(5):707-718.
[18]SUN N,WANG Y,LI YT,et al.Sugar-based growth,astaxanthin accumulation and carotenogenic transcription of heterotrophic Chlorella zofingiensis(Chlorophyta)[J].Process Biochem,2008,43(11):1288-1292.
[19]ZHENG Y,CHI Z,LUCKER B,et al.Two-stage heterotrophic and phototrophic culture strategy for algal biomass and lipid production[J].Bioresour Technol,2012,103(1):484-488.
[20]SANCHEZ-LUNA LD,CONVERTI A,TONINI GC,et al.Continuous and pulse feeding of urea as a nitrogen source in fed-batch cultivation of Spirulina platensis[J].Aquacult Eng,2004,31(3-4):237-245.
[21]O’GRASY J,MORGAN JA.Heterotrophic growth and lipid production of Chlorella protothecoides on glycerol[J].Bioproc Biosyst Eng,2011,34(1):121-125.
[22]FACUNDO JM,KEN S,TOSHIHDE K,et al.Growth characteristics of Spirulina platensis in heterotrophic and mixotrophic conditions[J].J Ferment Bioeng,1993,76(5):408-410.
[23]VILLAREJO A,ORUS MI ,MARTINEZ F.Coordination of photosynthetic and respiratory metabolism in Chlorella vulgaris UAM 101 in the light[J].Physiol Plant,1995,94(4):680-686.
[24]LEWITUS AJ,KANA TM.Light respiration in six estuarine phytoplankton species:contrasts under autotrophic and organotrophic growth conditions[J].J Phycol,1995,31:754-761.
[25]OGBONNA JC,TANAKA H.Cycle autotrophic/heterotrophic cultivation of photosynthetic cells:a method of achieving continuous cell growth under light/dark cycles[J].Bioresourc Technol,1998,65(1-2):65-72.
[26]BOUSSIBA S,VONSHAK A.Astaxanthin accumulation in the green alga Haematococcus pluvialis[J].Plant Cell Physiol,1991,32(7):1077-1082.
[27]KONG Q,LI L,MARTINEZ B.Culture of microalgae Chlamydomonas reinhardtii in wastewater for biomass feedstock production[J].Appl Biochem Biotechnol,2010,160(1):9-18.
[28]LI YT,HAN DX,SOMMERFELD M,et al.Photosynthetic carbon partitioning and lipid production in the oleaginous microalga Pseudochlorococcum sp.(Chlorophyceae)under nitrogen limited conditions[J].Bioresour Technol,2011,102(1):123-129.
[29]KLASS DL.Biomass for renewable energy and fuels[M].Amsterdam:Elsevier Academic Press,2004:193-212.
[30]CERON GARCIA MC,SANCHEZ MIRON A,FERNANDEZ SEVILLA,et al.Mixotrophic growth of the microalga Phaeodactylum tricornutum influence of different nitrogen and organic carbon sources on productivity and biomass composition[J].Proc Biochem,2005,40(1):297-305.
