流感病毒受体特异性红细胞检测试剂的制备及初步应用
2014-05-21邵振文谭力凯杨萌萌张桂红
邵振文,谭力凯,粟 硕,曹 楠,周 晗,杨萌萌,张桂红
(华南农业大学兽医学院,广东 广州 510642)
流感病毒感染宿主靶细胞的首要条件是通过其血凝素与宿主细胞表面的唾液酸受体结合而侵入机体,该结合能力决定了流感病毒种间传播的潜能[1]。一般认为流感病毒受体识别特异性应与宿主的受体类型一致,人流感病毒主要结合人肺脏和上呼吸道上皮的细胞表面受体SAα2,6Gal唾液酸受体,而禽流感病毒(AIV)主要结合禽上呼吸道和肠道上皮细胞表面的SAα2,3Gal唾液酸受体[2]。由于猪体内同时含有两种类型的受体,猪被认为是流感病毒的“中间宿主”[3]。不同宿主来源的病毒可以在猪体内发生变异,当产生可以结合人流感病毒受体的病毒时,可能引发在人群中的流行。因此加强对流感受体特异性的研究可以帮助我们及时掌握病毒的变异状况,了解病毒的宿主范围[4]。
虽然近年来,国内外已经建立了多种针对流感病毒的诊断技术,满足了我国针对流感病毒流行病学检测以及防制的迫切需要[5]。但目前仍无有效手段对流感病毒病原的变异和宿主的特异性进行检测和评估。本实验通过构建含有单一唾液酸受体的红细胞可以快速检测流感病毒的受体特异性,进而判断病毒的宿主嗜性。为评估病毒变异对人类造成的潜在威胁,制定合理有效的公共卫生防制策略提供理论依据和有效手段。
1 材料和方法
1.1 病毒株和细胞 禽源猪流感病毒(SIV)A/swine/Guangzhou/L1/2010(H9N2)、H3和H9亚型AIV标准抗原均由华南农业大学兽医学院禽病实验室保存;AIV A/chicken/Guangdong/383/2008(H5N1)由本实验室在8日龄病死鸡胚中分离;人流感病毒A/PR/8/34(H1N1)由广东省疾病预防控制中心提供;鸡红细胞(RBC)采自健康成龄公鸡。
1.2 主要试剂 霍乱弧菌神经氨酸酶(Vibrio choleraeneuramindase,VCNA)、唾液酸转移酶底物CMP-唾液酸(CMP-sialic acid)、α2,3唾液酸转移酶(α-2,3-Sialytransferase)与 α2,6 唾液酸转移酶(α-2,6-Sialytransferase)均购自Sigma公司;枸橼酸-枸橼酸钠-磷酸二氢钠-腺嘌呤-葡萄糖抗凝剂(CPDA)购自广州齐云生物有限公司;FITC标记的西洋接骨木凝集素(SNA)FITC-SNA(仅与 SAα2,6Gal结合)和FITC标记的朝鲜槐凝集素(MAA)FITC-MAA(仅与SAα2,3Gal结合)购自 EY labs公司。
1.3 RBC悬液的制备 用CPDA01抗凝剂润湿注射器,无菌采集健康鸡血液,1500 r/min离心15 min,弃上清液。用pH7.2的PBS重悬鸡RBC,洗涤3次,每次1500 r/min离心10 min,弃上清液,利用PBS将洗涤后的鸡RBC分别配制成10%和1%的RBC悬液,4℃保存备用。
1.4 RBC表面受体的处理 取100 μL浓度为10%的健康鸡RBC加入50 mU VCNA,37℃水浴1 h,每20 min震荡一次,PBS洗涤3次,2000 r/min离心5 min,重悬后配制成1%的RBC悬液,4℃保存备用。
1.5 VCNA红细胞受体的重新标记 取上述制备的VCNA鸡RBC 50 μL,加入1.5 mmol/L磷酸胞苷唾液酸。将其分为两等分,分别加入10 μL(浓度为1 mg/mL)的α-2,6唾液酸转移酶和α-2,3唾液酸转移酶,37℃孵育2 h。PBS洗涤3次,配置成1%的鸡RBC悬液。
1.6 流式细胞仪检测RBC受体 利用细胞计数仪分别取3×106个正常鸡RBC、VCNA处理的鸡RBC和α2,3和α2,6唾液酸转移酶处理的鸡RBC,分别与FITC标记的植物凝集素FITC-SNA(30 μg/mL)和FITC-MAA(30 μg/mL)37 ℃作用 30 min,PBS 洗涤3次。利用流式细胞仪进行荧光强度检测。
1.7 RBC表面受体特异性的检测 在96孔微量血凝板上分别以H5N1亚型AIV和H1N1亚型人流感病毒检测正常的鸡RBC、VCNA处理的鸡RBC和分别通过不同唾液酸转移酶处理的鸡RBC。以此确定不同唾液酸转移酶的标记效果。
1.8 流感病毒受体特异性的检测 利用已构建的含有单一唾液酸受体的RBC对H9N2亚型SIV以及H3和H9亚型AIV标准抗原进行血液凝集试验,检测上述流感病毒的受体特异性,并以已知受体类型的病毒作为对照。
2 结 果
2.1 RBC表面受体的检测 对正常的RBC、VCNA处理的RBC以及经过唾液酸转移酶处理过的RBC分别进行流式检测,结果显示,正常鸡RBC可以与FITC-SNA和FITC-MAA结合,证明其表面含有SAα2,3Gal和 SAα2,6Gal受体(图 1A2、A3);VCNA处理的鸡RBC不能够与FITC-SNA与FITC-MAA结合,表明神经氨酸酶已经将RBC表面受体消除(图1D2、D3);经过 α2,3唾液酸转移酶处理过的鸡RBC仅与FITC-MAA结合,表明其表面只含有单一SAα2,3Gal受体(图 1C2);而鸡 RBC经过 α2,6唾液酸转移酶重新标记后仅与FITC-SNA结合,表明其只含有 SAα2,6Gal受体(图 1B3)。
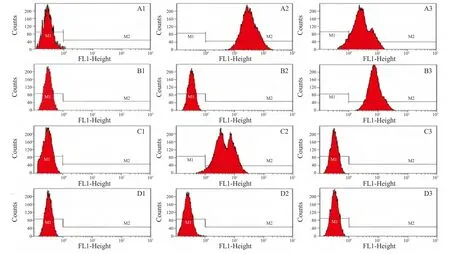
图1 流氏细胞仪检测红细胞表面唾液酸受体的荧光Log值Fig.1 Log Fluorescence intensity on surface of RBCs detected by flow cytometry
2.2 RBC表面受体特异性的验证 分别利用正常的鸡RBC、VCNA处理的鸡RBC以及分别标记SAα2,3Gal和 SAα2,6Gal受体的 RBC对 H1N1亚型人流感病毒和H5N1亚型AIV进行检测。结果表明,正常红细胞可以与H5N1亚型AIV和H1N1亚型人流感病毒均发生凝集反应;VCNA处理的鸡RBC与两种病毒均未发生凝集反应;只标记有SAα2,3Gal受体的鸡RBC只能够与AIV结合,而人流感病毒只能够与标记有SAα2,6Gal的鸡RBC发生凝集(图 2)。
2.3 流感病毒受体结合特性的检测 利用已构建好的含有单一唾液酸受体的RBC对H3和H9亚型AIV标准抗原及H9N2亚型SIV的受体特异性进行检测,结果显示,SIV可以与标记有SAα2,3Gal受体和SAα2,6Gal受体的RBC均发生凝集反应,表明SIV表面含有SAα2,3Gal和SAα2,6Gal这两种受体。H3和H9亚型AIV标准抗原仅与标记有SAα2,3Gal受体的红细胞发生凝集反应(图3)。
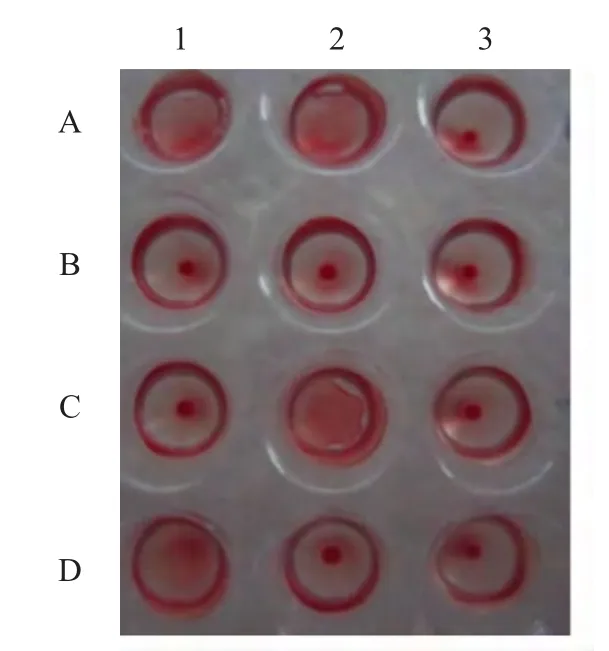
图2 已知受体特异性的流感病毒对含有不同受体类型红细胞的凝集特性检测Fig.2 Hemagglutination assay of influenza virus using chicken RBCs with different receptors
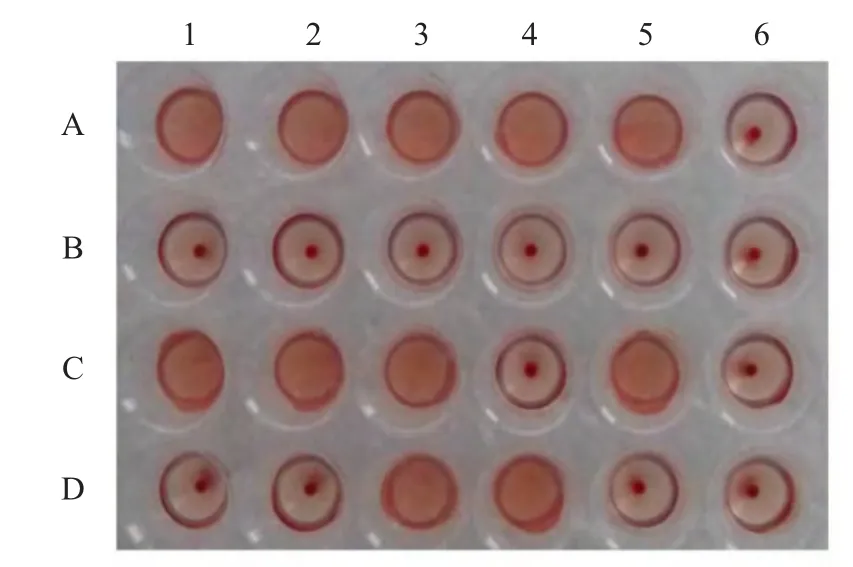
图3 流感病毒受体结合特异性的检测结果Fig 3 Identification of receptor binding specificity of influenza virus
3 讨 论
近年来频繁发生的动物源流感病毒直接感染人事件提示流感病毒可以通过变异跨越种属障碍威胁人类身体健康。流感病毒必须通过与宿主细胞表面的唾液酸寡糖链结合,才能进入宿主细胞进行复制转录[6]。通过分析流感病毒对不同唾液酸受体的结合能力,可以帮助我们加深对流感病毒宿主嗜性的理解。2001年,To和Mederios等利用外源凝集素荧光分类法研究表明鸡RBC表面同时具有SA2,3Gal和SAα2,6Gal唾液酸糖链[7]。人们后来发现VCNA处理后的鸡RBC不与流感病毒发生凝集反应[8]。因此本实验采用糖生物化学技术,利用VCNA消除RBC表面受体,然后通过唾液酸转移酶重新将单一唾液酸受体重新标记到RBC表面。利用构建的RBC对流感病毒进行血凝试验,可以准确判断流感病毒的受体特异性。
据报道SNA和MAA可以分别特异性的结合鸡RBC表面的SA2,6Ga与SAα2,3受体,因此本实验将标记有FITC-SNA和FITC-MAA的RBC进行流式检测,结果表明单一唾液酸受体可以被有效的标记到RBC表面[9]。而对流感病毒受体结合特性检测试验结果表明含有单一唾液酸受体的RBC可以有效区分人流感病毒和AIV。此外对SIV进行的受体结合特性检测表明,SIV可以在猪体内发生变异,获取感染人类唾液酸受体的能力,具有在人群中引发流行的潜能,继而威胁人类身体健康。本实验所构建的检测方法操作简单,可以在短时间内对流感病毒的受体特异性进行准确、快速的检测。该检测方法既可以为及时发现能够引起人间大流行的病毒株提供技术手段,也可以为预测流感的流行、制定积极有效的公共卫生应对方案提供充分的科学依据。
[1]刘金华.一种鉴定A型流感病毒受体亲和特性的方法[P].CN20071176058.1,2008.
[2]钟耀刚,秦棪楠,孙士生,等.流感病毒识别糖链受体分子机制的研究进展[J].Progress Biochem Biophysics,2012,39(7):605-612.
[3]李海燕,于康震,杨焕亮,等.中国猪源H5N1和H9N2亚型流感病毒的分离鉴定[J].中国预防兽医学报,2004,26(1):1-6.
[4]Suzuki Y,Ito T,Suzuki T,et al.Sialic acid species as a determinant of the host range of influenza A viruses[J].J Virol,2000,74:11825-11831.
[5]Stone B,Burrows J,Schepetiuk S,et al.Rapid detection and simultaneous subtype differentiation of influenza A viruses by real time PCR[J].J Virol Methods,2004,117:103-112.
[6]Couceiro J N,Paulson J C,Baum L G.Influenza virus strains selectively recognize sialyloligosaccharides on human respiratory epithelium;the role of the host cell in selection of hemagglutinin receptor specificity[J].Virus Res,1993,29:155-165.
[7]Medeiros R,Escriou N,Naffakh N,et al.Hemagglutinin residues of recent human A(H3N2)influenza viruses that contribute to the inability to agglutinate chicken erythrocytes[J].Virology,2001,289:74-85.
[8]Zhang Wei,Shi Yi,Lu Xi-shan,et al.An airborne transmissible avian influenza H5 hemagglutinin seen at the atomic level[J].Science,2013,340:1463-1467.
[9]Ueno K,Hanamure Y,Ohyama M.Differences in terminal carbohydrate structures of sialomucin in the murine nasal cavity[J].Eur Arch Otorhinolaryngol,1994,251:119-122.
