黄芪甲苷抑制GSK-3β活性介导大鼠心肌缺血/再灌注损伤作用的线粒体机制研究
2014-05-19贺永贵李王芳伊红丽习瑾昆
贺永贵,李王芳,伊红丽,郑 桓,习瑾昆
(1.河北联合大学附属医院;2.河北联合大学心脏研究所,中匈合作中医药实验室,唐山市新药基础研究重点实验室,河北唐山 063000)
急性心肌梗死引起的心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIRI),严重危害人类健康,急需对其机制进行探讨以指导临床治疗。黄芪是一种多年生草本植物,为豆科植物蒙古黄芪或膜荚黄芪的干燥根。黄芪甲苷(Astragaloside IV)是从黄芪中分离提取的重要生物活性成分之一,临床应用广泛,研究证实黄芪甲苷具有明显的心肌保护作用[1]。本研究观察MIRI时心功能和心肌梗死面积的变化,并给予黄芪甲苷干预以探讨其对大鼠MIRI的保护作用,在以往研究的基础上进一步探讨其对MIRI的线粒体保护机制,为黄芪甲苷的心肌保护作用提供可靠的实验依据。
1 材料
1.1 动物 实验用♂ Wistar大鼠,体质量250~350 g,由北京维通利华实验动物中心提供,实验动物使用许可证号:SYXK(冀)2010-0038。
1.2 主要材料与试剂 黄芪甲苷购自天津马克生物技术有限公司(批号:HQJG-20110507)。mPTP开放剂苍术苷(atractyloside)和抑制剂环孢素A(cyclosporin A,CsA)购自Sigma-Aldrich公司。磷酸化-GSK-3β(Ser9)抗体、Total-GSK-3β抗体购自美国Cell Signaling Technology公司。辣根过氧化物酶标记山羊抗兔IgG、BCA蛋白浓度测定试剂盒、ECL发光检测试剂盒购自碧云天生物技术研究所。
1.3 仪器 Langendorff体外心脏灌流系统、数据采集分析系统(成都仪器厂);电泳仪(Invitrogen公司);生物图像采集系统(美国UVP公司);电镜(日本日立公司)。
2 方法
2.1 实验分组及动物模型制备
2.1.1 实验分组 健康♂ Wistar大鼠,随机分为对照组、黄芪甲苷组、mPTP开放剂组及抑制剂组。
2.1.2 动物模型制备 Lengandorff系统建立大鼠MIRI模型。将♂ Wistar大鼠(250~350 g)用苯巴比妥钠(100 mg·kg-1)及肝素(2 mg·kg-1)腹腔注射麻醉后,开胸取心脏,立即放入盛有预冷生理盐水的平皿内,冲掉残留血液,并迅速悬挂于非循环的Langendorff灌流装置上,行主动脉逆行灌流(Kerbs-Henseleit缓冲液)。灌注稳定20 min后,用5-0丝线穿于冠状动脉周围,以造成局部缺血。再灌注时,松开小止血钳即可。
2.2 心功能指标测定 通过生物信号采集处理系统获得数据,观察缺血/再灌注过程中大鼠心脏在平衡末、缺血30 min、再灌注120 min时的心率(heart rate,HR)、左心室发展压(left ventricular-developed pressure,LVDP)、左室舒张末期压力(end diastolic pressure,EDP);在上述时点收集冠脉流出液,计时1 min,测量冠脉流出量(coronary flow,CF)。
2.3 电镜观察心肌组织超微结构 取再灌注心肌组织(结扎线以下左前下壁),4%多聚甲醛固定,电镜观察。
2.4 心肌梗死面积测定 再灌注120 min时,再次结扎冠状动脉(永久性),由主动脉逆行注入高分子荧光微球以区分梗死区。取出心脏,剪去多余血管和脂肪,称心脏重量,在-20℃冰箱冻存2 h。取出冷冻的心脏,从心尖至心底沿心脏横轴快速切成1 mm的心脏组织切片,游离出每个左心室组织切片置于1%TTC磷酸盐缓冲液中(pH=7.4),恒温37℃孵育20 min后,浸入10%的福尔马林溶液,以提高染色和非染色组织的对比度。此时可见红色为非心肌梗死区,灰白色不着色组织为心肌梗死区。将心脏组织切片放在两块玻璃板中间并压平,紫外光下描出标本和缺血区轮廓,观察梗死面积。梗死区和危险区绘图于透明塑料膜上,用Image Tool软件量化。梗死面积/%=梗死区/危险区×100%
2.5 线粒体分离及Ca2+诱导的肿胀实验 用差速离心法分离线粒体和胞质成分。心脏组织悬浮于组织匀浆缓冲液中(250 mmol·L-1蔗糖,10 mmol·L-1Tris-HCl(pH 7.4),1 mmol·L-1EDTA,1 mmol·L-1钒酸纳,1 mmol·L-1氟化钠,蛋白酶抑制剂,4℃保存,使用前加入钒酸纳、氟化钠、蛋白酶抑制剂)。充分混匀后置于冰上10 min。将匀浆液于4℃离心10 min(1 000×g);弃沉淀即细胞核和细胞碎片,转移上清至一新的离心管中,于4℃离心30 min(10 000×g);弃去少量沉淀后将上清液于4℃继续离心60 min(10 000×g),上清液为纯净细胞质成分,沉淀物为线粒体。将线粒体重悬于预冷的PBS缓冲液中,于4℃离心30 min(10 000×g),得到纯净线粒体。采用BCA蛋白定量试剂盒进行线粒体浓度分析。新鲜线粒体悬浮于肿胀缓冲液中(120 mmol·L-1KCl,10 mmol·L-1Tris-HCl,5 mmol·L-1KH2PO4,20 mmol·L-1MOPS,4℃),使线粒体终浓度达到0.3 g·L-1,并接种于96孔板中,加入200μmol·L-1CaCl2诱导 mPTP开放,用分光光度法测量520 nm吸收光降低的百分率来评价线粒体的肿胀程度。
2.6 Werstern blot检测磷酸化-GSK-3β蛋白表达提取缺血/再灌注心肌组织总蛋白,用BCA蛋白定量试剂盒进行蛋白浓度测定。每孔以60μg蛋白上样,电泳并转膜。10%脱脂牛奶室温封闭30~60 min,磷酸化-GSK-3β及单克隆抗体(1∶1 000稀释)4℃孵育过夜。二抗(1∶1 000稀释)室温孵育1 h后,ECL荧光显色。用总蛋白(Total-GSK-3β)进行内参检测。将X线片用Mixrotek Scan Wizard扫描软件进行电脑扫描,Image J图像分析软件对条带进行灰度扫描及定量分析。
2.7 统计学分析 实验数据采用SPSS 17.0统计软件进行统计学处理,所有实验数据均用¯x±s表示。显著性差异采用完全随机设计的单因素方差分析(one-way ANOVA)。
3 结果
3.1 黄芪甲苷对缺血/再灌注心脏心功能的影响对照组和黄芪甲苷组间的基础数据即结扎冠状动脉之前的 HR、CF、LVDP、EDP等差异无显著性(Tab 1)。但再灌注120 min时,黄芪甲苷组的CF、LVDP明显高于对照组(P<0.05)(Fig 1)。
3.2 黄芪甲苷对心肌超微结构的影响 缺血/再灌注造成了心肌线粒体损伤,主要为线粒体肿胀及空泡变性。而黄芪甲苷组线粒体损伤明显减轻(Fig 2)。
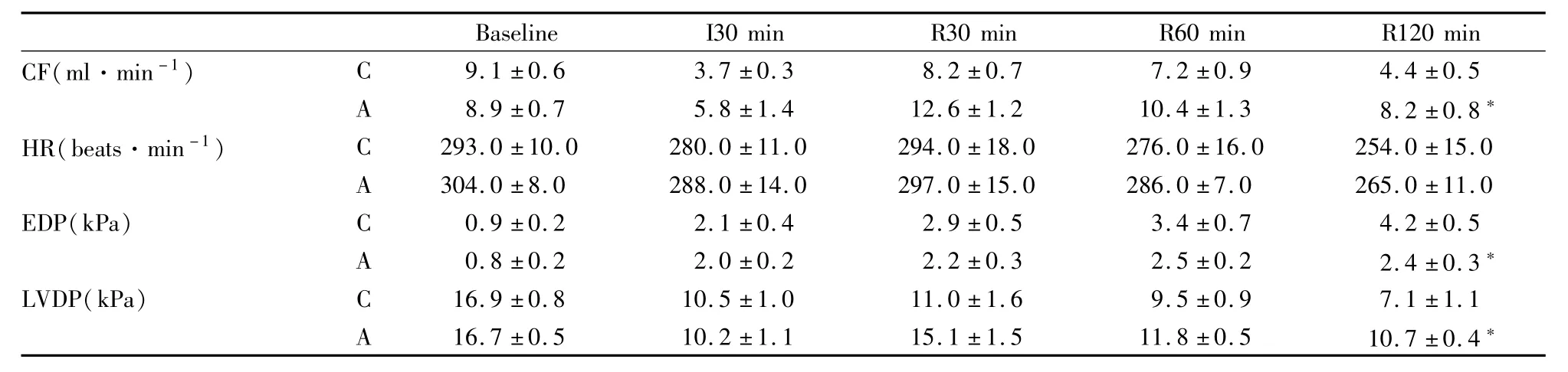
Tab 1 Hemodynamic data(¯x±s)
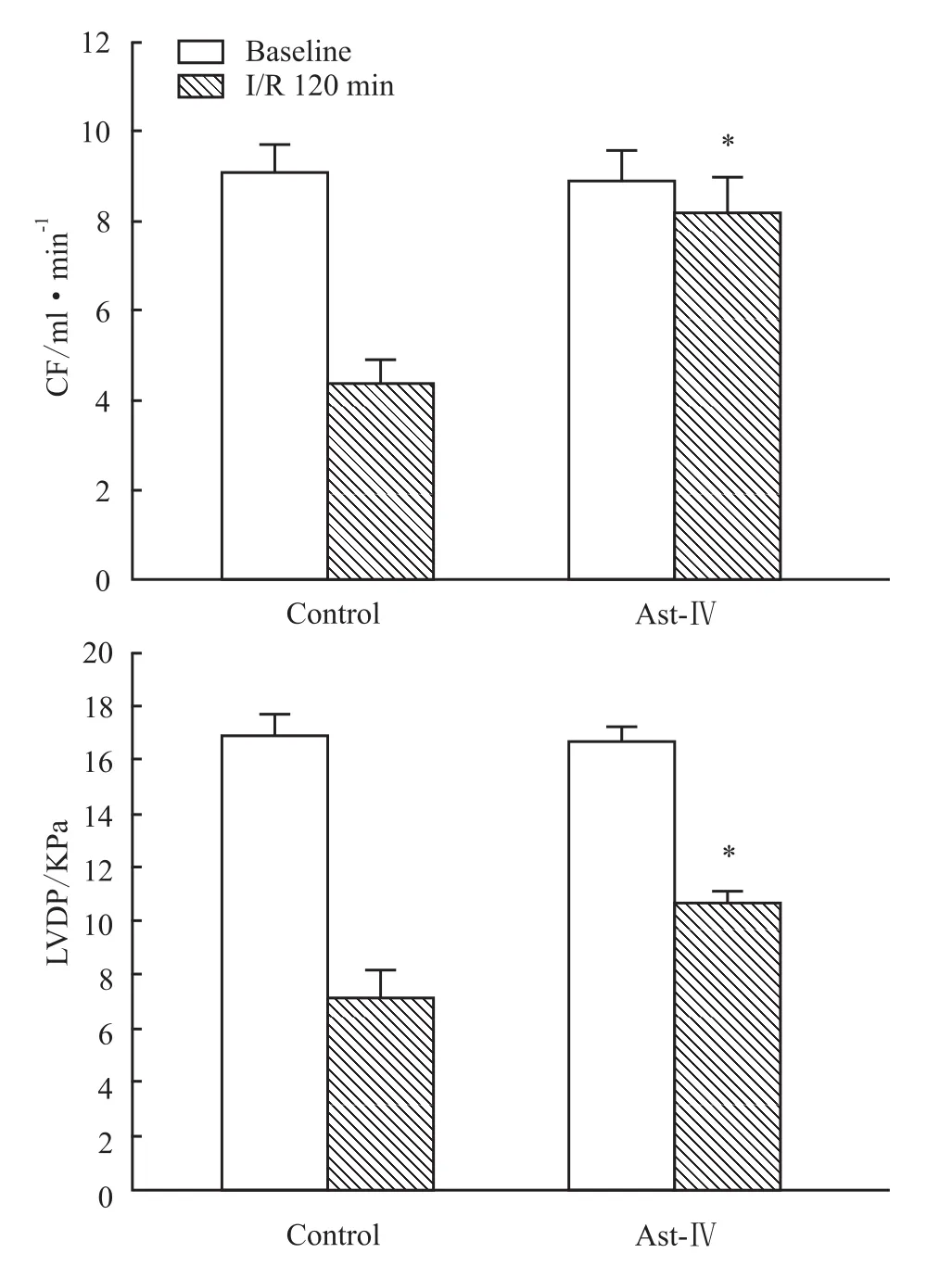
Fig 1 Effect of Astragaloside IV on cardiac contractile function at reperfusion
3.3 黄芪甲苷对心肌梗死面积的影响 与对照组相比,黄芪甲苷明显减少心肌梗死面积。黄芪甲苷的这种抗梗死作用被mPTP开放剂atractyloside所逆转,说明黄芪甲苷通过抑制mPTP开放来保护再灌注心脏(Fig 3)。
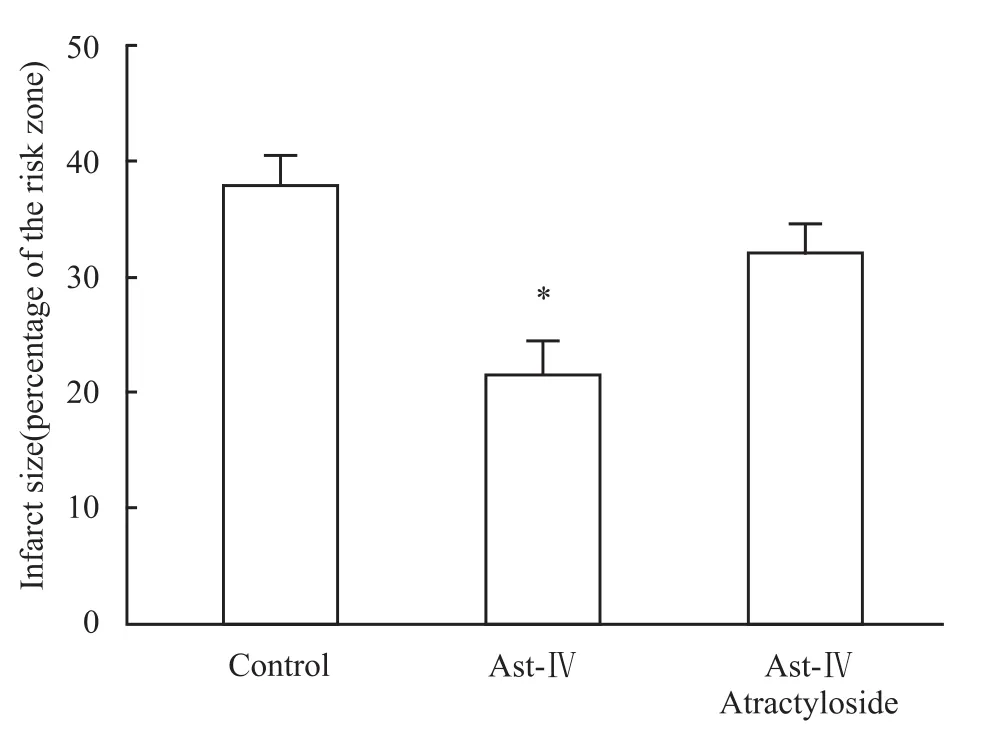
Fig 3 Effect of Astragaloside IV on infarct size
3.4 黄芪甲苷对mPTP开放的影响 如Fig 4所示,在加入200μmol·L-1CaCl2后,对照组线粒体520 nm的吸光度明显减少,提示高Ca2+使mPTP开放而导致线粒体肿胀。相反,黄芪甲苷能够模拟mPTP抑制剂CsA,明显阻止Ca2+诱导的吸光度减少,提示黄芪甲苷能够抑制mPTP的开放。
3.5 黄芪甲苷对 GSK-3β磷酸化的影响 由于GSK-3β的失活能够抑制mPTP的开放,因此本研究观察了黄芪甲苷对离体心脏再灌注时GSK-3β-Ser9位点磷酸化的影响。结果如Fig 5所示,黄芪甲苷使再灌注5 min和10 min的GSK-3β磷酸化明显增加,说明黄芪甲苷通过使GSK-3β失活而抑制mPTP的开放。
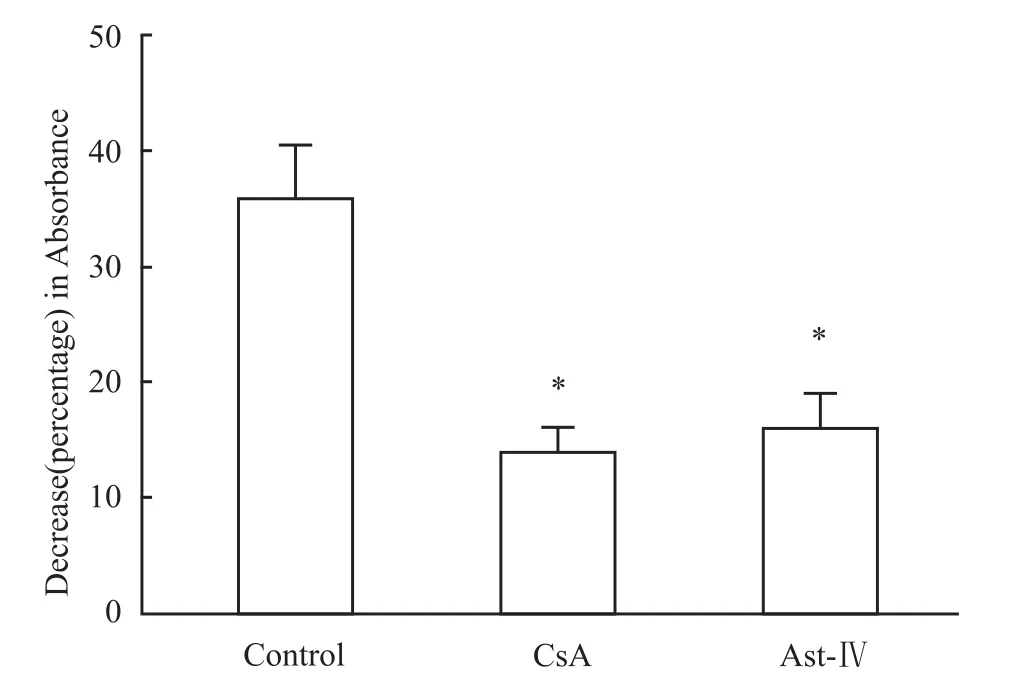
Fig 4 Effect of Astragaloside IV on mPTP opening
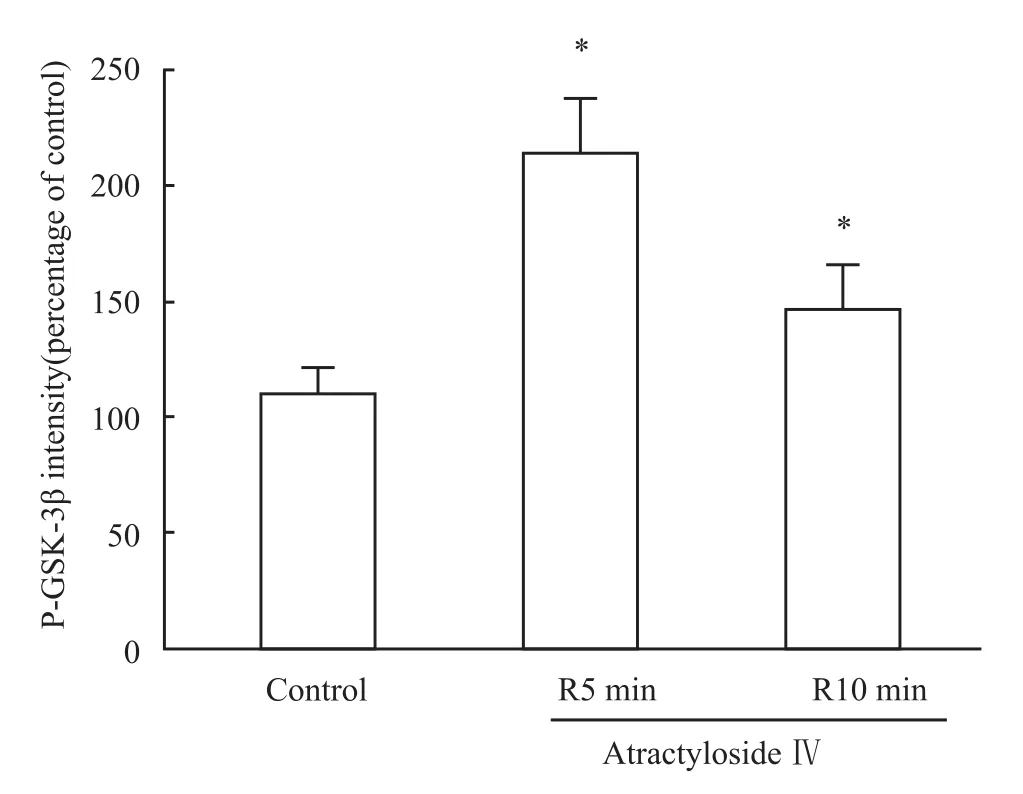
Fig 5 Effect of Astragaloside IV on GSK-3βphosphorylation
4 讨论
黄芪甲苷是从中药黄芪中分离得到的一种皂苷类化合物,是黄芪的重要活性成分。研究显示[1],黄芪甲苷具有心肌保护作用。然而,其保护心脏的具体细胞信号转导机制尚不明确,尤其是心肌线粒体保护途径的研究还比较少。后处理即有效缓解再灌注损伤,是决定MIRI预后的关键。本研究通过Lengandorff系统建立大鼠离体MIRI模型,观察黄芪甲苷能否保护再灌注心脏及其可能的信号转导机制。
通过生物信号采集系统进行心功能指标测定,结果显示对照组和黄芪甲苷组间的基础数据即结扎冠状动脉之前的HR、CF、LVDP、EDP等差异并无显著性。但再灌注120 min时,黄芪甲苷组CF、LVDP明显高于对照组(P<0.05),说明黄芪甲苷能够改善再灌注心肌收缩功能。
线粒体的主要作用是通过氧化磷酸化生成ATP,供给细胞能量。近年来的研究表明,线粒体在心肌再灌注损伤中起关键性作用,这主要是因为线粒体膜上存在线粒体通透性转移孔(mitochondrial permeability transition pore,mPTP)。在正常生理条件下mPTP闭合,阻止离子和代谢物质通透,从而保持线粒体的正常结构和功能。但在应激条件下(如缺血、缺氧),此孔被打开并允许分子质量小于1.5 ku的物质如H+和水自由通过粒线体膜,最终以坏死和凋亡两种方式损伤细胞。研究证实,mPTP在心肌缺血/再灌注损伤中起决定性作用[2-3],而且mPTP开放发生在再灌注最初几分钟,而不是在缺血期[4],说明再灌注初期是保护心脏的关键。最近研究证实,吗啡[5]和白藜芦醇[6-7]也通过抑制mPTP的开放而保护再灌注心肌。本研究电镜结果显示,黄芪甲苷能够减轻再灌注引起的线粒体肿胀、空泡化,证实黄芪甲苷的心肌保护作用与线粒体有关。黄芪甲苷能够明显减少心肌梗死面积,其抗梗死作用被mPTP开放剂Atractyloside所抑制,说明黄芪甲苷通过阻止mPTP开放保护再灌注心脏。黄芪甲苷能够模拟mPTP抑制剂CsA,明显抑制Ca2+诱导的线粒体肿胀,进一步证实黄芪甲苷通过抑制mPTP开放,保护再灌注心脏。
糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)的主要作用是通过磷酸化多种底物蛋白以调节糖原的合成代谢,并参与细胞增殖、分化和凋亡及细胞运动等生命过程[8]。GSK-3β受Ser9和Tyr216位点磷酸化的调节,Ser9磷酸化使GSK-3β活性降低,而静息状态时Tyr216磷酸化使GSK-3β活性增高[9]。研究显示[7,10],GSK-3β在心肌保护中具有非常重要的意义,其Ser9位点的磷酸化抑制其活性,进一步阻止mPTP的开放,是心肌保护的关键[9]。我们的前期研究显示,吗啡、白藜芦醇、腺苷等[5,7,11]通过抑制 GSK-3β活性,阻止 mPTP开放,发挥心肌保护作用。本研究结果显示,黄芪甲苷明显增加再灌注GSK-3βSer9的磷酸化,提示抑制GSK-3β活性阻止mPTP开放,是黄芪甲苷心肌保护作用的机制之一。
本实验结果显示,黄芪甲苷可明显增加再灌注心脏的CF、LVDP,明显减少再灌注心肌线粒体肿胀及空泡化,明显减少心肌梗死面积,明显增加GSK-3β磷酸化水平。以上研究结果提示,黄芪甲苷可明显改善再灌注心肌功能,减少心肌梗死面积,其机制可能与抑制GSK-3β活性,进而阻止mPTP开放有关。
参考文献:
[1]Zhang W D,Chen H,Zhang C,et al.Astragaloside IV from Astragalus membranaceus shows cardioprotection during myocardial ischemia in vivo and in vitro[J].Planta.Med,2006,72(1):4-8.
[2]Halestrap A P.A pore way to die:the role of mitochondria in reperfusion injury and cardioprotection[J].Biochem Soc Trans,2010,38(4):841-60.
[3]Weiss JN,Korge P,Honda H M,et al.Role of the mitochondrial permeability transition in myocardial disease[J].Circ Res,2003,93(4):292-301.
[4]Xu Z,Park S S,Mueller R A,et al.Adenosine produces nitric oxide and prevents mitochondrial oxidant damage in rat cardiomyocytes[J].Cardiovasc Res,2005,65(4):803-12.
[5]Xi J,Tian W,Zhang L,et al.Morphine prevents the mitochondrial permeability transition pore opening through NO/cGMP/PKG/Zn2+/GSK-3βsignal pathway in cardiomyocytes[J].Am J Physiol Heart Circ Physiol,2010,298(2):H601-7.
[6]廖章萍,章志玲,邹逢琳,等.白藜芦醇对抗线粒体电压依赖性阴离子通道介导心肌损伤作用的研究[J].中国药理学通报,2011,27(4):477-81.
[6]Liao Z P,Zhang Z L,Zou F L,et al.Resveratrol protects against anoxia/reoxygenation injury mediated by mitochondrial VDAC in cardiomyocytes[J].Chin Pharmacol Bull,2011,27(4):477-81.
[7]贺永贵,孙玉洁,谢宇曦,等.糖原合成酶激酶3β在白藜芦醇诱导的大鼠心肌线粒体保护中的作用及其机制[J].中华心血管病杂志,2012,40(10):858-63.
[7]He Y G,Sun Y J,Xie Y X,et al.Resveratrol attenuates oxidantinduced mitochondrial damage in embryonic rat cardiomyocytes via inactivating GSK3β[J].Chin J Cardiol,2012,40(10):858-63.
[8]Miura T,Tanno M.Mitochondria and GSK-3beta in cardioprotection against ischemia/reperfusion injury[J].Cardiovasc Drugs T-her,2010,24(3):255-63.
[9]Miura T,Tanno M.The mPTP and its regulatory proteins:final common targets of signalling pathways for protection against necrosis[J].Cardiovasc Res,2012,94(2):181-9.
[10]Gress E R,Hsu A K,Gress GJ.Opioid-induced cardioprotection occurs via glycogen synthase kinase 3βinhibition during reperfusion in intact rat hearts[J].Circ Res,2004,94(7):960-6.
[11]Xi J,McIntosh R,Shen X,et al.Adenosine A2A and A2B receptors work in concert to induce a strong protection against reperfusion injury in rat hearts[J].JMol Cell Cardiol,2009,47(5):684-90.
