背侧海马CA1区5-HT2A受体超微分布以及对神经元电活动影响
2014-05-18章功良
庞 刚,章功良
(安徽医科大学1.人体解剖学教研室、2.生理学教研室,安徽 合肥 230032)
脑内5-羟色胺(5-hydroxytryptamine,serotonin,5-HT)神经递质系统可调节机体记忆和其它认知行为反应,以适应内、外环境的变化,5-HT2A受体可能是介导这些作用的靶点之一[1-2]。5-HT2A受体属G蛋白偶联膜受体家族,激活后可增强磷脂酶C的活性,提高细胞内 Ca2+浓度[3]。大量研究表明,5-HT2A受体激活可促进啮齿类动物和人类的学习和记忆活动[4-8]。形态学研究发现,5-HT2A受体大量存在于调节认知、特别是与记忆相关的中枢结构,如海马、杏仁体和大脑皮质[2,9]。海马含有多种类型的锥体细胞和中间神经元,其接受脑干中缝核5-HT能神经元的纤维投射[2,10],5-HT可能是通过与海马谷氨酸能神经元和抑制性中间神经元的相互作用而调节记忆[11-12]。在功能上,激活5-HT2A受体可增加谷氨酸释放[12]、NMDA受体敏感度[13]和啮齿类动物的条件操作性记忆[13],而受体阻断则可产生相反结果[14-16],提示海马5-HT2A受体和谷氨酸NMDA受体存在结构和功能协同关系。然而,海马5-HT2A受体的亚细胞定位及其与NMDA受体的空间关系尚不明确。为此,本研究采用包埋后免疫电镜技术确定5-HT2A受体在大鼠背侧海马CA1(dCA1)区的亚细胞分布及与NMDA受体分布的关系。我们前期研究发现,5-HT2A受体激动剂TCB-2可增加海马依赖性记忆[4],但其中枢机制尚不明确。海马可能是一个重要的靶点,为明确5-HT2A受体兴奋后的海马神经元细胞电生理变化,我们采用多通道记录方法观测其对神经元电活动的影响,以进一步明确5-HT2A受体在海马依赖性记忆中的作用机制,丰富海马记忆理论,并为治疗记忆障碍的新药开发提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年SPF级动物(实验动物生产许可证号:34000200000043),♂。Sprague-Dawley大鼠(体质量220~250 g)由安徽医科大学实验动物中心提供,C57BL小鼠(体质量20~25 g)购自Jackson实验室。动物置于12/12 h明/暗环境中,环境温度22℃~25℃,动物自由摄食水。动物使用严格遵循安徽医科大学和安徽省实验动物中心医学科研动物使用守则。
1.1.2 药物和试剂 水合氯醛(国药集团);小鼠抗大鼠谷氨酸受体抗体(Merck Millipore,MAB397,美国);生物素标记山羊抗小鼠 IgG(Calbiochem,401213,美国);兔抗大鼠 5-HT2A受体抗体(Calbiochem,PC176,美国);5 nm胶体金标记山羊抗兔IgG(Sigma,G7277,美国);进口羊血清工作液、DAB(中杉金桥);TCB-2(Torcis,2592,美国)。
1.1.3 仪器 JEM-1230透射电镜(JEOL,日本);旋钮器(Instech,美国);Plexon多通道采集处理系统(Plexon Inc,美国);NeuroExplorer(3.266版本,Nex Technologies,MA,美国);脑立体定位仪(淮北振华)。
1.2 方法
1.2.1 包埋后免疫电镜技术 SD大鼠10只,水合氯醛(70 g·L-1,350 mg·kg-1)腹腔内注射麻醉后,剖开胸腔,经左心室插管至升主动脉,PBS缓冲液快速冲洗,4%多聚甲醛灌注固定。完毕后,完整取出脑组织。参照Paxinos和Watson《大鼠脑立体定位图谱》,从脑组织中剥离dCA1区,切成1 mm3大小,固定于2.5%戊二醛及1%锇酸,环氧树脂Epon-812包埋,超薄切片70 nm,载于200~300网孔镍网上。置3%H2O2内20min,双蒸水冲洗3次;浮于正常羊血清(1∶50)30 min,PBS冲洗;孵育于小鼠抗大鼠谷氨酸受体抗体(1∶50),4℃过夜;PBS冲洗3次后,生物素标记山羊抗小鼠IgG(1∶100)30 min,PBS冲洗;DAB(1∶50)显色10 min,PBS冲洗;将镍网翻过来,浮于正常羊血清(1∶50)30 min,PBS冲洗;孵育于兔抗大鼠5-HT2A受体抗体(1∶50)5 h,PBS冲洗;5 nm胶体金标记山羊抗兔IgG(1∶5)37℃ 30 min,PBS冲洗;醋酸铀和柠檬酸铅双重染色,透射电镜观察并摄片。
1.2.2 在体自由运动大鼠单细胞放电记录和数据分析 C57BL小鼠20只,随机分为实验组和对照组。通过脑立体定位手术植入16通道(4个四电极)可移动式微电极阵列,调节电极深度以记录右侧dCA1锥体细胞层的电活动。术后动物休息1周。实验组给予TCB-2(1.0 mg·kg-1)腹腔注射,对照组给予生理盐水。采用Plexon多通道采集处理系统记录神经元放电(滤波150~8000 Hz,采样频率40 kHz)和场电位(滤波0.7~400 Hz,采样频率1 kHz),同步采用Plexon CinePlex图像追踪系统记录小鼠行为学。Plexon SortClient软件(2.6版本)记录场电位、神经元放电波形及其对应的时间标记,保存为 Plexon系统格式化文件(*.plx)。利用Plexon OfflineSorter软件(3.2.1版本),采用手工和自动方法分析筛选神经元放电信号,仅对清晰的、在1 ms不应期内放电比例<0.5%的神经元放电进行分析。基于神经元放电活动特性区分锥体细胞和中间神经元。锥体细胞的放电特征有:①低平均放电频率(0.5~10 Hz)和不规则放电模式;②峰电位间距直方图显示短峰电位间距(3~10 ms)占据优势,呈现特征性3~5 ms峰间距后指数性衰减;③宽波形(>300μs)。而中间神经元的放电特征为相对狭窄波形(<250μs)、高平均放电频率(>5 Hz)和峰电位间距直方图呈现延迟的尖峰和更为缓慢的衰减。采用NeuroExplorer(3.266版本)来分析神经元放电波形及其特征。
1.3 统计学分析 采用 SPSS21.0软件,应用Student t检验、Two-Way ANOVA和SNK多重检验。
2 结果
2.1 SD大鼠海马dCA1区5-HT2A受体的配布电镜下观察到标记5-HT2A受体的纳米金颗粒电子密度高,呈颗粒状,广泛分布神经元的粗面内质网、轴突内神经丝,以及末端的突触和突触小泡内,胞核和线粒体内也有少量分布;谷氨酸NMDA受体免疫阳性产物呈絮状,分布亦较广泛,并在突触小泡、神经丝处与5-HT2A受体共区域表达(Fig 1)。
2.2 激活小鼠背侧海马CA1区5-HT2A受体对电活动的影响 腹腔给药前,对照组主神经元放电频率为(0.55±0.16)Hz,实验组为(0.49±0.15)Hz。给药后,对照组主神经元放电频率无明显变化,为(0.59±0.20)Hz(t=-0.398,P>0.05,配对 t检验);而实验组则明显升高,为(0.69±0.17)Hz(t=-2.227,P<0.05)。而中间神经元放电频率在给药前,对照组为(8.37±1.92)Hz,实验组为(8.92±2.03)Hz;给药后均无显著性变化,对照组为(8.79±2.02)Hz(t=-0.732,P>0.05),实验组为(7.81±1.73)Hz(t=-1.873,P>0.05)(Fig 2)。
3 讨论
本研究发现,5-HT2A受体在海马dCA1区神经元内分布广泛,并在突触、突触小泡和神经丝等处与NMDA受体共区域表达;激活dCA1区5-HT2A受体,可致主神经元的放电频率明显升高,而对中间神经元的放电频率无明显影响。我们前期研究发现[4],5-HT2A受体激活可促进动物的学习和记忆活动,本研究在此基础上进一步发现海马可能是5-HT2A受体调节学习和记忆的一个重要靶点。
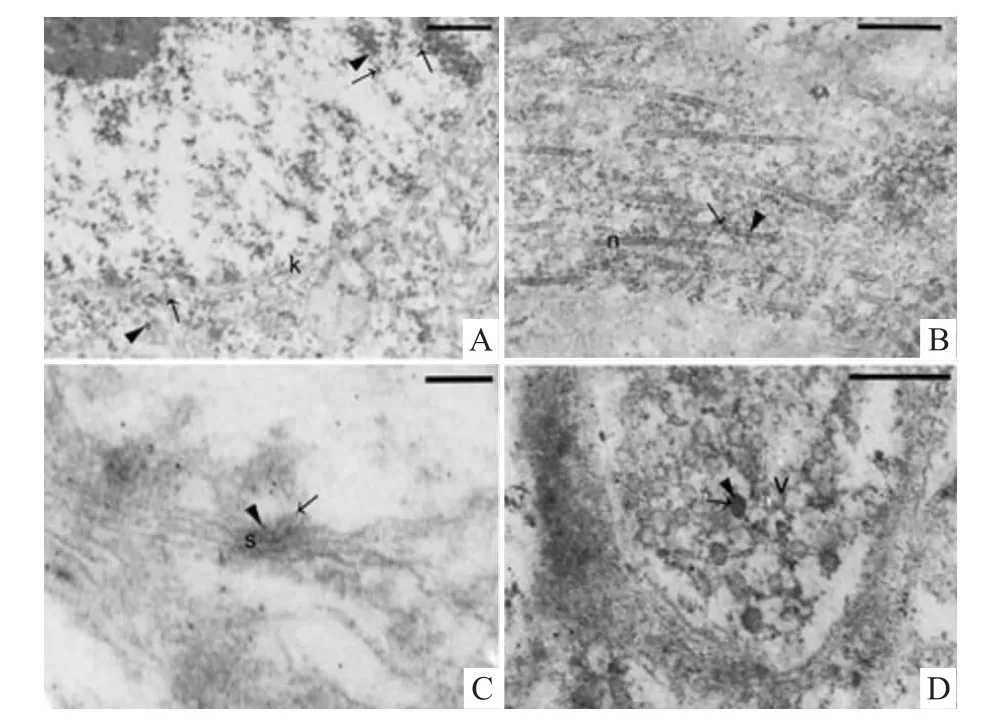
Fig 1 Colocalization of serotonin 2A receptor with glutamate NMDA receptor in dorsal hippocampal CA1 areaA:Cell nucleus and cytoplasm(bar=500 nm);B:Neurofilament(bar=200 nm);C:Synapse(bar=100 nm);D:Synaptic vesicle(bar=200 nm).→:serotonin 2A receptor immunoreactivity;▲:glutamate receptor immunoreactivity;k:karyotheca;n:neurofilament;s:synapse;v:synaptic vesicle.

Fig 2 Activation of the serotonin 2A receptor increases principal neuronal firing rate in dorsal hippocam pal CA1 areaA:Brain atlas showing the location of recording as indicated by red circle.B:Top,time bin=0.05s;middle,principalneuron firing pattern;bottom,interneuron firing pattern.C:Principle components,blue showing interneuron firing cluster and green showing principal neuron firing cluser.Grey ones are noise.D:Principal neuron(green)and interneuron(blue)firingwaveforms;grid 500μV,100μsec.E:Autocorrelograms of principal neuron(top)and interneuron(bottom);bin=5 ms.F:TCB-2 enhanced principal neuron firing rate.G:TCB-2 did not affect interneuron firing rate.*P<0.05 vs pre-treatment.
学习和记忆是脑的重要高级功能之一,机体通过获取新信息并加以储存、利用以保证生存和进化[4]。但随着生理性老化或罹患神经退行性疾病,脑均可出现不同程度的学习和记忆障碍。海马是调控记忆和认知的重要中枢之一,其实时接受、分析、修饰各种时间性和空间性环境信息,并将新、旧信息进行整合、偶联以更新现有认识思维。海马神经元和神经网络电活动介导空间性、非空间性的信息和事件的处理。海马锥体细胞接受脑干中缝核5-HT能神经纤维投射并表达5-HT2A受体[6]。dCA1区在海马依赖性学习和记忆中占有重要地位[17],光镜下已证实海马5-HT2A受体蛋白表达,但其在dCA1区的亚细胞定位仍不清楚。通过本研究我们发现,5-HT2A受体与NMDA受体存在空间相邻关系,提示这两种受体可能相互影响,并可通过突触前和突触后机制调节记忆和其它海马功能。理论上,不同的受体空间位置可有不同的调控机制。在突触后膜谷氨酸NMDA受体通过调控长时程增强(LTP)和突触可塑性促进记忆的巩固。激活突触后膜上的5-HT2A受体可去极化膜电位和增加细胞内Ca2+浓度,从而易化NMDA受体,促进记忆和其它海马功能;激活突触间隙外细胞膜的5-HT2A受体,可通过G蛋白机制调节膜电位和(或)细胞内信号转导影响突触可塑性、学习和记忆。
形态学已证实5-HT2A受体在dCA1区内有广泛表达,此受体可调节谷氨酸能神经元活动和NMDA受体活性。兴奋5-HT2A受体可增加dCA1区细胞外谷氨酸浓度,据此可以推测dCA1区5-HT2A受体通过改变海马谷氨酸水平来调节海马依赖性学习和记忆活动[18]。dCA1区锥体细胞是海马记忆系统的基本组分,记录其活动可评价海马记忆进程[19]。本研究通过腹腔注射TCB-2激活dCA1区5-HT2A受体,单神经元细胞外放电记录技术显示主神经元的放电频率明显升高,而中间神经元的放电频率无明显变化,提示5-HT2A受体可通过改变海马锥体细胞的机能活动而影响学习和记忆进程。
总之,本研究发现海马dCA1区神经元内广泛表达5-HT2A受体并存在与NMDA受体存在空间相关性,电生理和神经化学实验结果显示,激活此区5-HT2A受体可致主神经元放电频率和谷氨酸浓度升高,这提示了5-HT2A受体可通过改变海马锥体细胞的机能活动和谷氨酸水平来调节学习和记忆活动。
参考文献:
[1] Bekinschtein P,Renner M C,Gonzalez M C,Weisstaub N.Role of medial prefrontal cortex serotonin 2A receptors in the control of retrieval of recognition memory in rats[J].J Neurosci,2013,33(40):15716-25.
[2] Jacobs B L,Azmitia EC.Structure and function of the brain serotonin system[J].Physiol Rev,1992,72(1):165-229.
[3] Hoyer D,Clarke D E,Fozard JR,et al.International union of pharmacology classification of receptors for 5-hydroxytryptamine(serotonin)[J].Pharmacol Rev,1994,46(2):157-203.
[4] Zhang G,Ásgeirsdóttir H N,Cohen SJ,etal.Stimulation of serotonin 2A receptors facilitates consolidation and extinction of fear memory in C57BL/6Jmice[J].Neuropharmacology,2013,64:403-13.
[5] Wagner M,Schuhmacher A,Schwab S,etal.The His452Tyr variant of the gene encoding the5-HT2Areceptor is specifically associated with consolidation of episodic memory in humans[J].Int J Neuropsychopharmacol,2008,11(8):1163-7.
[6] Khaliq S,Haider S,Ahmed SP,etal.Relationship ofbrain tryptophan and serotonin in improving cognitive performance in rats[J].Pak JPharm Sci,2006,19(1):11-5.
[7] Levkovitz Y,Ophir-Shaham O,Bloch Y,etal.Effectof L-tryptophan on memory in patients with schizophrenia[J].JNerv Ment Dis,2003,191(9):568-73.
[8] Porter R J,Lunn B S,O′Brien J T.Effects of acute tryptophan depletion on cognitive function in Alzheimer′s disease and in the healthy elderly[J].Psychol Med,2003,33(1):41-9.
[9] Cornea-Hébert V,Riad M,Wu C,et al.Cellular and subcellular distribution of the serotonin 5-HT2Areceptor in the central nervous system of adult rat[J].J Comp Neurol,1999,409(2):187-209.
[10]Vertes R P.A PHA-L analysis of ascending projections of the dorsal raphe nucleus in the rat[J].JComp Neurol,1991,313(4):643-68.
[11]Boast C,Bartolomeo A C,Morris H,Moyer JA.5HT antagonists attenuate MK801-impaired radial arm maze performance in rats[J].Neurobiol Learn Mem,1999,71(3):259-71.
[12]Ciranna L.Serotonin as amodulator of glutamate-and GABA-mediated neurotransmission:implications in physiological functions and in pathology[J].Curr Neuropharmacol,2006,4(2):101-14.
[13]Arvanov V L,Liang X,Magro P,et al.A pre-and postsynaptic modulatory action of 5-HT and the 5-HT2A,2C receptor agonist DOB on NMDA-evoked responses in the ratmedial prefrontal cortex[J].Eur JNeurosci,1999,11(8):2917-34.
[14]Ceglia I,CarliM,Baviera M,etal.The5-HT receptor antagonist M100,907 prevents extracellular glutamate rising in response to NMDA receptor blockade in themPFC[J].JNeurochem,2004,91(1):189-99.
[15]Higgins G A,Enderlin M,Haman M,Fletcher P J.The 5-HT2Areceptor antagonist M100,907 attenuates motor and‘impulsivetype’behaviours produced by NMDA receptor antagonism[J].Psychopharmacology(Berl),2003,170(3):309-19.
[16]Welsh SE,Romano A G,Harvey JA.Effects of serotonin 5-HT(2A/2C)antagonists on associative learning in the rabbit[J].Psychopharmacology(Berl),1998,137(2):157-63.
[17]Martin S J,Clark R E.The rodent hippocampus and spatialmemory:from synapses to systems[J].Cell Mol Life Sci,2007,64(4):401-31.
[18]MocciG,Jiménez-Sánchez L,Adell A,et al.Expression of 5-HT2Areceptors in prefrontal cortex pyramidal neurons projecting to nucleus accumbens.Potential relevance for atypical antipsychotic action[J].Neuropharmacology,2014,79:49-58.
[19]DragoiG,Tonegawa S.Preplay of future place cell sequences by hippocampal cellular assemblies[J].Nature, 2011, 469(7330):397-401.
