下丘脑室旁核ATP敏感性钾离子通道参与大鼠炎性痛调节的作用研究
2014-05-18张秀丽闫巍巍刘东志张励才
张秀丽,闫巍巍,刘东志,张励才
(1.徐州医学院江苏省麻醉学重点实验室,江苏 徐州 221002;2.嘉兴市第二医院麻醉科,浙江嘉兴 314000)
炎性痛相关因素包括周围组织损伤、缺血、缺氧、酸中毒,临床治疗炎性痛是医生面对的一个难题。目前的研究主要集中在炎性痛与受体、离子通道、神经递质的关系上。在炎性痛条件下,伤害性神经递质,如组胺和5-羟色胺等的释放增加,刺激了外周和中枢神经系统伤害性感受器,从而提高神经细胞的兴奋性,增加背根神经节、脊髓和脑组织痛相关物质的表达[1-3]。ATP敏感性钾离子通道广泛表达于中枢神经元,并调节其膜兴奋性、神经递质的释放和参与神经保护[4]。研究表明,侧脑室内注入KATP通道开放剂克罗卡林和吡那地尔可以增强皮下注射吗啡引起的镇痛作用,这种增强效应可以被KATP通道特异性阻断剂格列本脲消除,提示这种镇痛作用的发挥与KATP通道有关[5]。DAMGO(一种μ阿片受体激动剂)注入丘脑中央下核(thalamic nucleus submedius,Sm),减少脊髓背角c-Fos表达和抑制畏惧行为,而这种效应可以被核团内预先注射格列本脲所阻断[6]。这说明KATP通道可能在脊髓上水平参与疼痛信号调控。越来越多的研究显示,下丘脑室旁核参与疼痛调控。因此,本研究采用一种常用的动物疼痛模型——CFA诱导的炎性痛模型,用免疫组织化学的方法观察炎性痛条件下下丘脑室旁核神经元中KATP通道的表达变化和伤害性行为相关的脊髓背角c-Fos的表达,为进一步理解炎性痛的发病机制及探讨KATP通道在炎性痛中的作用提供参考。
1 材料与方法
1.1 试剂及器材 兔抗 kir6.2一抗(1∶200,Alomone Labs,以色列);c-Fos一抗(1∶400,Abcam,美国);FITC标记的驴抗兔(1∶200,Millipore公司,美国);组化试剂盒(北京中杉);二氮嗪(Sigma,美国);激光共聚焦显微镜(FV1000,Olympus,日本);热痛敏刺激仪(IITC series 8-390型,中国医学科学院生物工程研究所生产)。
1.2 实验动物 Sprague-Dawley大鼠,♂,250~280 g,由徐州医学院实验动物中心提供。饲养在12 h/12 h明暗光线交替、22~24℃的安静环境中,自由进食、水。所有实验均遵守《实验动物使用规范》。采用随机数字法分为5组(每组6只):正常组(Normal组)、完全弗氏佐剂致炎性痛组(CFA组)、生理盐水对照组(Saline组)、KATP通道特异性激动剂二氮嗪组(Diaoxide组)和激动剂溶媒对照组(Vehicle组)。
1.3 模型的建立 将大鼠轻轻固定,用100μl微量注射器,尽快将用生理盐水稀释后的100μl浓度为50%的完全弗氏佐剂(CFA)注入大鼠左侧后肢足底中心皮下,建立慢性炎性痛模型。对照组仅足底皮下注射生理盐水100μl。CFA足底注射后大鼠产生典型的外周炎症表现,包括:注射局部的红、肿、疼痛等,持续时间大于1周。
1.4 下丘脑室旁核核团注射 在致炎后d 3,大鼠直接以水合氯醛麻醉(300 mg·kg-1体重,ip),参照《大鼠脑立体坐标图谱》(Paxinos and Watson),于立体定位仪(日本)上向大鼠一侧侧脑室[前囟:(-1.6~1.8)mm;深:(7.8-8.0)mm;中缝向左右旁开(0.3-0.6)mm]注射二氮嗪(diaoxide)25ng(溶于0.3μl 0.5%DMSO中)。注射后15、30、60、240 min后检测热痛阈。
1.5 热缩足反射潜伏期(thermal withdrawal latency,TWL) 在相同的时间段、相同的室内温度和湿度下进行测定。按照Hargreaves法,将大鼠放置于3 mm厚的15 cm×15 cm×15 cm的有机玻璃箱中,待大鼠在其中适应30 min安静后,用热痛敏刺激仪照射大鼠左后肢足底后外侧。从照射开始至大鼠出现抬腿回避的时间为TWL。光源刺激强度恒定不变。自动切断时间为25 s,以防止组织损伤。每只动物连续测定5次,测量间隔3 min,取后3次比较平稳的数据平均值为大鼠TWL。
1.6 组织制备 大鼠用10%水合氯醛(300 mg·kg-1)腹腔注射麻醉后,经左心室-升主动脉插管,依次灌注37℃生理盐水150 ml冲洗和4℃、4%多聚甲醛溶液300 ml固定,总灌注时间为1~1.5 h。取大脑组织和脊髓后,放入4%多聚甲醛溶液中4℃后固定过夜;转入30%蔗糖溶液中4℃脱水至组织沉淀。冰冻连续冠状切片,荧光片厚40μm,取相应脑组织节段的切片;取腰脊髓L4-5节段切片,片厚 30μm。用 0.01 mol·L-1PBS(NaCl 8.0 g,KCl 0.2 g,NaH2PO40.24 g,Na2HPO43.63 g;pH 7.4)冲洗切片3次×5 min/次。
1.7 免疫荧光单标 选取完整切片至24孔孵育板中,加入含0.3%Triton-100的10%驴血清封闭液,室温封闭2h;加入兔抗kir6.2一抗(1∶200)或兔抗c-Fos一抗(1∶400),4℃孵育 48 h;0.01 mol·L-1的PBS冲洗3次×5 min/次;暗室中加入FITC标记的驴抗兔(1∶200),4℃孵育过夜,0.01 mol·L-1的PBS冲洗3次×5 min/次,贴片、室温干片、50%甘油封片,激光共聚焦显微镜避光下放大100倍、400倍,对脑和脊髓组织切片进行观察并摄片。免疫对照组用PBS代替一抗,其余步骤同前。
1.8 显微图像和细胞计数 免疫荧光染色切片采用激光共聚焦显微镜技术观测。光镜切片细胞计数方法:各例动物取相同层面KATP阳性细胞最集中的4张脑和脊髓组织切片,于100倍放大,在固定部位截取一屏(脊髓组织取脊髓背角Ⅰ、Ⅱ板层恒定位置)分别计数KATP阳性和c-Fos阳性细胞数,用于统计学分析。
1.9 统计学分析 所有计量资料均用¯x±s表示,采用SPSS13.0软件对实验数据进行统计分析,并生成统计图表。每个时间点多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用q检验;两组比较采用t检验。
2 结果
2.1 炎性痛行为学改变和脊髓c-Fos在炎性痛条件下的表达变化 CFA组和Saline组之间,术前TWL差异无统计学意义(P>0.05)。左侧足底皮下注射CFA致炎后d 1、d 3、d 7,TWL明显降低,低于术前的基础值(P<0.01);与Saline组比较,差异有统计学意义(P<0.05)。同时伴有患足红肿、行走困难及提缩患爪等一些保护性行为,而且这一效果持续至少3 d,然后才逐渐减轻。Saline组大鼠术前和术后的TWL未见明显变化,差异无统计学意义(P>0.05)。CFA致炎后 d 3、d 7,腰段脊髓背角的c-Fos表达明显增加,差异有统计学意义(P<0.01),见 Fig 1、2。
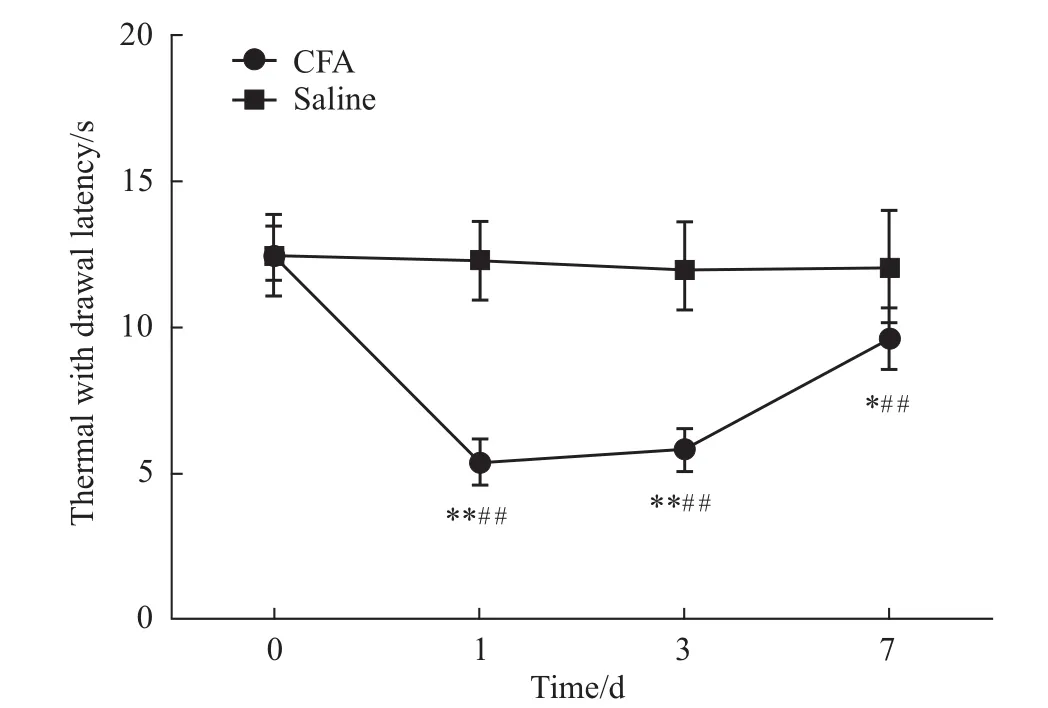
Fig 1 Timecourse of development of thermal hypersensitivity in rats after intraplantar injection with CFA or saline±s,n=6,unit:second)**P<0.01 vs saline group;##P<0.01 vs day 0
2.2 下丘脑室旁核KATP阳性神经元 CFA组和生理盐水组均可见KATP阳性细胞。CFA致炎后d 3和d 7,大鼠脑片中计数到的KATP阳性细胞数明显小于Saline组,差异有统计学意义(P<0.01),见Fig 3。
2.3 PVN内注射KATP通道特异性激动剂后大鼠痛行为学及脊髓背角c-Fos表达变化 外周致炎后d 3,室旁核给予特异性免疫激动剂后,Diaoxide组大鼠的TWL明显升高,高于给药前的TWL,与Vehicle组相比也增高,差异有统计学意义(P<0.01);这一效应在给药后10~15 min达到最大,到4 h衰减到给药前水平。Vehicle组的TWL在给药后各时间点与给药前比较均无统计学意义(P>0.05)。给予激动剂后腰脊髓c-Fos表达较给药前和Vehicle组明显下降,差异有统计学意义(P<0.01),见Fig 4,5。
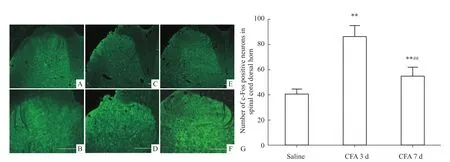
Fig 2 c-Fos-expression in dorsal spinal horn of saline group,CFA 3d and CFA 7d and numbers of c-Fos positive neurons in dorsal spinal horn of normal,CFA 3d and CFA 7d(¯x±s,n=6)Graphs A,C,E representexpression of c-Fos in saline group,CFA 3d and CFA 7d.Graphs B,D,Fare the enlargementof graphs A,C,E.**P<0.01 vs saline group;##P<0.01 vs CFA 3d.Scale bars:100μm.
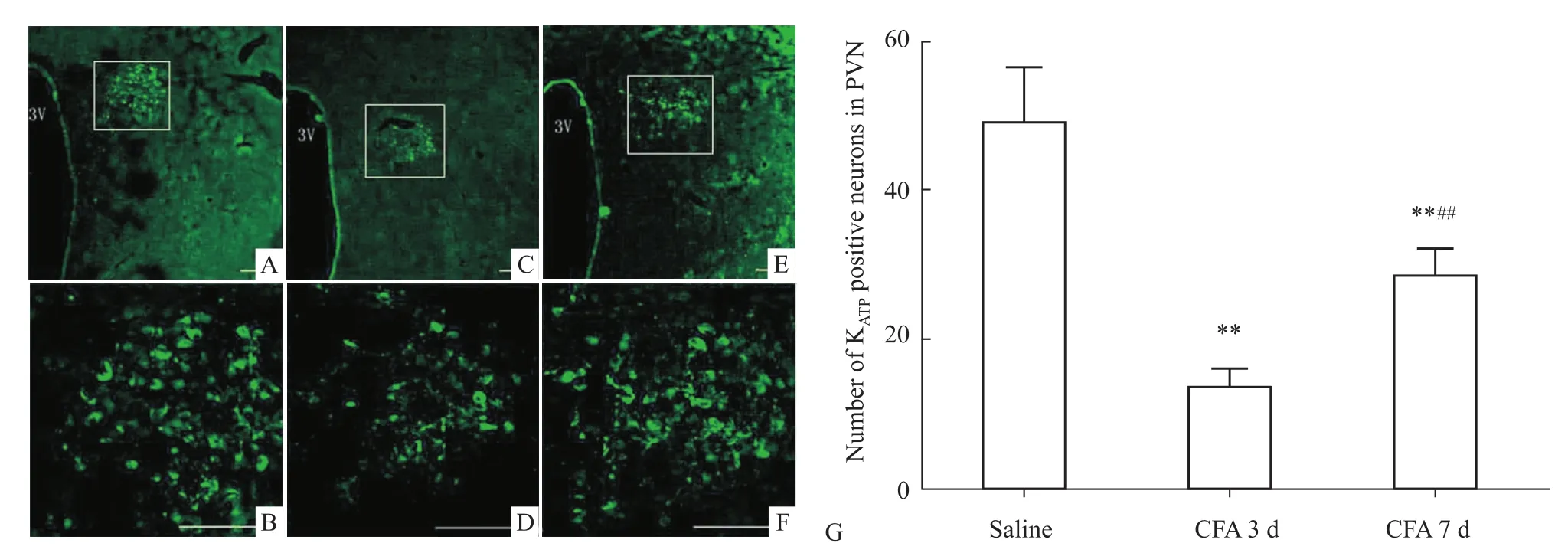
Fig 3 KATP-expression in paraventricular nucleus of saline group,CFA 3d and CFA 7d.3V:the 3rd ventricle and numbers of KATP positive neurons in PVN of saline group,CFA 3d and CFA 7d(¯x±s,n=6)Graphs A,C,E representexpression of KATP in saline group,CFA 3d and CFA 7d.Graphs B,D,F are the enlargementof graphs A,C,E.**P<0.01 vs saline group;##P<0.01 vs CFA 3d.Scale bars:100μm.
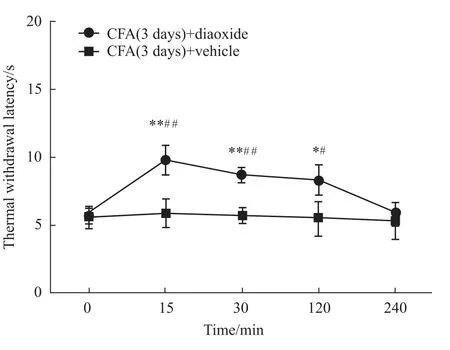
Fig 4 Effect of injection of diaoxide on TW L after CFA injection(±s,n=6,unit:second)*P<0.05,**P<0.01 vs vehicle group;#P<0.05,##P<0.01 vs0min.
3 讨论
ATP敏感性钾离子通道是一种受神经递质或细胞内ATP调控的内向整流钾通道,ATP浓度升高时其开放率明显下降。现有的研究显示,KATP通道存在于大鼠的中枢神经元及脊髓背角神经元上[7-8],调节神经元的兴奋性和神经递质的释放,可能与疼痛调控的相关机制有关。Wu等[8]研究发现坐骨神经慢性压迫性损伤(chronic constriction injury of the sciatic nerve,CCI)术后,在神经损伤的同侧可发现脊髓背角KATP亚基表达均下调,伴随着热痛和机械痛觉过敏;足底局部注射KATP通道激动剂磺脲类药物能拮抗足底注射低剂量双氯芬酸对福尔马林致炎性痛的治疗效应[9]。这些研究都说明KATP通道参与了疼痛的发生过程。
本实验采用了一种常用的实验动物模型,CFA诱导的炎性痛。该模型能成功模拟病理性疼痛典型的自发痛、痛觉过敏和触诱发痛等症状,并维持一段时间,结果证实,大鼠CFA致炎后d 1 TWL即降低,直到d 3都维持在较低水平[10]。
研究表明,生理性刺激大鼠初级感觉神经元能引起脊髓背角突触后神经元的c-Fos表达,伤害性热刺激也能升高脊髓背角Ⅰ、Ⅱ板层c-Fos的表达,而吗啡预处理可以减少上述c-Fos的表达。这从另一方面说明药物对疼痛的治疗作用也可以通过免疫组化标记c-Fos来反映[11]。c-Fos表达可作为伤害性刺激后疼痛传导和调控的标志,c-Fos表达与疼痛状态相对应。我们的研究发现,免疫组化显示,CFA注射同侧的脊髓背角有c-Fos表达且主要表达在与疼痛相关的L4-5脊髓Ⅰ、Ⅱ板层,这些结果和上述关于c-Fos的相关研究一致;注射CFA后c-Fos表达增加,d 3表达最高,这和疼痛行为学结果一致,从形态学上证明CFA炎性痛模型的成功。
研究结果表明,疼痛模型下,疼痛信号相关解剖结构的KATP通道蛋白表达下降;本实验免疫荧光结果显示,在炎性痛条件下,下丘脑室旁核KATP通道表达下降,d 3下降最明显,这与疼痛行为学变化是一致的。这说明室旁核KATP通道可能参与炎性痛的发生过程。疼痛最明显的d 3,室旁核注射KATP通道特异性激动剂二氮嗪能逆转CFA致炎引起的热痛敏,同时可减轻疼痛诱发的脊髓背角c-Fos的表达,进一步为室旁核KATP通道参与炎性痛的调控提供证据。
在脊髓水平,去甲肾上腺素(norepinephrine,NE)通过激活中间神经元的内源性阿片受体,阿片受体进一步激活KATP通道,从而产生抗伤害性刺激的作用[12]。实验表明,电刺激引起的疼痛模型下,下丘脑内源性相关肽(甲硫氨酸脑啡肽、β内啡肽)水平增加[13],而研究证实大鼠下丘脑室旁核NE在疼痛的调控过程中发挥重要作用[14],结合本实验的研究结果,我们推测下丘脑室旁核KATP通道可能是通过NE激活室旁核的内源性阿片肽受体,从而进一步激活KATP通道,参与炎性痛发生和调控的过程。
综上所述,通过对下丘脑室旁核KATP通道表达与炎性痛引起的机械痛和热痛敏之间的关系的研究,我们推测下丘脑室旁核KATP通道可能参与疼痛的发生和调控过程,为炎性痛的发生机制及治疗提供新的线索,为临床治疗炎性痛提供新的参考。
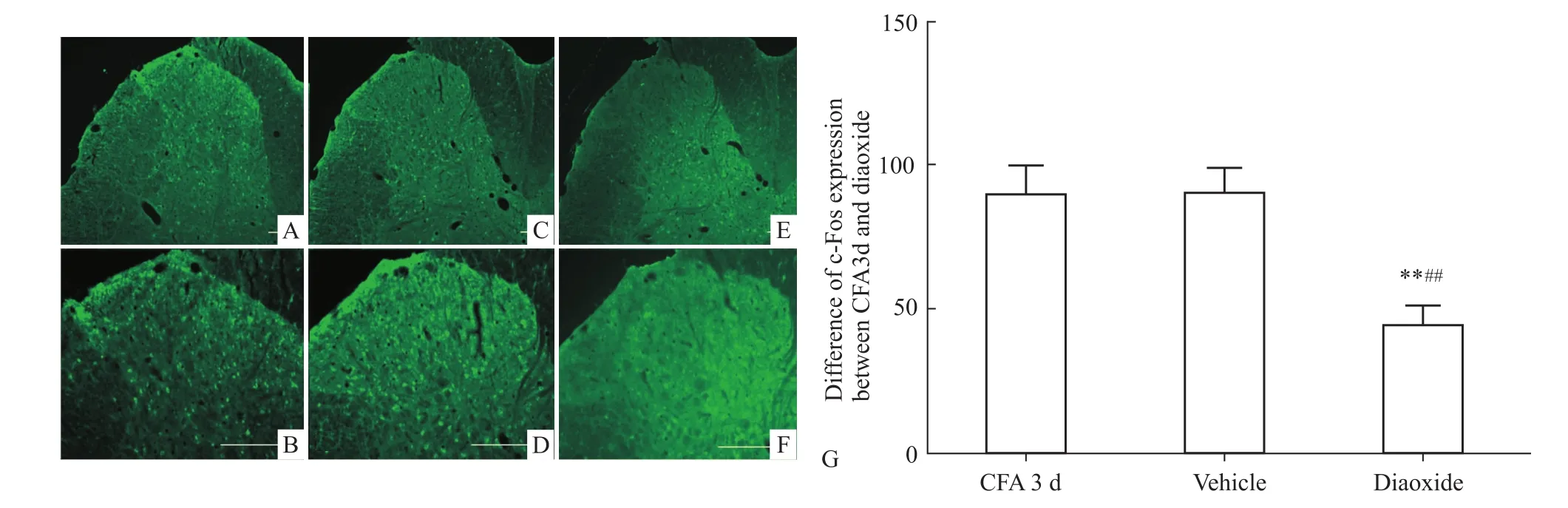
Fig 5 C-Fos-expression in dorsal spinal horn of CFA 3d,vehicle and diaoxide groups and numbers of c-Fos positive neurons in dorsal spinal horn of CFA 3d,vehicle and diaoxide groups(±s,n=6)Graphs A,C,E represent expression of c-Fos in CFA 3d,vehicle and diaoxide groups.Graphs B,D,F are the enlargement of graphs A,C,E.**P<0.01 vs CFA 3d;##P<0.01 vs vehicle group.Scale bars:100μm
参考文献:
[1] Voilley N,deWeille J,Mamet J,LazdunskiM.Nonsteroid antiinflammatory drugs inhibit both the activity and the inflammationinduced expression of acid-sensing ion channels in nociceptors[J].JNeurosci,2001,21(20):8026-33.
[2] Vaughn A H,Gold M S.Ionicmechanismsunderlying inflammatorymediator-induced sensitization of dural afferents[J].JNeurosci,2010,30(23):7878-88.
[3] Mannion R J,Costigan M,Decosterd I,et al.Neurotrophins:peripherally and centrally acting modulators of tactile stimulus-induced inflammatory pain hypersensitivity[J].PNAS,1999,96(16):9385-90.
[4] Roeper B L J.Molecular physiology of neuronal K-ATP channels[J].Mol Membr Biol,2001,18(2):117-27.
[5] Ocaña M,Cendán C M,Cobos E J,et al.Potassium channels and pain:present realities and future opportunities[J].Eur J Pharmacol,2004,500(1):203-19.
[6] Feng J,Huo FQ,Jia N,et al.Activation ofmu-opiod receptors in thalamic nucleus submedius depressses bee venome-evoked spinal c-Fos expression and flinching behaviors[J].Neuroscience,2009,161:554-60.
[7] Seino S,Miki T.Physiological and pathophysiological roles of ATP-sensitive potassium channels[J].Prog Biophys Mol Biol,2003,81(2):133-76.
[8] Wu X F,Liu W T,Liu Y P,et al.Reopening of ATP-sensitive potassium channels reduces neuropathic pain and regulates astroglial gap junctions in the rat spinal cord[J].Pain,2011,152(11):2605-15.
[9] Ortiz M I,Granados-Soto V,Castañeda-Hernández G,et al.The NO-cGMP-K+channel pathway participates in the antinociceptive effect of diclofenac,but not of indomethacin[J].Pharmacol Biochem Behav,2003,76(1):187-95.
[10]索占伟,杨 娴,曹 静,等.脊髓背角PKC在慢性炎性疼痛中的作用及其机制[J].中国药理学通报,2011,27(3):316-9.
[10]Suo ZW,Yang X,Cao J,et al.Involvement of spinal PKC in inflammatory pain and its underlyingmechanisms[J].Chin Pharmacol Bull,2011,27(3):316-9.
[11]Hunt SP,Pine A,Evan G.Induction of c-Fos-like protein in spinal cord neurons following sensory stimulation[J].Nature,1987,328:632-4.
[12]Kang Y M,Zhang Z H,Yang SW,et al.ATP-sensitive K channels are involved in themediation of intrathecal norepinephrine-or morphine-induced antinociception at the spinal level:A study using EMG planimetry of flexor reflex in rats[J].Brain Res Bull,1998,45(3):269-73.
[13]Cheng L L,Ding M X,Xiong C,et al.Effects of electroacupuncture of different frequencies on the release profile of endogenous opioid peptides in the central nerve system of goats[J].Evid Based Complement Alternat Med,2012,2012:476457.
[14]Zhou X J,Yang J,Yan F L,et al.Norepinephrine plays an important role in antinociceptivemodulation of hypothalamic paraventricular nucleus in the rat[J].Int J Neurosci,2010,120(6):428-38.
