正交设计优选丹参-人参活性组分抗乳腺癌有效配伍
2014-05-17颜晓静陈姗姗朱晶晶陈卫平
杨 烨,颜晓静,毕 蕾,陈姗姗,朱晶晶,陈卫平
(南京中医药大学基础医学院,江苏南京 210023)
乳腺癌是女性最常见的恶性肿瘤之一,发病率占恶性肿瘤的10%左右,已成为威胁妇女健康的主要病因。丹参和人参分别为活血化瘀、扶正固本类中药的代表。人参的抗肿瘤功效已被广泛证实,我们的前期研究也表明丹参的有效成分有抗肿瘤作用[1-3]。二者配伍常用于临床抗肿瘤,但缺乏相关研究和报道。本实验旨在通过正交实验方法优选丹参-人参活性成分抗乳腺癌的最佳配伍,并对其抗肿瘤机制进行初步研究,为中药组方配伍治疗乳腺癌提供科学依据。
1 仪器与材料
1.1 试剂 DMEM(Gibco,批号 8113261);EMEM(Gibco,批号 1291856);澳洲进口胎牛血清(Gibco,16000-044);2.5 g· L-1胰蛋白酶 (Gibco,批号1297729);青 -链霉素(Gibco,批号 1266382);CCK-8(Cell counting kit-8)细胞毒性试剂盒(DOJINDO日本株式会社同仁化学研究所,批号EY683);Hoechst 33342试剂盒(Thermo Scientific,批号62249);Alexa Fluor 488 Annexin V和PI细胞凋亡检测试剂盒(Invitrogen,批号 V1324);40g·L-1多聚甲醛(Sigma,批号20120421)。
1.2 仪器 高内涵细胞成像系统(VTI700,美国Thermo Scientific公司);CO2恒温培养箱(NU4950E,美国NUAIRE公司);倒置相差显微镜(DFC-259,德国Leica公司);多功能酶标仪(spectramax M5,美国Molecular Devices公司);多功能冷冻离心机(SL-16R,美国Thermo Scientific公司);实时无标记细胞传感电阻仪(3X16,瑞士Roche公司)。
1.3 细胞株与药物 人正常乳腺细胞株MCF-10A和人乳腺癌细胞株MCF-7购自于中国科学院上海生命科学研究院细胞资源中心;丹参总酚酸(80%,批号 ZL20130112)、丹参总酮(90%,批号 ZL20130206)、人参总皂苷(80%,批号ZL20130211)和人参总多糖(60%,批号ZL20130203)均购自于南京泽朗医药科技有限公司。
2 方法
2.1 正交设计 本实验采用正交实验法优选人参-丹参活性成分的有效配伍。人参-丹参组分配伍优选选取丹参总酚酸(A)、丹参总酮(B)、人参总皂苷(C)、人参多糖(D)为考察因素,每个因素选取3个水平,以MCF-10A和MCF-7细胞的抑制率为评价指标,因素水平见Tab 1。用L9(34)正交表安排实验,见Tab 2。
2.2 细胞培养 正常乳腺MCF-10A细胞采用含体积分数为0.1的胎牛血清、0.1U·L-1的青霉素和链霉素的DMEM培养液。乳腺癌MCF-7细胞采用含体积分数为0.1的胎牛血清、0.1 U·L-1的青霉素和链霉素的EMEM培养液,置于37℃、含体积分数为0.05的CO2饱和湿度细胞培养箱内传代培养。

Tab 1 Factors and levels of orthogonal test
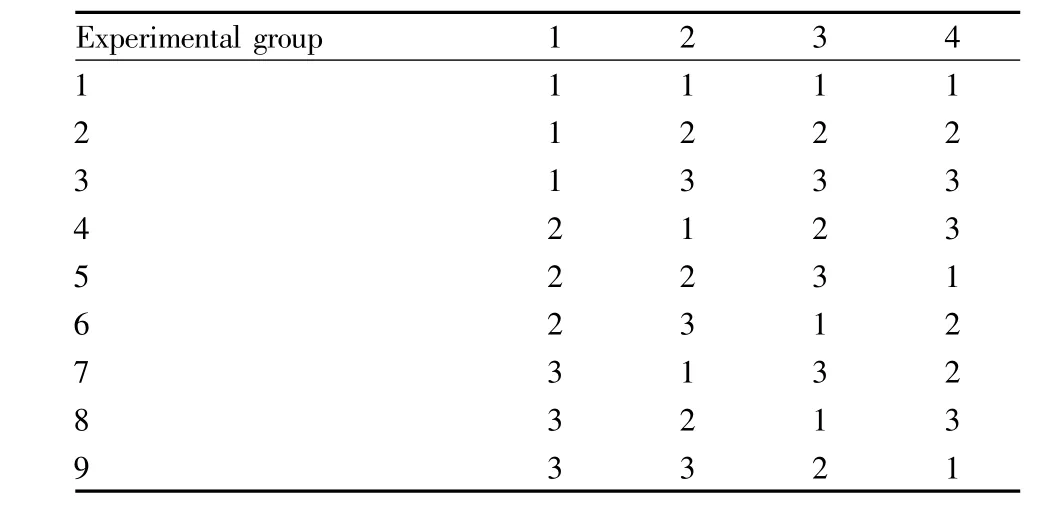
Tab 2 L 9(34)table of orthogonal test
2.3 CCK-8法测定细胞相对抑制率 取对数生长期MCF-10A和 MCF-7细胞株,2.5 g·L-1胰酶消化,调整细胞密度为每毫升1×105个细胞,每孔100 μl接种于96孔板中,置37℃,含体积分数为0.05的CO2饱和湿度培养箱中培养。按Tab 2配制丹参-人参组分1~9组,另设阴性对照组。细胞培养24 h后,小心吸弃上清,以每孔100μl依次加入所配备好的药物,阴性对照组加入等体积的细胞培养液,每组设3个复孔。37℃,含体积分数为0.05的CO2饱和湿度培养箱中培养48 h后,小心吸弃上清,每孔加入CCK-8溶液100μl,继续培养30 min,酶标仪于450 nm波长处测定吸光度(A)。按公式计算各组药对细胞生长的抑制率(IR):IR%=(1-A药物组均值/A阴性对照组均值)×100%。
2.4 细胞形态学观察 取对数生长期的MCF-10A和MCF-7细胞制成单细胞悬液,按每毫升1×105个细胞的密度接种于96孔板上,每孔100μl,置于37℃,含体积分数为0.05的CO2饱和湿度条件下,细胞培养箱中培养24 h。设给药组、阴性对照组和阳性对照组,给药组按Tab 2配制丹参-人参组分1~9组,阴性对照组加入等体积的细胞培养液,阳性对照组为顺铂(cisplatin,DDP)和紫杉醇(paclitaxel,PTX),终浓度为 10 mg·L-1,每组设 3个复孔。37℃,含体积分数为0.05的CO2饱和湿度条件下培养48 h后,放置于倒置显微镜下,观察细胞形态及生长情况并拍照。
2.5 实时细胞分析技术检测细胞增殖 取E-plate16细胞增殖检测板,加入培养基每孔100μl,培养箱中平衡30 min,置于RTCA DP中检测基线值。将细胞消化悬浮于含有血清的培养液中,吹打均匀,调整细胞密度为每毫升1×105个细胞,每孔100μl接种于E-plate16细胞增殖检测板,培养箱中平衡30 min,置于RTCA DP中动态监测24 h。吸弃E-plate16细胞增殖检测板中上清,加入配制好药物,每孔100μl,设置给药组和阴性对照组,给药组加入正交筛出的最佳组分配伍组合A2B3C1D2,即第6组,阴性对照组加入等体积的细胞培养液,培养箱中平衡30 min,再置于实时无标记细胞传感电阻仪中动态监测48 h,观察细胞增殖曲线。
2.6 高内涵细胞分析技术检测细胞凋亡 取96孔板,每孔加入多聚赖氨酸100μl包被过夜。为充分除去多聚赖氨酸,将包被好的96孔板用PBS清洗3次,每孔每次100μl。将MCF-10A和MCF-7分别消化悬浮于各自含有血清的培养液中,吹打均匀,调整细胞密度为每毫升1×105个细胞,接种于96孔板,置于37℃,含体积分数为0.05的CO2饱和湿度条件下细胞培养箱中培养24 h后给药。设置给药组和阴性对照组,给药组加入正交筛出的最佳组分配伍组合A2B3C1D2,即第6组,阴性对照组加入等体积的细胞培养液,每组设3个复孔。再将96孔板置于37℃,含体积分数为0.05的CO2饱和湿度培养箱中培养48 h。取培养48 h的96孔板,弃去细胞培养上清,然后加入Annexin V和100 mg·L-1的PI工作液,每孔50μl,室温避光孵育15 min。孵育后弃除染液,每孔加入1×Annexin-Binding buffer 100 μl,洗两遍,然后每孔加入多聚甲醛100μl,室温避光固定20 min,固定后弃除多聚甲醛,各孔加入1×Annexin-Binding buffer 100μl,洗两遍,而后加入Hoechst染液,每孔100μl,于室温避光孵育10 min。弃除染液,每孔加入1×Annexin-Binding buffer 100 μl,洗两遍,最后各孔加入100μl的1×Annexin-Binding buffer,于高内涵细胞成像系统检测。
2.7 数据分析 实验数据采用SPSS 15.0软件进行统计分析,各组定量检测数据以¯x±s表示,两组间比较采用t检验,多组间比较采用单因素方差(one-way ANOVA)分析,组间比较采用LSD检验。
3 结果
3.1 CCK-8法测定细胞相对抑制率 Tab 3显示MCF-10A和MCF-7细胞经丹参-人参组分1~9组给药后,用CCK-8法测定细胞的吸光度值及经计算所得细胞生长的抑制率(IR)。Tab 4显示了各因素不同水平的平均值,从结果上直观分析,各因素水平对结果影响的强弱顺序为:A3>A1>A2,B1>B2>B3,C2>C3>C1,D1>D3>D2。Tab 5结果表明,A、D因素对实验结果有影响(P<0.01),B因素无影响(P>0.05),影响因素主次顺序为:A>D>C>B。本实验的结果是正常乳腺细胞MCF-10A抑制率与乳腺癌细胞MCF-7抑制率的比值越小,则表明药物对正常乳腺细胞的抑制较低,而对乳腺癌细胞的抑制较高,所以平均值越小越好,确定最佳组分配伍为A2B3C1D2,即第6组药物组合。
3.2 实时细胞分析技术检测细胞增殖 Fig 1显示,丹参-人参最佳组分配伍药物对MCF-10A和MCF-7细胞增殖的影响,直观地表明从基线开始到24 h时所有细胞均平稳增殖,第24 h给药后,给药组与阴性对照组相比较,给药组对乳腺癌细胞MCF-7和正常乳腺细胞MCF-10A均有抑制增殖的作用,给药后24 h对MCF-7细胞的增殖抑制作用强于对MCF-10A细胞的增殖抑制作用,并且可以看出对MCF-7细胞呈现持续的抑制增殖作用,而对于正常乳腺细胞则呈现先抑制后又抑制减弱的状态。提示所筛选出的丹参-人参组分配伍最优组合对乳腺癌细胞确有较好的抑制增殖作用,而对正常乳腺细胞的增殖抑制作用较小。
Tab 3 Inhibition of MCF-10A and MCF-7 cell growth of orthogonal test(±s,n=6)
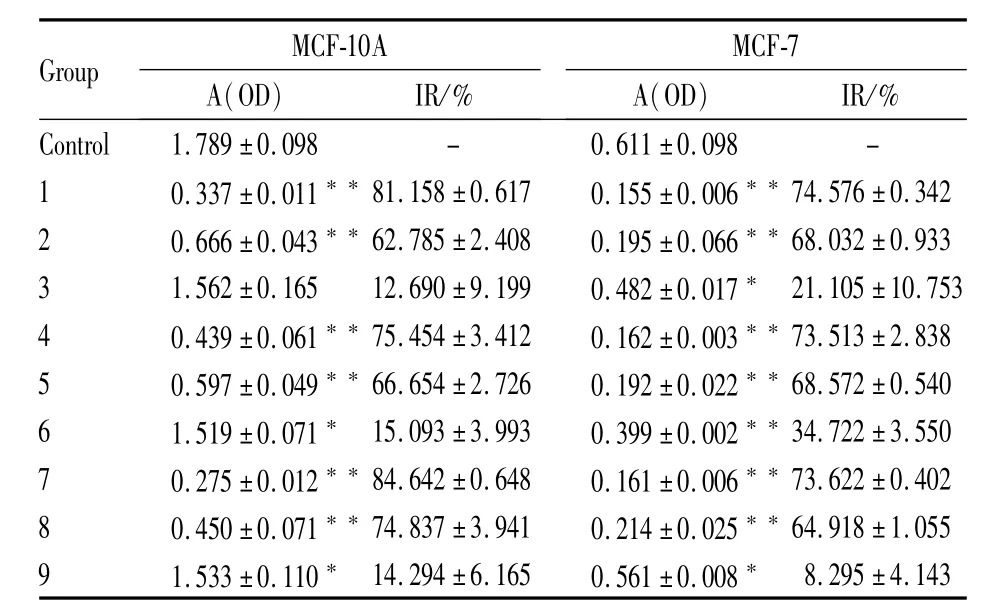
Tab 3 Inhibition of MCF-10A and MCF-7 cell growth of orthogonal test(±s,n=6)
*P<0.05,**P<0.01 vs control
Group MCF-10A A(OD)IR/%MCF-7 A(OD)IR/%Control 1.789±0.098 - 0.611±0.098 -1 0.337±0.011**81.158±0.617 0.155±0.006**74.576±0.342 2 0.666±0.043**62.785±2.408 0.195±0.066**68.032±0.933 3 1.562±0.165 12.690±9.199 0.482±0.017*21.105±10.753 4 0.439±0.061**75.454±3.412 0.162±0.003**73.513±2.838 5 0.597±0.049**66.654±2.726 0.192±0.022**68.572±0.540 6 1.519±0.071*15.093±3.993 0.399±0.002**34.722±3.550 7 0.275±0.012**84.642±0.648 0.161±0.006**73.622±0.402 8 0.450±0.071**74.837±3.941 0.214±0.025**64.918±1.055 9 1.533±0.110*14.294±6.165 0.561±0.008*8.295±4.143
3.3 细胞形态学观察 Fig 2显示给药后细胞形态学变化。与MCF-7阴性对照组比较,最佳组分配伍给药后,明显改变了MCF-7细胞的形态,呈现出细胞密度降低,细胞固缩,体积变小,细胞间连接明显减少;与MCF-10A阴性对照组比较,最优组合给药后对乳腺正常MCF-10A细胞形态差异无显著性。结果表明,最优组分配伍能够明显改变MCF-7细胞形态,而对MCF-10A细胞的形态差异无显著性。
3.4 高内涵细胞分析技术检测细胞凋亡 最佳组分配伍对细胞凋亡的影响如Fig 3~6所示。对于正常乳腺细胞MCF-10A,对照组与给药组相比Hoechst荧光强度无差异(P>0.05),细胞核呈规则的类圆形或椭圆形,染色均匀,显淡蓝色荧光,为正常细胞处在分裂期细胞的细胞核;而对于乳腺癌细胞MCF-7,给药组与对照组相比Hoechst荧光强度明显降低(P<0.01),细胞核明显减少,细胞核固缩,呈致密颗粒块状荧光分布的凋亡典型形态。Annexin V和PI染色荧光显示,对于正常乳腺MCF-10A细胞,对照组与给药组相比Annexin V荧光值无差异(P>0.05);而对于乳腺癌细胞MCF-7,给药组与对照组相比,AnnexinV和PI荧光值明显增强(P<0.01)。提示最优组合药物具有明显诱导乳腺癌细胞凋亡的作用,但对正常乳腺细胞的诱导凋亡作用差异无显著性。
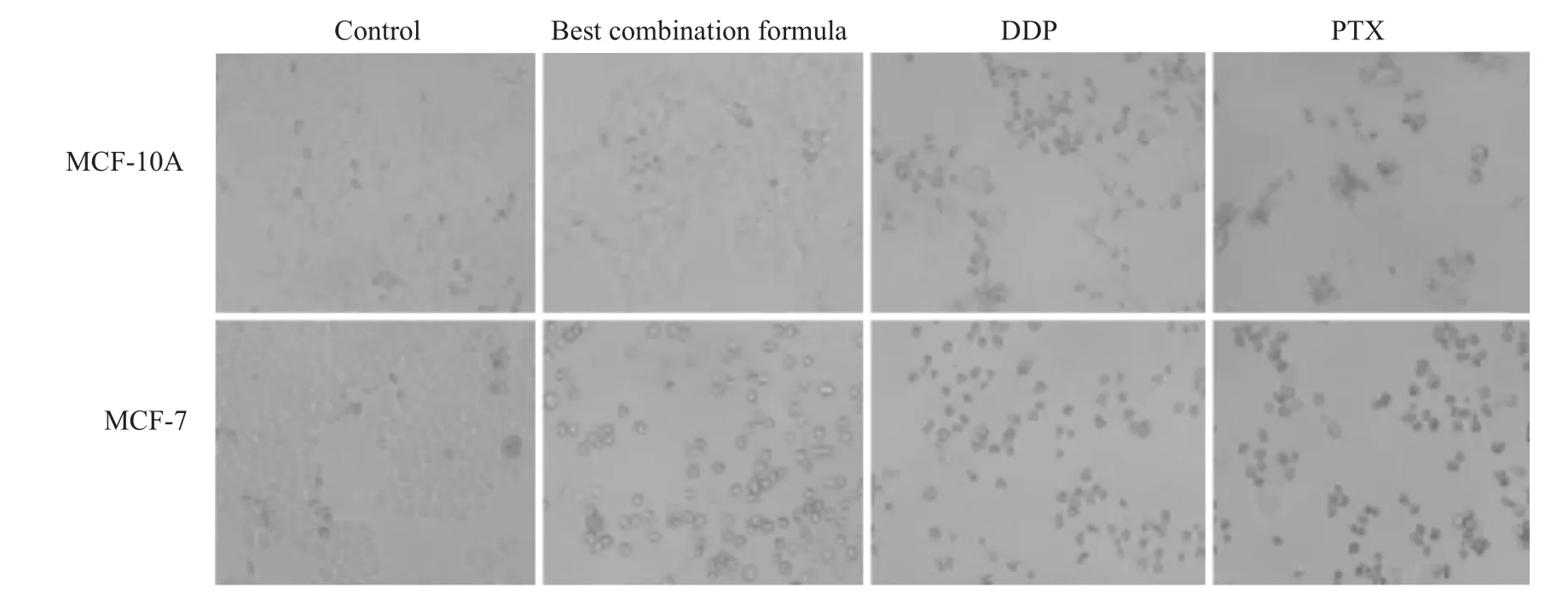
Fig 2 Influence of best combination formula on cell morphology(×200)

Fig 3 Influence of best combination formula on cell apoptosis by HCS analysis(×200)MCF-7-Cand MCF-7-T means the negative control group and drug group of MCF-7;MCF-10A-Cand MCF-10A-T means the negative control group and drug group of MCF-10A

Fig4 Influenceofbestcombinationformula onHoechstfluorescence(n=3)**P<0.01vscontrolgroup

Fig5 Influenceofbestcombinationformula onAnnexinVfluorescence(n=3)**P<0.01vscontrolgroup

Fig6 Influenceofbestcombinationformulaon PIfluorescence(n=3)**P<0.01vscontrolgroup
4 讨论
随着中药药理学、细胞生物学、分子生物学等多学科研究方法和技术手段的发展,中药及其有效成分的抗肿瘤作用研究已成为世界性的研究热点[4]。中药的有效组分配伍是根据现代医学对疾病发生、发展规律的认识,采用细胞或整体动物模型研究有效组分配伍的增效机制。不仅体现了中药多成分、多靶点、多层次产生作用的特点,而且相对于传统中药复方,其物质基础更为明确,针对性更强,质量更加安全可控,有利于提高制剂工艺和质量控制水平。中药有效组分配伍结合正交实验设计可筛选出较好的配伍比例。正交试验设计是研究多因素多水平的一种设计方法,根据正交性从全面试验中挑选出部分有代表性的点进行试验,挑选出的有代表性的点具备了“均匀分散,齐整可比”的特点,与各试验因素、各水平的全搭配试验相比,可减少试验个数,提高实验效率,迅速得到较理想的实验结果[5]。
丹参的现代药理作用广泛,化学成分主要有脂溶性的丹参酮类化合物和水溶性的酚酸类化合物两大类[6]。丹参总酚酸(salvianolicacids)具有抗肿瘤作用,但其报道较少[7-8]。大量的研究显示,丹参酮(tanshinone)可对肿瘤细胞产生杀伤、诱导分化和凋亡、抑制侵袭和转移等作用[9]。人参总皂苷(saponinsofPanaxginseng,EPG)是人参根的主要生理活性物质,有抗氧化、抗衰老、抗疲劳及抑制细胞凋亡、抑制肿瘤生长和降糖降脂等药理活性[10-11]。人参多糖(ginsengpolysaccharide)是人参的另一类主要成分,具有提高免疫力、抗肿瘤和降血糖等药理作用[12-14]。
许多抗癌药物都是通过触发肿瘤细胞凋亡通路而达到抑制肿瘤生长的目的[15]。本实验中Hoechst荧光染色和AnnexinV/PI双染色法结果表明,最优组合可诱导乳腺癌细胞发生凋亡。其中,Annexin V荧光染色结合Hoechst荧光染色表现的细胞核固缩提示药物诱导细胞发生晚期凋亡,同时,PI荧光染色也提示药物诱导细胞发生晚期凋亡。综上所述,丹参-人参活性组分的最优配伍是通过细胞晚期凋亡的途径达到抗肿瘤的作用。
本实验优选丹参-人参活性组分:丹参总酚酸、丹参总酮、人参总皂苷和人参多糖的最佳配伍,以正常乳腺细胞MCF-10A与乳腺癌细胞MCF-7的细胞抑制率比值大小为指标,由正交实验设计筛选出最佳配伍组合 A2B3C1D2,即由丹参总酚酸5mg·L-1、人参总皂苷 10mg·L-1、人参多糖 5mg·L-1的终浓度配比成的组合。实验结果表明,丹参-人参活性成分有效配伍时,丹参酮的作用效果并无体现,其原因还有待进一步研究。筛选出的最佳组合在有效抑制乳腺癌MCF-7细胞增殖的同时,也诱导细胞的凋亡,而对正常乳腺细胞MCF-10A的影响并不明显,表明该配比下的人参-丹参活性成分的配伍可能具有抑制乳腺癌细胞的增殖,并诱导乳腺癌细胞发生凋亡的作用,同时,对正常乳腺细胞的影响较小,提示抑制增殖和诱导凋亡是其抗肿瘤的可能机制之一。本研究揭示了丹参-人参组分配伍抗乳腺癌的可能作用机制,为中药组方配伍治疗乳腺癌提供了科学依据,更进一步实现开创有效组分组成的现代中药制剂,提高中药科技含量的目标。
参考文献:
[1] 毕 蕾,陈卫平,姜泽群,冯全服.丹酚酸A对肝癌HepG2细胞线粒体跨膜电位的影响[J].中华中医药杂志,2012,27(4):1171-3.
[1] Bi L,Chen W P,Jiang Z Q,Feng Q F.Effect of Salvianolic acid A on mitochondrial transmembrane potential of human hepatocellular carcinoma cell line HepG2[J].China J Tradit Chin Med Pharm,2012,27(4):1171-3.
[2] 王 昕,田 迎,严晓莺,陈卫平.丹酚酸A抑制LTEP细胞迁移及对 ERK信号转导通路的影响[J].中成药,2011,33(12):2059-61.
[2] Wang X,Tian Y,Yan X Y,Chen W P.Inhibitory effect of salvianolic acid A on migration of LTEPcells via ERK signaling[J].Chin Tradit Patent Med,2011,33(12):2059-61.
[3] 温 雅,毕 蕾,张义彪,陈卫平.丹参水提液对肺癌A549细胞增殖的抑制作用[J].中医药导报,2010,16(1):2-5.
[3] Wen Y,Bi L,Zhang Y B,Chen W P.Inhibitory effects of radix Salviae miltiorrhiae water extract on A549 cells in vitro[J].Guiding J Tradit Chin Med Pharm,2010,16(1):2-5.
[4] 梁欣娜,张兴燊,滕红丽.中药及其有效成分抗肿瘤作用研究[J].时珍国医国药,2013,24(1):119-22.
[4] Liang X N,Zhang X S,Teng H L.The anti-tumor effect Chinese medicine and its active ingredient[J].Lishizhen Med Mat Med Res,2013,24(1):119-22.
[5] 李卫娜,陈卫平,袁冬平,李国春.正交设计优选凉血化瘀方及其防治肝衰竭的药效研究[J].中西医结合肝病杂志,2007,17(5):281-3.
[5] Li W N,Chen W P,Yuan D P,Li G C.Optimization of formula with the function of cooling blood to remove stasis by orthogonal design and study on curative effect on FHF[J].Chin J Integr Tradit West Med on Liver,2007,17(5):281-3.
[6] 何根云.丹参的药理作用与临床应用[J].浙江中西医结合杂志,2011,21(2):124-5.
[6] He G Y.The pharmacological action and clinical application of salvia miltiorrhiza[J].Zhejiang J Integr Tradit Chin West Med,2011,21(2):124-5.
[7] 张晓雷,陈俊华,郭春霞,辛现良.丹参多酚酸盐的药理作用研究[J].世界临床药物,2013,34(5):292-7.
[7] Zhang X L,Chen J H,Guo C X,Xin X L.Research progress on pharmacological activities of salvianolate[J].World Clin Drugs,2013,34(5):292-7.
[8] 梁家红,张水娟,姚 立.丹酚酸B对肺上皮细胞凋亡和急性肺损伤的影响[J].中国药理学通报,2013,29(4):531-4.
[8] Liang JH,Zhang SJ,Yao L.Effect of salvianolic acid B on lung epithelial cell apoptosis and acute lung injury[J].Chin Pharmacol Bull,2013,29(4):531-4.
[9] 宋少华,郭闻渊,傅志仁,等.丹参多酚酸盐通过线粒体途径诱导人肝癌SMMC-7721细胞的凋亡[J].中国肿瘤生物治疗杂志,2010,17(1):62-6.
[9] Song SH,Guo WY,Fu Z R,et al.Salvianolate induces apoptosis of human hepatoma SMMC-7721 cells through mitochondrial path way[J].Chin J Cancer Biother,2010,17(1):62-6.
[10]何道同,王 兵,陈珺明.人参皂苷药理作用研究进展[J].辽宁中医药大学学报,2012,14(7):118-21.
[10]He D T,Wang B,Chen JM.Research progress on pharmacological effects of ginsenoside[J].J Liaoning Univ Tradit Chin Med,2012,14(7):118-21.
[11]Xiang Y Z,Shang H C,Gao X M,et al.A comparison of the ancient use of ginseng in traditional Chinese medicine with modern pharmacological experiments and clinical trials[J].Phytother Res,2008,22(7):851-8.
[12]Kim M H,Byon Y Y,Ko E J,et al.Immunomodulatory activity of ginsan,a polysaccharide of Panax ginseng,on dendritic cells[J].Korean J Physiol Pharmacol,2009,13(3):169-73.
[13]Li C,Cai J,Geng J,et al.Purification,characterization and anticancer activity of a polysaccharide from Panax ginseng[J].Int J Biol Macromol,2012,51(5):968-73.
[14]Niu J,Pi Z,Yue H,et al.Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chromatography-mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,907:7-12.
[15]Ramos A M,Aller P.Quercetin decreases intracellular GSH content and potentiates the apoptotic action of the antileukemic drug arsenic trioxide in human leukemia cell lines[J].Biochem Pharmacol,2008,75(10):1912-23.
