齐墩果酸衍生物对胰岛素抵抗的改善作用及机制
2014-05-17朱林卉王德彬杨光忠
徐 婧,朱林卉,王德彬,胡 鑫,杨光忠
(中南民族大学药学院,湖北 武汉 430074)
糖尿病是一种遗传和环境多因素影响的代谢性疾病,严重威胁人类健康。2型糖尿病占糖尿病的绝大多数,胰岛素抵抗(insulin resistance,IR)是2型糖尿病的主要发病因素[1]。齐墩果酸(oleanolic acid,OA)是一种具有保肝、抗炎、抗肿瘤等多种生理活性的五环三萜类化合物,以游离或结合成苷的形式在自然界广泛存在[2-3]。研究表明,OA能有效降低血糖,增加血糖耐受,明显提高肝糖原与血清胰岛素水平,从而改善胰岛素抵抗[4-5]。为了在 OA结构基础上发现更多高活性、低毒性的新药物先导化合物,国内外学者针对OA进行了结构修饰,并得到了大量具有抗糖尿病活性的化合物[2,6],本课题组以OA为骨架引入药效团查耳酮,合成了化合物{4-[(E)-3-(4-Bromo-phenyl)acryloyl]phenyl}-indole[3,2-b]olean-12-en-28-oate(Bio,结构式见Fig 1)[7]。为探索Bio改善胰岛素抵抗的作用,本研究建立胰岛素抵抗的HepG2细胞模型,检测Bio对模型细胞胰岛素抵抗的改善作用,并通过分析Bio对模型细胞中PPARγmRNA和蛋白表达的影响,探讨其改善胰岛素抵抗的作用机制。

Fig 1 Structure of compound Bio
1 材料与方法
1.1 细胞来源 HepG2人肝癌细胞系购自中国典型培养物保藏中心(CCTCC武汉大学)。
1.2 主要试剂及仪器 齐墩果酸衍生物Bio,本课题组合成;葡萄糖检测试剂盒,北京金豪制药股份有限公司;二甲亚砜(DMSO),Biosharp公司;RPMI 1640、DMEM培养基,Gibco公司;胎牛血清(FBS)、RNA小量制备试剂盒,Axygen公司;逆转录试剂盒,TaKaRa公司;牛胰岛素、胰酶,Sigma公司;Rabbit Anti-PPARγ、Mouse Anti-β-actin、Anti-rabbit IgG、Anti-mouse IgG,武汉博士德生物工程有限公司;354型多功能酶标仪,美国Thermo公司;Universal HoodⅡ型凝胶成像仪,美国 Bio-rad公司;TP600型 PCR仪,日本TaKaRa公司。
1.3 HepG2细胞的培养 将HepG2细胞置于50 ml培养瓶中,用含体积分数为10% 灭活FBS的RPMI 1640完全培养基在37℃、5%CO2条件下培养至单层贴壁,每3 d按1∶3的比例传代1次,取对数生长期的细胞用于后续实验。
1.4 HepG2细胞胰岛素抵抗模型的建立 参考文献方法[8]进行。用含10%FBS的DMEM培养基将处于对数期的HepG2细胞配制成细胞悬液,以1×108cells·L-1的浓度每孔100μl接种于96孔板。待细胞单层贴壁后,用PBS洗涤细胞两次。每孔加100μl无血清的DMEM培养基饥饿12 h后,对照组加入含2%FBS的DMEM培养液,模型组分别加入200μl新配制的含有胰岛素浓度分别为1.72×10-5、10-6、10-7、10-8mol· L-1的 2%FBS的DMEM培养液,于37℃、5%CO2培养箱中孵育24 h后弃培养基,用PBS洗涤细胞3次,加入无血清DMEM培养基200μl孵育24 h,使用葡萄糖氧化酶法检测培养基中葡萄糖浓度。以未接种细胞的空白复孔糖含量相减,计算出各孔细胞的葡萄糖消耗量。选择对照组与模型组细胞葡萄糖消耗量差值最大的胰岛素作用浓度作为胰岛素适宜浓度。
确定胰岛素适宜浓度后,按照上述方法,胰岛素作用24、36和48 h后,计算各组细胞的葡萄糖消耗量,检测胰岛素抵抗模型的持续稳定时间。
1.5 细胞分组及处理 依据不同实验要求,对细胞进行如下分组处理:①对照组(Control):培养液中不含有胰岛素;②模型组(Model):培养液含1.72×10-5mol·L-1胰岛素;③二甲双胍组(DMBG):模型组 +1×10-6mol·L-1的二甲双胍;④Bio高浓度组(Bio H):模型组 +1×10-5mol·L-1化合物 Bio;⑤Bio中浓度组(Bio M):模型组 +1×10-6mol·L-1化合物Bio;⑥Bio低浓度组(Bio L):模型组 +1×10-7mol·L-1化合物 Bio。
1.6 葡萄糖消耗及MTT实验 对照组、模型组与化合物处理组细胞按照“1.5”所示处理后,于37℃,5%CO2条件下培育24 h,吸取细胞培养上清液2 μl,采用葡萄糖氧化酶法检测培养基中葡萄糖含量。以未接种细胞的空白复孔糖含量相减,计算出各孔细胞的葡萄糖消耗量。
葡萄糖消耗检测结束后,参考文献[9],使用MTT法测定细胞存活率,用于考虑细胞增殖对葡萄糖消耗的影响。
1.7 PPARγmRNA表达水平检测 细胞造模成功后,按照“1.5”所示给予相应药物处理,然后将细胞转入1.5 ml EP管,按试剂盒说明提取细胞总RNA,紫外分光光度计测定260 nm和280 nm波长下的A值,计算RNA浓度,琼脂糖凝胶电泳观察RNA质量。按照逆转录试剂盒说明配置逆转录反应体系,逆转录合成cDNA第1链,作为PCR反应的模板。PCR反应条件为:94℃预变性5 min,94℃变性 30 s,59℃退火1 min,72℃延伸30 s,35个循环后,72℃延伸7 min。PCR产物经1%琼脂糖凝胶电泳分离。应用凝胶成像系统分析成像,以目的CAP片断/β-actin片断的条带光密度比值进行比较(GSR)。所用引物由北京擎科新业生物技术有限公司合成。PPARγ上游引物为5′-TCAAACACATCACCCCCCTG-3′;下 游 引 物 为 5′-ACCCCATCTTTATTCATCAA-3′;β-actin 上 游 引 物 为 5′-GAGCTACGAGCTGCCTGACG-3′;下游引物 为 5′-CCTAGAAGCATTTGCGGTGG-3′。
1.8 PPARγ的蛋白表达检测 药物处理细胞后,将细胞移至1.5 ml离心管,加入细胞裂解液提取细胞总蛋白,BCA法测定所得各组蛋白浓度。蛋白质经10%SDS-PAGE电泳分离后转至硝酸纤维素膜,用含5%脱脂奶粉的TBST缓冲液封闭1 h,加入PPARγ一抗(1∶200),4℃过夜。用含吐温-20的TBST缓冲液洗膜3次,然后加入二抗(1∶5 000),室温孵育1 h,洗膜后,ECL化学发光法检测条带。
1.9 统计学方法 所有数据采用Origin 6.5软件进行统计学处理,计量资料用¯x±s表示,组间比较采用t检验。
2 结果
2.1 胰岛素抵抗模型的建立及鉴定 如Tab 1所示,模型细胞经 1.72×10-5、10-6、10-7mol·L-1胰岛素处理24 h后,葡萄糖消耗量均较对照细胞低,1.72×10-5mol·L-1胰岛素处理的模型组与对照组细胞的葡萄糖消耗量差值最大,二者差异具有统计学意义(P<0.05),由此可确定诱导胰岛素抵抗HepG2细胞模型的胰岛素作用浓度为1.72×10-5mol·L-1。在该胰岛素浓度下,24、36、48 h时间点模型细胞葡萄糖的消耗量均低于对照细胞(Tab 2,P<0.05),胰岛素抵抗持续存在,表明该模型可稳定至48 h。
Tab 1 Effect of different concentrations of insulin onglucose consumption of HepG2(±s,n=3)

Tab 1 Effect of different concentrations of insulin onglucose consumption of HepG2(±s,n=3)
*P<0.05 vs control
G r o u p C o n c e n t r a t i o n o f i n s u l i n/m o l·L-1 G l u c o s e c o n s u m p t i o n/m m o l·L-1 C o n t r o l 0 2.6 7±0.1 9 M o d e l 1.7 2×1 0-5 1.4 1±0.1 2*1.7 2×1 0-6 1.9 4±0.1 6*1.7 2×1 0-7 2.0 9±0.1 0*1.7 2×1 0-8 2.7 0±0.1 8
Tab 2 Effect of action time of insulin on glucose consumption of HepG2±s,n=3)

Tab 2 Effect of action time of insulin on glucose consumption of HepG2±s,n=3)
*P<0.05 vs control
G r o u p G l u c o s e c o n s u m p t i o n/m m o l·L-1 2 4 h 3 6 h 4 8 h C o n t r o l 2.6 7±0.1 9 2.4 8±0.1 6 2.3 8±0.2 0 M o d e l 1.4 1±0.1 2* 1.0 8±0.1 0* 1.5 6±0.1 4*
2.2 Bio对胰岛素抵抗Hep G2细胞模型葡萄糖消耗量的影响 药物作用模型细胞24 h后,测定培养液中葡萄糖含量,计算葡萄糖消耗量,如Tab 3所示。结果显示,与模型细胞相比,10-5、10-6、10-7mol· L-13个浓度的Bio处理均可增加HepG2细胞模型葡萄糖消耗量(P<0.05),增加率分别为135%、62%、39%,10-5、10-6化合物对葡萄糖消耗量的增加率高于同等浓度的阳性对照药二甲双胍(P<0.05)。同时可以看到,Bio促进葡萄糖消耗的作用呈剂量依赖性增加。
2.3 Bio对胰岛素抵抗的 HepG2细胞 PPARγ mRNA表达的影响 利用 RT-PCR检测 PPARγ mRNA的表达量,并对电泳结果进行灰度分析,结果如Fig 2所示。与对照组相比,胰岛素抵抗模型的PPARγ表达量降低(0.89±0.06,P<0.05)。与模型组相比,阳性对照二甲双胍可以提高PPARγ的表达量(1.67±0.07,P<0.05);不同浓度的 Bio处理均可以提高模型细胞中PPARγmRNA的表达量,但刺激作用低于二甲双胍,分别为Bio H组(1.07±0.07,P<0.05)、Bio M组(1.04±0.08,P<0.05)、Bio L组(0.93±0.05,P<0.05)。
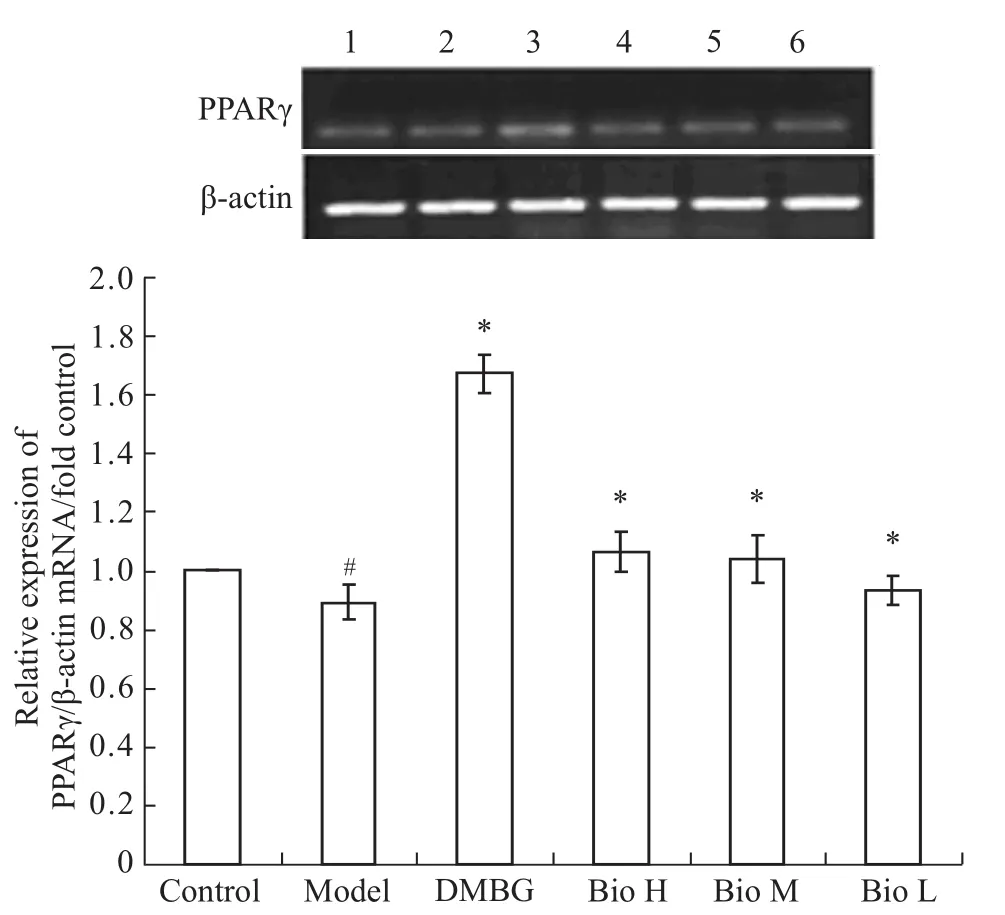
Fig 2 Expression of PPARγmRNA in different groups1:Control;2:Model;3:DMBG;4:Group Bio H;5:Group Bio M;6:Group Bio L.#P<0.05 vs control;*P<0.05 vs model.
Tab 3 Effect of Bio on glucose consumption of IR Hep G2±s,n=3)

Tab 3 Effect of Bio on glucose consumption of IR Hep G2±s,n=3)
*P<0.05 vs model;#P<0.05 vs DMBG
G r o u p D o s e/m o l· L-1 G l u c o s e c o n s u m p t i o n/M T T/m m o l·L-1 C o n t r o l - 2.8 8±0.6 M o d e l - 1.9 6±0.7 B i o 1 0-5 4.6 1±0.6*#1 0-6 3.1 7±0.1*#1 0-7 2.7 2±1.6*D M B G 1 0-5 3.2 5±0.8 1 0-6 3.0 5±1.0 1 0-7 3.0 0±0.1
2.4 Bio对胰岛素抵抗的Hep G2细胞PPARγ蛋白表达的影响 使用不同浓度药物处理模型组细胞,Western blot测定细胞中 PPARγ的蛋白表达。结果显示:与对照组相比,模型组细胞的PPARγ的蛋白表达量明显降低(0.27±0.08,P<0.05);二甲双胍和不同浓度的Bio处理均可以上调模型细胞中PPARγ蛋白的表达,与模型组相比差异具有显著性(P<0.05),分别为 DMBG组(1.35±0.07,P<0.05)、Bio H组(1.81±0.07,P<0.05)、Bio M组(0.45±0.04,P<0.05)、Bio L组(0.31±0.05,P<0.05)。Bio H组对PPARγ上调作用高于二甲双胍。见Fig 3。
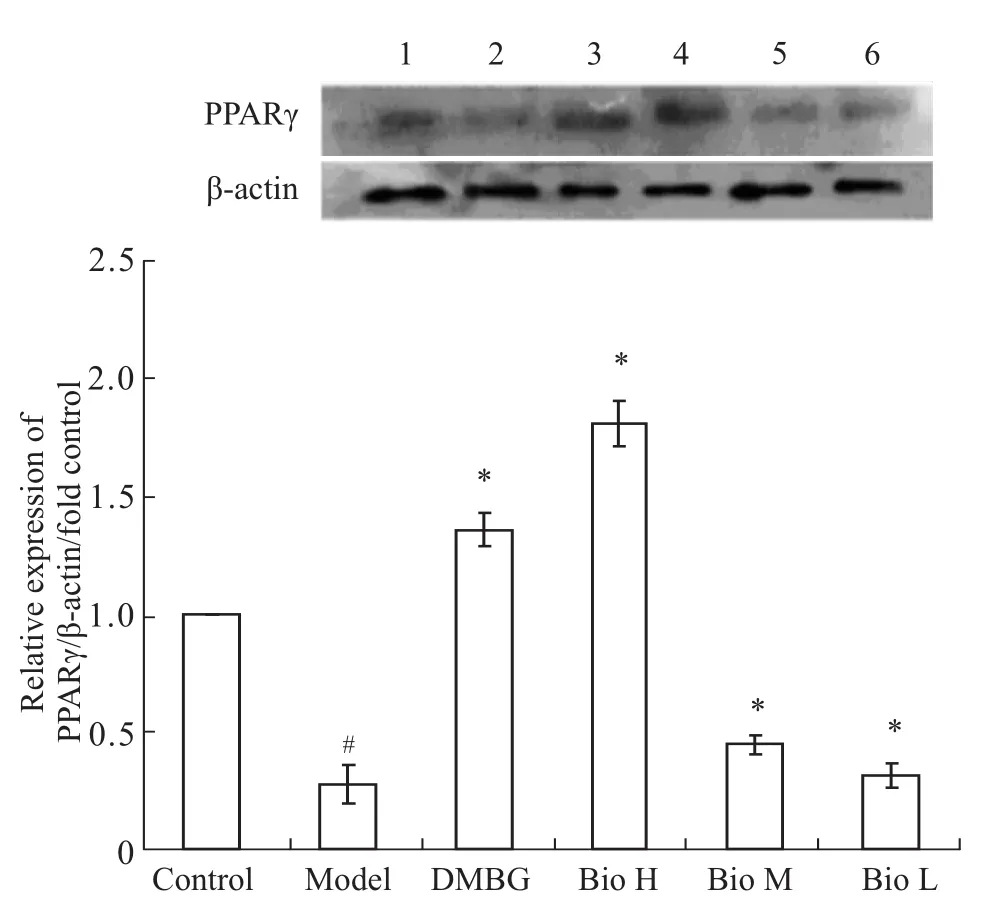
Fig 3 Expression of PPARγprotein in different groups1:Control;2:Model;3:DMBG;4:Group Bio H;5:Group Bio M;6:Group Bio L.#P<0.05 vs control;*P<0.05 vs model
3 讨论
目前针对2型糖尿病的治疗手段常采用化学合成的降糖药物,但存在多种不良反应,如乳酸中毒、低血糖、肝肾损伤等[10],以天然化合物为先导物,通过结构修饰发现新的高效低毒的药物先导化合物是抗糖尿病新药研究和开发的重要途径之一[11]。齐墩果酸作为从植物提取的一类具有广泛药理作用的天然产物,在针对糖尿病的研究中表现出很好的研究价值[5],本课题组前期通过对齐墩果酸的结构修饰得到了一系列具有较高体外降糖活性的化合物[12]。
胰岛素抵抗是2型糖尿病的重要发病机制之一,贯穿着2型糖尿病的发生、发展全过程,是导致糖尿病各种并发症的“动力”根源[1]。肝脏是胰岛素作用的主要靶器官,参与空腹状态下的内生性糖的产生和输出,以及进食后糖的吸收、利用和储存,胰岛素抵抗在肝脏的后果主要表现为肝脏摄取葡萄糖和合成糖原的能力下降,导致餐后血糖升高[13]。通过高浓度胰岛素诱导肝脏细胞产生胰岛素抵抗,便于观察干预因素对胰岛素抵抗的直接影响,并可在细胞水平探讨胰岛素抵抗形成的机制。本研究中经高浓度胰岛素诱导的HepG2细胞,葡萄糖摄取能力明显低于未诱导细胞,细胞的胰岛素敏感性降低,胰岛素抵抗细胞建立成功。在此基础上探讨Bio对葡萄糖消耗的影响,研究结果显示,在胰岛素抵抗状态下,高、中、低浓度的Bio均可以促进HepG2细胞的葡萄糖消耗量,并且高、中浓度的Bio促进效果优于同等浓度的二甲双胍,表明Bio可以增强胰岛素敏感性,改善胰岛素抵抗。
过氧化物酶体增殖物激活受体 (PPARs)是一类由配体激活的核转录因子,属于Ⅱ型核激素受体超家族,具有α、β、γ3种亚型,在调节脂肪合成、能量稳定、糖脂代谢平衡中起着重要作用[14]。其中,PPARγ能够增加外周组织对胰岛素的敏感性,其机制可能是通过抑制脂肪分化相关因子的分泌,减少胰岛素抵抗因子的产生;抑制胰岛素受体底物磷酸化,导致葡萄糖转运体(GLUT)转位增加,促进脂肪组织和骨骼肌的葡萄糖摄取,从而改善胰岛素抵抗。如抗糖尿病药物噻唑烷二酮类(TZDs)作为PPARγ的外源性配体,能够有效激活PPARγ,调控磷酸烯醇式丙酮酸激酶(PEPCK)、GLUT4和胰岛素受体等基因的转录,促进葡萄糖转运,增加胰岛素敏感性[15]。本研究通过RT-PCR和Western blot的结果均表明,Bio能够明显促进胰岛素抵抗细胞的PPARγ的表达,改善胰岛素抵抗状态下的糖脂代谢紊乱,且在蛋白水平,10-5mol·L-1的化合物对PPARγ的调节作用优于二甲双胍,说明Bio通过PPARγ改善胰岛素抵抗,是一种潜在的PPARγ激动剂。
Corbin等报道Escherichia coli蛋白的丰度变化与转录水平的变化有非常高的相关性,而Gygi等及Xia等在实验中发现蛋白质表达水平与转录水平的相关性较低。本研究中,Bio M和Bio L组处理后,PPARγ在mRNA和蛋白水平的变化情况一致:与模型组细胞相比表达水平上调,且上调作用均低于阳性对照二甲双胍。但是,Bio H组处理后,PPARγ mRNA水平的表达量低于二甲双胍,蛋白水平表达量却高于二甲双胍组,造成mRNA和蛋白水平不一致性的原因可能如下:①转录后调控的存在:mRNA在翻译成蛋白质的过程中,涉及到转录后修饰、翻译后修饰等过程;② mRNA和蛋白质稳定性的差异;③实验技术本身原因:RT-PCR和Western blot均为半定量分析、不同的操作者人为引入的误差等。虽然Bio H组处理后,PPARγ在转录水平和蛋白水平的表达出现了不一致,但与模型组细胞相比,PPARγ的表达均上调。
综上所述,齐墩果酸衍生物 Bio能够改善HepG2细胞的胰岛素抵抗状态,其机制与增强转录因子PPARγmRNA和蛋白表达,提高胰岛素敏感性相关。但其作用于PPARγ后,下游相关基因的表达变化以及信号通路有待于进一步研究。
参考文献:
[1] Ravi K,Ramachandran B,Subramanian S.Protective effect of eugenia jambolana seed kernel on tissue antioxidants in streptozotocin induced diabetic rats[J].Biol Pharm Bull,2004,27(8):1212-7.
[2] Fred-Jaiyesimi A,Kio A,Richard W.α-Amylase inhibitory effect of 3β-olean-12-en-3-yl(9Z)-hexadec-9-enoate isolated from Spondias mombin leaf[J].Food Chem,2009,116(1):285-8.
[3] Hung H Y,Qian K,Morris-Natschke SL,et al.Recent discovery of plant-derived anti-diabetic natural products[J].Nat Prod Rep,2012,29(5):580-606.
[4] Chen J,Liu J,Zhang L,et al.Pentacyclic triterpenes.part 3:synthesis and biological evaluation of oleanolic acid derivatives as novel inhibitors of glycogen phosphorylase[J].Bioorg Med Chem Lett,2006,16(11):2915-9.
[5] de Melo CL,Queiroz M G,Fonseca SG,et al.Oleanolic acid,a natural triterpenoid improves blood glucose tolerance in normal mice and ameliorates visceral obesity in mice fed a high-fat diet[J].Chem Biol Interact,2010,185(1):59-65.
[6] 唐 初,陈 玉,柏 舜,等.齐墩果酸的结构修饰与生物活性研究进展[J].有机化学,2013,33(1):46-65.
[6] Tang C,Chen Y,Bai S,et al.Advances in the study of structural modification and biological activities of oleanolic acid[J].Chin J Org Chem,2013,33(1):46-65.
[7] Tang C,Zhu L H,Li J,et al.Synthesis and structure elucidation of five new conjugates of oleanolic acid derivatives and chalcones using 1D and 2D NMR spectroscopy[J].Magn Reson Chem,2012,50(3),236-41.
[8] 张汝学,贾正平,李茂星,等.体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用[J].中国药理学通报,2008,24(7):971-6.
[8] Zhang R X,Jia Z P,Li M X,et al.The establishment of insulin resistant model in vitro and preliminary application for screening drugs[J].Chin Pharmacol Bull,2008,24(7):971-6.
[9] Zheng X K,Zhang L,Wang W W,et al.Anti-diabetic activity and potential mechanism of total flavonoids of Selaginella tamariscina(Beauv.)Spring in ratsinduced by high fat diet and low dose STZ[J].J Ethnopharmacol,2011,137(1):662-8.
[10]Ravi K,Ramachandran B,Subramanian S,et al.Protective effect of eugenia jambolana seed kernel on tissue antioxidants in streptozotocin induced diabetic rats[J].Biol Pharm Bull,2004,27(8):1212-7.
[11]余伯阳.以生物组合化学技术发现新高效低毒天然药物先导化合物[J].中国天然药物,2007,5(3):169-73.
[11]Yu B Y.Studies on the Bio-combinatorial chemistry as the new method for finding higher bioactive or lower toxicity leading compound[J].Chin J Nat Med,2007,5(3):169-73.
[12]Tang C,Zhu L H,Chen Y,et al.Synthesis and biological evaluation of oleanolic acid derivative-chalcone conjugates asα-glucosidase inhibitors[J].RSC Adv,2014,4(21):10862-74.
[13]李婷婷,高丽昌,唐 禄,等.成纤维细胞生长因子-21改善胰岛素抵抗肝细胞对葡萄糖的吸收及机制[J].中国药理学通报,2012,28(3):366-71.
[13]Li T T,Gao L C,Tang L,et al.The effect of FGF-21 on the glucose uptakes and insulin resistance in cultured human liver cells[J].Chin Pharmacol Bull,2012,28(3):366-71.
[14]丁世英,申竹芳,谢明智.PPAR与胰岛素抵抗[J].中国药理学通报,2002,18(3):241-5.
[14]Ding SY,Shen Z F,Xie M Z.PPAR and insulin resistance[J].Chin Pharmacol Bull,2002,18(3):241-5.
[15]Pauli JR,Ropelle E R,Cintra D E,et al.Acute physical exercise reverses S-nitrosation of the insulin receptor,insulin receptor substrate 1 and protein kinase B/Akt in diet-induced obese Wistar rats[J].J Physiol,2008,586(2):659-71.
