土槿乙酸抑制接触性超敏反应的药效学研究及机制探讨
2014-05-17董小青王翼腾刘晓光欣2
李 覃,董小青,王翼腾,刘晓光,王 伟,周 欣2,,陈 虹,5
(1.武警后勤学院病原生物与免疫学教研室,天津 300309;2.天津市心血管重塑与靶器官损伤重点实验室,天津 300162;3.武警后勤学院生药与药剂学教研室,天津 300309;4.武警后勤学院附属医院,天津 300162;5.天津市职业与环境危害生物标志物重点实验室,天津 300309)
免疫调节剂多用于治疗免疫系统紊乱导致的相关疾病。目前,临床上常用的西药类免疫调节剂包括糖皮质激素、细胞增殖抑制剂、免疫抑制剂等,但是,这些药物大多存在毒副作用和疗效局限等问题。在此背景下,人们开始把目光投向中药。中药是我国自然科学中最有特色的研究领域,能够整合调节机体各项功能,作用途径广泛,使毒副作用降到最低。萜类化合物是广泛分布于多种植物的天然产物,其中二萜类化合物以其结构多样、生物活性强而备受关注。
金钱松是现今仅存于中国的单属单种特有植物。土槿皮(也叫土荆皮)是金钱松的近根树皮,属《中华人民共和国药典》收载的常用中药,其中最主要的活性成分即为二萜类化合物土槿乙酸(pseudolaric acid B,PB)。PB具有独特的二萜母核以及内酯环和共轭双烯酸侧链(Fig 1)[1]。现代药理实验研究表明,PB能够发挥抗真菌、抗血管生成、抗肿瘤等多种生物学效应[2]。我们前期发现[3-5],PB可有效抑制抗原特异性免疫应答,诱导调节性T细胞产生,但具体机制尚未完全阐明。本研究进一步分析PB发挥作用的分子机制,为新型抗炎免疫调节药物的研制提供理论和实验依据。

Fig 1 Structure of PB(C23 H28O8,MW:432.46)
1 材料与方法
1.1 主要材料 PB由本室提取自土槿皮(经中国药品生物制品检定所检测纯度>98%)。二硝基氟苯(DNFB)购于 Sigma公司;DMEM培养基、Opti-MEM培养基、胎牛血清(FCS)购于Gibco公司;苏木精、伊红染色液购于碧云天生物技术公司;PPARγ单克隆抗体购于SAB公司;Akt及其磷酸化抗体phospho-Akt(Ser473)购于Bioworld公司;Bradford蛋白浓度测定试剂盒、增强化学发光(ECL)试剂盒购于Pierce公司;X-tremeGeneTMHP转染试剂购自Roche公司;双荧光素酶报告基因检测试剂盒购于Promega公司。
清洁级BALB/c小鼠(6~8周,♀ 8~20 g)购于中国人民解放军军事医学科学院实验动物中心,动物合格证SCXK-(军)2012-004,实验过程中对动物的处置符合医学伦理学标准。
1.2 小鼠CHS模型建立 80只BALB/c小鼠随机分为8组(10只/组):正常组、模型组、各剂量PB给药组。参照Wang等[6]方法并略作调整建立接触性超敏反应(contact hypersensitivity,CHS)小鼠模型。实验前1日(day-1)小鼠腹部去毛约3 cm,开始日(day 0)和第1日(day 1)于去毛部位涂0.5%DNFB(以4∶1丙酮橄榄油配制)40μl致敏。6日后于鼠耳内外侧涂0.2%DNFB 20μl激发。
1.3 给药方法 PB混悬于生理盐水,连续口服给药10 d(day-1至day 8),正常对照组和模型对照组灌服等量生理盐水(vehicle)。同时,另取正常小鼠给予相同剂量PB,观察PB对正常机体是否有毒副反应。
1.4 指标测定 激发后48 h颈椎脱臼处死小鼠,用打孔器在相同部位取直径8 mm耳片,游标卡尺测厚度,电子天平称重量,以左右耳片厚度、重量之差为肿胀度。同时,称重各组小鼠脾脏,计算脾指数。
1.5 苏木精-伊红(HE)染色 取各组小鼠耳组织标本,置中性甲醛固定24 h,石蜡包埋,切片(3 μm),苏木素 -伊红染色,80%、90%、95%、100%乙醇梯度脱水,二甲苯透明,中性树胶封片。由经验丰富的病理科医师独立通过显微镜观察各组小鼠耳组织皮肤中的病理变化。
1.6 Western blot 收集各组小鼠脾脏,按说明书操作提取组织蛋白,Bradford法定量蛋白含量,SDSPAGE电泳,半干法转至PVDF膜,5%脱脂奶粉封闭,一抗(PPARγ、phospho-Akt)孵育,4℃过夜,TBST洗膜后加入相应的辣根过氧化物酶标记的二抗,室温孵育2h,ECL法检测。Stripping Solution洗脱、封闭后,再次加入抗-Akt抗体、二抗,同上述操作。最后进行图片扫描和分析,采用BioRad系统进行数据分析处理。
1.7 细胞转染与报告基因检测 取对数生长期人胚肾HEK-293细胞,1×105/孔接种于24孔板,24 h后待细胞融合70%~80%,换无抗完全DMEM培养基,1 h后转染0.5μg TK-PPRE3-luc质粒(由美国萨克生物研究学院R.M.Evans教授惠赠)及0.02 μg质粒pRL-TK(Promega产品)。根据说明书用X-tremeGeneTMHP转染试剂进行瞬时转染,不同浓度PB进行体外干预,同时,以1μmol·L-1吡格列酮作为阳性对照组,24 h后根据试剂盒说明进行荧光素酶报告基因分析,计算相对荧光素酶活性。
1.8 统计学方法 计量资料数据以¯x±s表示,所有数据均用SPSS 13.0统计软件进行统计分析,采用单因素方差分析进行组间比较。
2 结果
2.1 PB的药效学分析
2.1.1 PB抑制CHS小鼠耳肿胀 如Fig 2所示,PB能够剂量依赖地抑制模型小鼠耳肿胀,20 mg·kg-1时抗炎效果达到平台期,40 mg·kg-1时药效有下降趋势。低于20 mg·kg-1的情况下,正常给药小鼠未见不良反应,超过25 mg·kg-1后小鼠可见毛色暗淡、消瘦、腹泻等不良反应。因此,接下来选择5、10、20 mg·kg-1分别作为低、中、高剂量组进一步分析PB对CHS的其它药效情况。

Fig 2 Oral treatment with PB suppressed CHS responsePB:pseudolaric acid B;Veh:CHS mouse model treated with saline;NOR:normal control.*P<0.05,**P<0.01 vs vehicle
2.1.2 PB对脾指数的影响 如Fig 3所示,CHS模型组小鼠脾指数明显升高,低、中、高剂量PB干预后均明显降低升高的脾指数,差异具有显著性(P<0.05)。
2.1.3 耳组织形态学 HE染色结果显示(Fig 4),正常组小鼠耳组织厚度正常,几乎无炎症细胞浸润;模型组小鼠耳片表皮明显增厚,细胞内及细胞间水肿明显,棘层和基底层有大量炎症细胞浸润,以淋巴细胞为主,同时可见嗜酸性粒细胞等其它炎症细胞。PB干预后能够降低CHS小鼠耳组织肿胀,表皮及真皮水肿明显减轻,炎症细胞浸润减少,真皮血管扩张充血现象缓解。
鉴于5 mg·kg-1的PB就能产生明显抑制CHS小鼠炎症发生、发展的药效,显示出良好的抗炎作用,因此,参考药理学相关实验设计[5],后续研究即以该低剂量PB进行机制探讨。
2.2 PB免疫调节作用的机制探讨
2.2.1 PB促进PPARγ表达 本部分研究首先通过Western blot检测了PB干预前后CHS小鼠脾脏PPARγ的蛋白表达水平。如Fig 5所示,PB能够明显促进PPARγ表达,与CHS组相比,差异具有显著性(P<0.01)。
2.2.2 PB上调PPARγ转录激活 为了进一步确定PB对PPARγ转录激活的影响,我们应用荧光素酶报告基因分析了PB对报告基因TK-PPRE3-luc的作用。PPARγ活化后可与报告质粒启动子的PPRE结合,启动荧光素酶转录。双荧光素酶报告基因分析结果显示(Fig 6),PB能剂量依赖地促进PPARγ转录激活,PPARγ阳性对照药物吡格列酮1μmol·L-1时的荧光素酶相对活性约36.2,活性高于PB的作用(P<0.01)。
2.2.3 PB抑制phospho-Akt活性表达 Western blot结果显示(Fig 7),CHS模型组小鼠phospho-Akt(p-Akt)的蛋白表达水平较正常组明显升高,PB干预后能够下调Akt的磷酸化活性表达,同时,非磷酸化Akt表达无变化。

Fig 3 Effects of PB on spleen indexPB:pseudolaric acid B;Veh:CHS mouse model treated with saline;NOR:normal control.*P<0.05,**P<0.01 vs vehicle

Fig 4 Hematoxylin and eosin(HE)staining(×100)A:Normal control;B:Veh;C,D,E:Pseudolaric acid B 5,10,20 mg·kg-1
3 讨论
随着工业化程度的逐步提高,自身免疫性疾病、变态反应性疾病等由免疫反应紊乱而引起的疾病也在不断增加,严重危害广大人民身心健康和生活质量。免疫抑制剂可通过影响机体免疫应答和免疫病理反应,抑制免疫功能,从而发挥治疗免疫反应过度引起的相关疾病。基于此,临床上根据个体情况合理选择药物,给免疫抑制剂提供了广阔的市场。CHS是抗原特异性T细胞介导的异常免疫应答,参与多种炎症免疫性疾病的致病机制。采用DNFB建立小鼠耳廓CHS模型是目前学界最常用的评价药物免疫抑制活性的动物模型之一。该模型以小鼠耳廓作为靶部位,根据炎症耳廓的厚度来判断药物疗效[7]。
传统中药土槿皮有止痒杀虫之功效,常用于治疗皮肤癣症、神经性皮炎、湿疹等疾病,属《中华人民共和国药典》收载的常用中药[1]。我们和其他研究人员均发现,PB能够明显抑制T淋巴细胞活化增殖,具有良好的免疫调节活性[3,8],本文在药学分析的基础上深入探讨其可能的作用机制。首先建立小鼠CHS模型,口服给予不同剂量PB干预后,观察其药效学指标。结果显示,各剂量PB均明显抑制CHS小鼠耳肿胀度,组织病理也显示PB能使CHS炎症反应缓解,通过下调T细胞介导的细胞免疫应答发挥免疫调节作用。
脾脏是产生特异性免疫应答的重要场所,其重量的改变能够一定程度上反映机体的免疫状态。本实验中PB明显降低CHS模型小鼠的脾脏指数,从另一个侧面反映了药物对机体免疫功能的抑制效应。
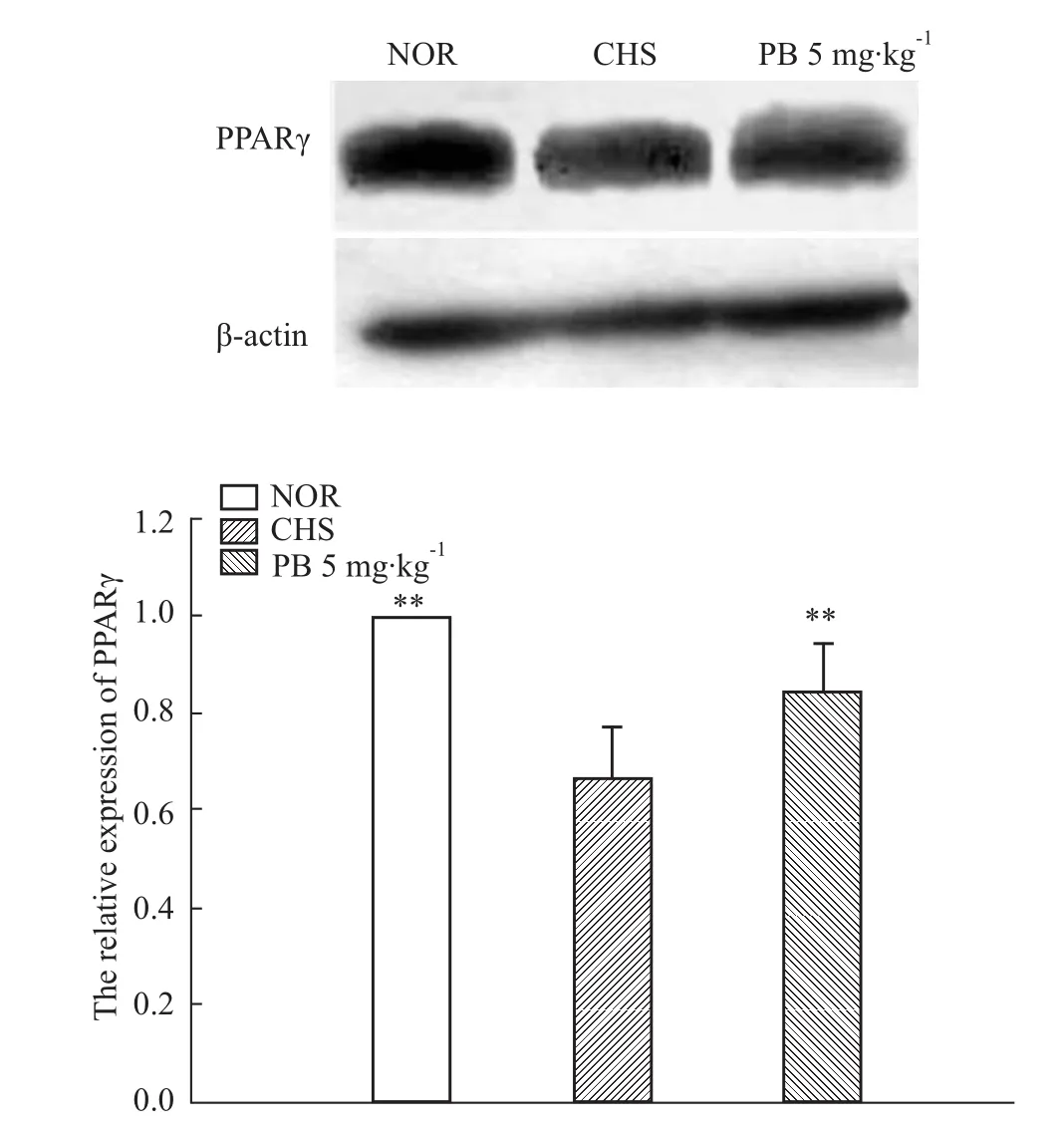
Fig 5 PB modulated expression of PPARγPB:pseudolaric acid B;CHS:CHS mouse model treated with saline;NOR:normal control.**P<0.01 vs CHS
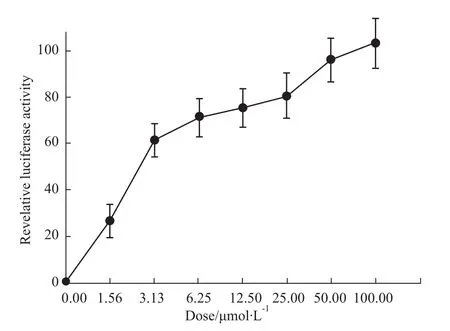
Fig 6 Effects of PB on PPARγtranscriptional activity in HEK-293 cells

Fig 7 PB suppressed level of phosphorylated-AktPB:pseudolaric acid B;CHS:CHS mouse model treated with saline;NOR:normal control.**P<0.01 vs CHS
过氧化物酶增殖物激活受体(peroxisome proliferater-activated receptor,PPAR)是一类控制多种细胞和代谢过程的转录因子,包括PPARα、PPARβ/δ和PPARγ三种表型。其中,PPARγ在淋巴细胞、巨噬细胞等免疫细胞以及其它多种组织细胞中均有表达,能够与视黄醛X受体(RXR)形成异源二聚体,结合到位于靶基因启动子区的PPAR反应元件(PPRE)。近年研究发现,PPARγ具有负调节免疫应答的作用[9],提示可以利用PPARγ的免疫抑制特性治疗CHS介导的炎症免疫性疾病。有报道显示[1,10],PB是 PPARγ的天然激动剂,其活性高于现有合成的激动剂。因此,我们首先检测了富含淋巴细胞的脾脏中PPARγ的蛋白表达水平,结果可见,PB能明显上调PPARγ表达。由于PPARγ被激活后会引起一系列的细胞生物学反应,通过调节细胞增生、分化,影响免疫反应和炎症过程[11]。因此,本研究进一步通过荧光素酶报告基因检测了PPARγ的转录激活情况,并证实PB能够通过增加PPARγ表达和转录激活,进而抑制炎症反应、调节机体免疫系统紊乱,有望发展成为一种新型抗炎免疫调节剂。
调节性T细胞(regulatory T cell,Treg)是一类高表达CD25的CD4+T细胞,Foxp3是其的特异性功能基因,在Treg的表型、发育等功能中起决定性作用[12-13]。Akt信号通路与细胞增殖、凋亡和分化等多种细胞生物活动密切相关,过度激活后可促进细胞增殖,使正常细胞发生恶性转化,或参与炎症性疾病的发病过程。最近,研究人员发现[14],Akt信号通路在Treg细胞生长分化中同样能够发挥重要作用,激活Akt通路会抑制Treg分化。葛圣林等[15]证实,抑制Akt信号通路可使 Foxp3表达增强,且与Akt信号通路的激活程度呈负相关。我们前期发现,PB明显增加CHS小鼠CD4+CD25+Foxp3+Treg细胞数量,促进 Foxp3基因表达[3,12]。本研究在前期工作的基础上进一步观察到,CHS模型小鼠升高的Akt磷酸化活性表达能够被PB抑制,提示通过调节Akt信号通路,进而影响Treg细胞分化可能是PB发挥效应的重要机制之一。
综上所述,PB可能通过促进PPARγ表达与转录激活、抑制Akt活化,增加Treg产生,从而发挥抗炎和免疫调节作用。但是,PB活化 PPARγ、抑制Akt信号通路、以及增加Treg三者之间究竟发挥怎样的交互联系尚需进一步研究阐明。深入探讨PB免疫调节的具体机制不但对于指导临床用药、诱导免疫耐受等方面具有积极意义,还可能发现新的药物作用靶点,并为新型抗炎免疫调节剂的研制提供思路。
参考文献:
[1] Chiu P,Leung L T,Ko B C.Pseudolaric acids:isolation,bioactivity and synthetic studies[J].Nat Prod Rep,2010,27(7):1066-83.
[2] 周晓飞,梁子华,林 密,等.土槿皮乙酸的药理学作用及其毒性反应 [J].中国热带医学,2007,7(7):1240-1.
[2] Zhou X F,Liang Z H,Lin M,et al.Advance in the research of pharmacology of pseudolaric acid B[J].China Trop Med,2007,7(7):1240-1.
[3] Li T,Chen H,Yang Z,et al.Topical application of pseudolaric acid B improve DNFB-induced contact hypersensitivity by regulating the balance of Th1/Th17/Treg cell subsets[J].Eur J Pharm Sci,2012,45(5):668-76.
[4] Wei N,Li T,Chen H,et al.The immunosuppressive activity of pseudolaric acid B on T lymphocytes in vitro[J].Phytother Res,2013,27(7):980-5.
[5] 李 覃,王 火,陈 虹,等.土槿乙酸调节特异性免疫应答的初步研究 [J].中国药理学通报,2013,29(2):421-5.
[5] Li T,Wang H,Chen H,et al.The preliminary study of pseudolaric acid B on specific immune response[J].Chin Pharmacol Bull,2013,29(2):421-5.
[6] Wang JX,Tang W,Shi L P,et al.Investigation of the immunosuppressive activity of artemether on T-cell activation and proliferation[J].Br J Pharmacol,2007,150(5):652-61.
[7] Czarnobilska E,Obtułowicz K,Wsołek K.Type IV of hypersensitivity and its subtypes[J].Przegl Lek,2007,64(7-8):506-8.
[8] Li T,Wong V K,Yi X Q,et al.Pseudolaric acid B suppresses T lymphocyte activation through inhibition of NF-kappaB signaling pathway and p38 phosphorylation[J].J Cell Biochem,2009,108(1):87-95.
[9] Alarcon L C,Sanchez FS,Villegas I,et al.New pharmacological perspectives and therapeutic potential of PPAR-gamma agonists[J].Curr Pharm Des,2004,10(1):3505-24.
[10]Jaradat M S,Noonan D J,Wu B,et al.Pseudolaric acid analogs as a new class of peroxisome proliferator-activated receptor agonists[J].Planta Med,2002,68(8):667-71.
[11]Jung K,Tanaka A,Fujita H,et al.Peroxisome proliferator-activated receptorγ-mediated suppression of dendritic cell function prevents the onset of atopic dermatitis in NC/Tnd mice[J].JAllergy Clin Immunol,2011,127(2):420-42
[12]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-64.
[13]Cretney E,Kallies A,Nutt S L.Differentiation and function of Foxp3(+)effector regulatory T cells[J].Trends Immunol,2013,34(2):74-80.
[14]Feuerer M,Hill JA,Mathis D,et al.Foxp3+regulatory T cells:differentiation,specification,subphenotypes[J].Nature Immunology,2009,10(7):689-95.
[15]葛圣林,彭磊磊,张成鑫.PI3K-Akt-mTOR信号通路对Foxp3基因表达的影响 [J].中国药理学通报,2011,27(6):855-9.
[15]Ge S L,Peng L L,Zhang C X.Molecular and cellular mechanisms of opiate addiction[J].Chin Pharmacol Bull,2011,27(6):855-9.