以细胞存亡调控蛋白c-FLIP为靶点的癌症治疗研究
2014-05-17陈立立陈忠明王冠林张宽仁
陈立立,陈忠明,王冠林,张宽仁
(昆明理工大学生命科学与技术学院,云南昆明 650500)
目前,癌症已经成为危害人类生命健康的最大杀手。癌症主要是控制细胞分裂增殖机制失常而引起的疾病,除此之外,还会局部侵入正常组织甚至经由体内循环系统或淋巴系统转移到身体其它部分。
肿瘤坏死因子相关的死亡诱导配体 (TNF-related apoptosis inducing ligand,TRAIL)是新发现的肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员,与其它成员不同,它能选择性诱导转化细胞、肿瘤细胞和病毒感染细胞发生凋亡,而对正常细胞没有明显的毒害作用[1]。因此,自TRAIL发现以来,其诱导癌细胞凋亡的分子机制一直是研究的重点和热点,利用其诱导的凋亡效应杀死肿瘤细胞具有广阔的临床应用前景。
然而,近年来研究发现,很多肿瘤细胞对TRAIL产生了耐受,其中一个很重要的原因是肿瘤细胞通过合成抗凋亡蛋白,如凋亡抑制蛋白 (inhibitor of apoptosis,IAP)、(B-cell lymphoma-2,Bcl-2)家族的抗凋亡蛋白、细胞型Fas相关死亡域样白介素-1β转换酶抑制蛋白 (cellular FADD-like IL-1β-converting enzyme-inhibitory protein,c-FLIP)等,从而对凋亡产生耐受,这是肿瘤抗凋亡的重要调节机制。
c-FLIP是一种抗凋亡蛋白,在许多恶性肿瘤细胞中都过量表达,这使得肿瘤细胞拥有了一定的逃生机制[2]。因此,通过靶向治疗来修复肿瘤细胞对凋亡的敏感性,对研究化学治疗产生的药物耐受性具有重要作用。
目前,针对抗凋亡蛋白IAP、Bcl-2为靶点的抑制剂有很多,多数已进入临床Ⅰ期、Ⅱ期实验[3-4]。但是,以c-FLIP为靶点的研发药物报道很少,除了RNA干扰的方法外,尚无c-FLIP专一性抑制剂或拮抗剂的报道。本文主要对以c-FLIP为靶点的癌症治疗的化学药物、方法进行综述,探讨降低、抑制或拮抗c-FLIP的方法,并提出新的思路,从而寻找一个潜在的安全的治疗癌症的方法,这对肿瘤的临床治疗具有重要意义。
1 细胞凋亡的信号通路
在癌症发生过程中,抑制和抗凋亡作用是癌细胞永生化的必要手段。目前,细胞凋亡信号转导通路主要包括外源途径和内源途径。
外源途径,又称死亡受体凋亡途径。TRAIL作为死亡受体信号通路中一个关键配体,与DR4(death receptor 4)或DR5结合后导致受体三聚化,细胞内包含死亡结构域(death domain,DD)的蛋白分子聚集成簇并募集接头蛋白(Fas associated death domain,FADD)。FADD的DD结构域负责和DR4或DR5分子胞内的DD结构域结合,N-端的DED则结合procaspase-8的 DED,并使其进行寡聚化,TRAIL-DR4/DR5-FADD-procaspase-8以串联形式组合形成死亡诱导信号复合物 (death-inducing signaling complex,DISC)。其中procaspase-8发生自身裂解,成熟并释放其活性亚单位caspase-8,直接激活下游效应因子caspase-3、caspase-6和caspase-7。最终使得细胞出现一系列凋亡现象,如Fig 1所示。
内源途径,又称线粒体凋亡途径。当procaspase-8激活不充分时,主要是通过线粒体途径来执行凋亡。通过Bcl-2家族中只含BH3同源区的Bid的切割来诱发凋亡。caspase-8/10或粒酶B(granzyme B)可以直接切割底物Bid,产生tBid,再进一步促进Bax和Bak作用线粒体膜,使细胞色素C(cytochrome C,cyt-C)从线粒体中释放。释放到细胞质的cyt-C在dATP存在的条件下能与凋亡相关因子-1(apaf-1)结合,使其形成多聚体,并促使procaspase-9与其结合而形成凋亡小体(apoptosome)。procaspase-9在凋亡小体上自切割活化,导致caspase-3的大量活化及随后的凋亡,如Fig 1所示。
2 细胞存亡调控蛋白c-FLIP
2.1 c-FLIP的结构 c-FLIP最初是在研究病毒时被发现的。Thome等[5]发现某些病毒,例如人的疱疹病毒(8HHV8)、人疣痘病毒等,寄生细胞后,会使细胞逃避机体的免疫监视,并且发现凋亡的细胞明显少于正常细胞。1997年,Irmler等[6]发现一些病毒 (如 γ-疱疹病毒、痘病毒等)含有一种可抑制细胞凋亡的基因,通过这种基因表达的蛋白能保护受感染的细胞不发生凋亡,从而使得病毒得以存活,继续复制。这种蛋白在结构上与 FLICE(FADD-like IL-1βconverting enzyme/caspase-8)相似,而且能抑制FLICE的作用,故被命名为FLIP,因其来源于病毒,所以又称为v-FLIP。目前,已有6个同族亚型的v-FLIP被证实。再后来,人们又分离得到 v-FLIP的人类细胞类似物 (cellular-FLIP,c-FLIP)。人类c-FLIP基因含13个外显子,与procaspase-8/10基因均位于染色体的2q33-34位置,两者相距大概200bp[7]。
c-FLIP又称 Casper、iFLICE、FLAME-1、CASH、CLARP、MRIT等,因其与细胞的死亡、存活信号密切相关,所以又称之为细胞存亡调控蛋白。虽然c-FLIP在mRNA水平上存在13种不同切割亚型,但是,到目前为止,在人类细胞的蛋白水平上,只能检测到3种表达形式:c-FLIPL(55 ku)、c-FLIPS(26 ku)、c-FLIPR(24 ku)[7]。
c-FLIPL和c-FLIPS通过选择性切割,可以产生不同的变体。外显子7会使得c-FLIPS/R的翻译终止,而c-FLIPL则可跳过外显子7,这也是它最长的原因。c-FLIPR的mRNA缺失了内含子6的切割能力,导致内含子6的起始部分的开放阅读框中出现终止密码,最终使得c-FLIPR成为3种亚型中最短的一种。而与人类相比,老鼠中只存在两种亚型即c-FLIP和c-FLIP[8]。LR
c-FLIPL含有一个与procaspase-8相似的结构域,即N端含有两个相互串联的DED,C端含有一个与caspase同源的结构域,但由于起催化作用的两个氨基酸残基Cys、His分别被Tyr、Arg所取代,因此,不具备了caspase蛋白水解酶的活性,从而不能形成活化的片段。c-FLIPS和v-FLIP很相似,除了具有两个DED外,在C端尾巴上还有一个19个氨基酸的特殊片段,这个片段是进行泛素化、蛋白酶体降解的关键调控位点。c-FLIPR的N端也含有DED,但与c-FLIPS相比,其C端则缺少了这些氨基酸片段的延伸[9]。
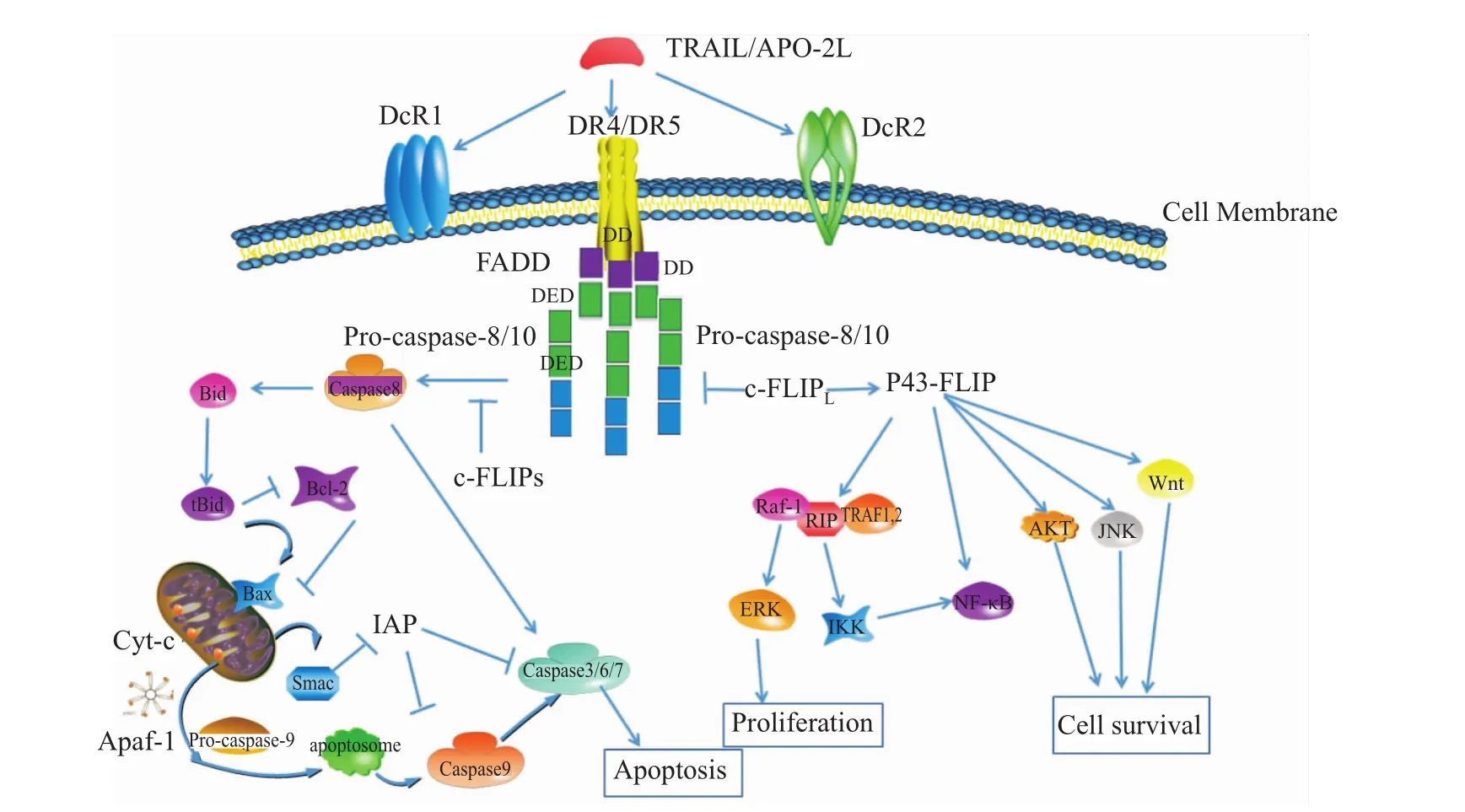
Fig 1 TRAIL mediated cell apoptosis and survival signaling pathways
2.2 c-FLIP的作用 动物模型实验研究结果显示,c-FLIP在T细胞增殖和胚胎发育中起着重要的作用。在研究不同癌症时,如结肠癌、胃癌、胰腺癌、黑色素瘤、B细胞慢性淋巴细胞瘤、卵巢癌等,都发现有c-FLIP的异常表达[10]。c-FLIP也因此被认为是癌细胞发生免疫逃逸的决定性因子之一。c-FLIP主要参与TRAIL、Fas、TNF-α介导的凋亡途径,并且是人类恶性肿瘤对化疗药物产生耐药性的主要原因。然而,c-FLIP调节凋亡的具体机制,到目前为止仍不是很清楚。
廖:那时没有人高喊“科普”口号,但有科普之实;现在喊口号、吃科普饭的人越来越多,但盛名之下,其实、其质又如何呢?这才是最值得我们思考的问题!
人源c-FLIP的不同亚型扮演着不同的调节作用。c-FLIPL/S与 procaspase-8都能结合到 FADD,形成不同 DISC,但由于c-FLIPS无蛋白水解酶的活性片段或类似片段,使得procaspase-8的二聚化及下游的活化受到抑制,最终阻止凋亡级联反应的发生。Kim等[11]研究c-FLIP阻止细胞凋亡的机制时,发现c-FLIPS可能通过维持抗凋亡蛋白 XIAP的表达水平以及激活 Akt途径来抑制奥沙利铂 (oxaliplatin)诱导的凋亡作用。
但c-FLIPL与procaspase-8能形成异源二聚体,c-FLIPL含有无活性但类似于procaspase-8的蛋白水解酶的活性片段,此异源二聚体的蛋白水解酶活性受到限制,最终只能产生p43/p41-p43-c-FLIP异源二聚体。p43-c-FLIP则有促进细胞增殖及介导细胞存活的作用 (Fig 1)。在研究 c-FLIP缺失的小鼠时,Chang等[12]发现,c-FLIPL具有双重功能,除了能竞争结合procaspase-8,具有抗凋亡的能力外,还能有限地激活procaspase-8,具有促凋亡的作用。然而,c-FLIPL抗凋亡和促凋亡的作用,主要是通过c-FLIPL在细胞中的表达水平来决定。在许多细胞中发现,当c-FLIPL的表达水平较低时,具有促进procaspase-8活化的作用,而在一些细胞 (如单核细胞、巨噬细胞和某些肿瘤细胞)中,当 c-FLIPL表达水平为中等时,便成为procaspase-8活化的抑制剂。而当c-FLIPL通过瞬时表达达到一个非常高的非生理浓度时,c-FLIPL仅依靠自身的细胞毒性作用就能抑制caspase-8的活性,而不需要TRAIL的介导。虽然c-FLIPL在procaspase-8的活化方面扮演着双重角色,但至少在肿瘤细胞的生理表达水平范围内,它仍然扮演一个非常重要的凋亡抑制蛋白的角色。
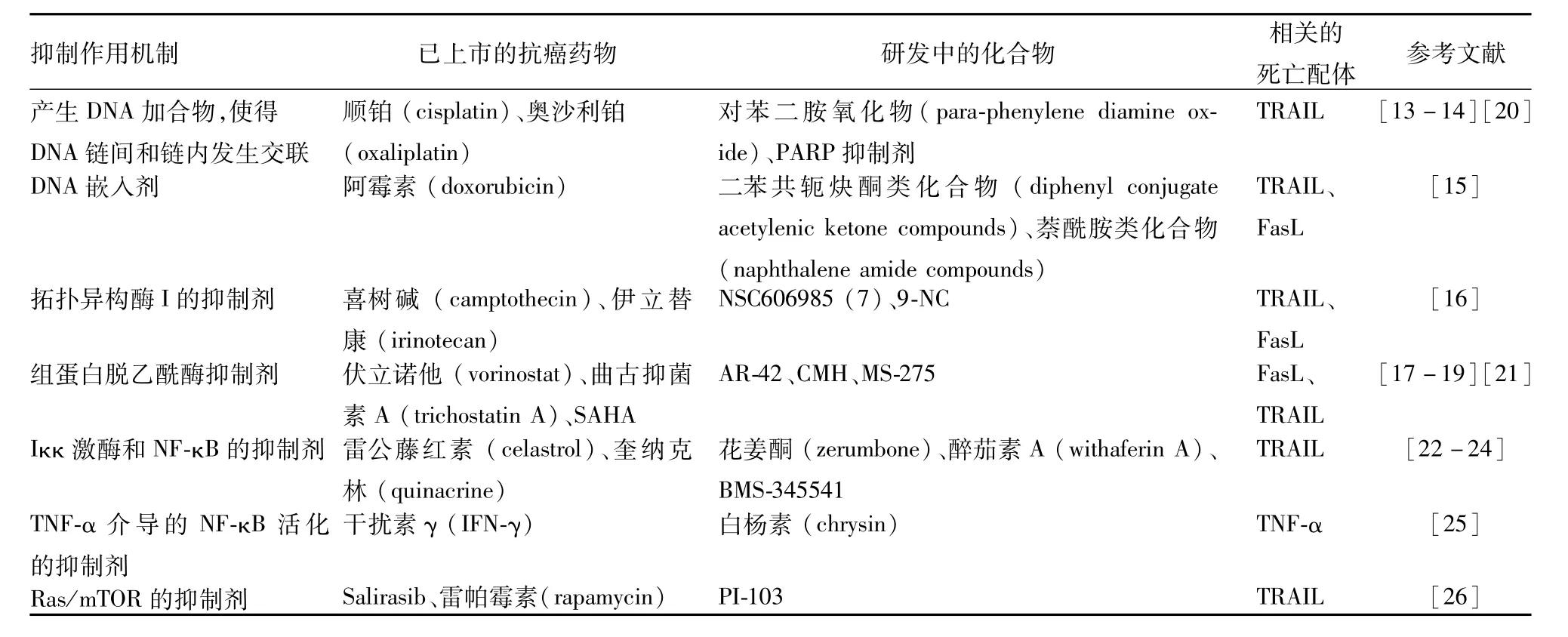
Tab 1 Medicine or compounds inhibiting c-FLIP expression at the transcriptional level
3 c-FLIP为多种肿瘤化疗药的靶点之一
由于细胞存亡调控蛋白c-FLIP在很多肿瘤细胞中存在,并且在这些肿瘤细胞中起着很重要的抗凋亡的作用,所以,在近年来新研究的抗肿瘤药物中,以c-FLIP为靶点的药物研发也越来越多,如下调c-FLIP的转录、翻译水平,或是促进它的降解等。
3.1 转录及翻译调节(Tab 1、2) 目前,治疗DNA损伤的药物有望下调c-FLIP的水平。一些化学治疗药物包括顺铂(cisplatin)[13-14]、阿霉素 (doxorubicin)[15]、拓扑异构酶 I(topoisomerase I)的抑制剂[16]等在不同肿瘤细胞中通过抑制c-FLIP的转录,促进癌细胞对死亡受体引起的凋亡的发生。组蛋白脱乙酰酶抑制剂 (histone deacetylase inhibitors)通过下调c-FLIP的转录、翻译水平,成功地抑制了不同恶性肿瘤细胞的增殖,并使其发生凋亡[17-19]。例如,最近,Bijangi-Vishehsaraei等[17]发现的一种新的组蛋白脱乙酰酶抑制剂[4-(4-Chloro-2-methyphenoxy)-N-hydroxybutanamide,CMH],通过下调c-FLIPL和 c-FLIPS的mRNA和蛋白水平,使得人乳腺癌细胞MCF-7发生凋亡。更有趣的是,这种药物会使得对阿霉素具有抗性的突变的MCF-7细胞具有更强的凋亡作用。
Kinoshita等[20]在研究人成骨肉瘤细胞MG-63通过免疫调节机制逃离Fas/CD95介导的凋亡时发现,当使用顺铂后,发现它对凋亡的敏感性增强,进一步研究后,发现顺铂主要是下调c-FLIPL,而对其它的抗凋亡蛋白如XIAP等没作用。
组蛋白去乙酰化酶和拓扑异构酶I的抑制剂也被作为调节c-FLIP水平的新的抗肿瘤药。Park等[21]在卵巢癌细胞SKOV3中发现,曲古抑菌素A(trichostatin A)可以下调c-FLIPL的mRNA和蛋白水平,而对c-FLIPS无明显影响。与此同时还发现,表皮生长因子(epidermal growth factor,EGF)信号途径的抑制剂会阻碍通过曲古抑菌素A调控的c-FLIPL的下调作用。
Jani等[22]在研究结肠癌细胞时,发现多种结肠癌细胞都对TRAIL或奥沙利铂产生了耐药性,究其原因,在这些肿瘤细胞中抗凋亡蛋白c-FLIP和 Mcl-1(myeloid cell leukemia-1,Bcl-2家族的一个新成员)的表达都有所上升,导致NF-κB上调,最终导致肿瘤细胞具有了抵抗凋亡的能力,但实验发现,结肠癌细胞在经过NF-κB的抑制剂奎纳克林 (quinacrine)或是 Iκκ(inhibitor of nuclear factor kappa-B kinase,Iκκ)抑制剂BMS-345541处理后,细胞对凋亡的敏感性大大增加,使得细胞恢复了凋亡活性。Charette等[26]发现,salirasib处理肝癌细胞后,下调了Ras的表达,而且还能抑制哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)的表达,使得与凋亡相关的caspase-3被激活、细胞色素C释放、死亡受体上调,以及细胞存亡调控蛋白c-FLIP在mRNA水平上的表达降低,最终使得肝癌细胞发生凋亡。
Katz等[31]发现,使用多激酶抑制剂索拉非尼 (sorafenib)对治疗恶性胸膜间皮瘤具有很好的疗效,在索拉非尼作用3 h后,很多抗凋亡蛋白,包括Mcl-1、c-FLIPL、生存素以及cIAP等发生磷酸化或是表达水平降低,从而增强了恶性胸膜间皮瘤对TRAIL的敏感性。
Olsson等[36]用浓度 300μg·L-1TRAIL处理慢性 B淋巴细胞白血病 (B-cell chronic lymphocytic leukemia,B-CLL)后,发现细胞仍然耐受,但当加入RNA的合成抑制剂放线菌素D(actinomycin D)后发现,B-CLL细胞对TRAIL诱导的凋亡开始敏感。最终通过蛋白质印迹等实验,证明了细胞对TRAIL产生耐受的根本原因在于c-FLIPL的过高表达,而放线菌素D的作用则是使得c-FLIPL和c-FLIPS的表达都降低。
Day等[2]发现,在低浓度的紫杉醇 (taxol)作用下,会引起CCRF-HSB-2人急性淋巴母细胞型白血病细胞发生caspase-8/10依赖的凋亡,而且会引起c-FLIPS和c-FLIPL下调。另外,紫杉醇会通过转录后调控和非caspase依赖机制来降低c-FLIP的表达。

Tab 2 Medicine or compounds inhiniting c-FLIP expression at the post-transcriptional level
3.2 干扰RNA的方法:siRNA RNA干扰 (RNA interference,RNAi)是一种广泛存在于高等植物和动物中的由双链RNA介导的转录后基因沉寂 (post transcriptional gene silencing,PTGS)的现象。外源双链RNA在细胞内一种被称为Dicer的核酸酶的作用下,被剪切成含19-23个核苷酸对的小RNA片段,称为小干扰 RNA(small interfering RNA,siRNA)。后者与Dicer及其它一些蛋白质共同构成RNA诱导的沉寂复合物 (RNAi inducing silence complex,RISC),依靠碱基互补规律识别与siRNA同源的mRNA分子,并将其降解。在肿瘤的基因治疗过程中,通过人工合成特定癌基因靶向的siRNA,并将其导入肿瘤细胞中,可以特异性地抑制目的基因的表达。干扰RNA的方法可以直接抑制c-FLIP蛋白的翻译过程,使得 c-FLIP的表达量降低。Chawla-Sarkar等[37]通过siRNA技术成功地下调了抗凋亡蛋白Bcl-2、FLIP和IAPs的表达。
在体外,以c-FLIP基因为靶点的siRNA技术改变了传统的癌症治疗方法。Day等[38]发现在很多肿瘤细胞中,c-FLIPsiRNA的脂质体复合物,能够成功干扰c-FLIP基因,使得体外的MCF-7细胞发生自发性的凋亡,而且注射c-FLIP siRNA的脂质体复合物到小鼠的MCF-7移植瘤中,移植瘤也出现了自发性凋亡。
除此之外,非小细胞肺癌细胞 A549、结肠癌细胞HCT116等的c-FLIP基因的表达都会因此降低。但是,在体内siRNA却仍有很多局限性,临床上要将siRNA用来治疗肿瘤,可能还需要一段时间。
3.3 c-FLIP的降解(Tab 3) c-FLIP抑制剂或拮抗剂主要是通过泛素化-蛋白酶系统来实现对c-FLIP的降解。广谱的代谢抑制剂是最早被用来研究抑制c-FLIP表达的机制。目前,许多化合物都对细胞中的c-FLIP有广泛的下调作用,如蛋白合成抑制剂环十二碳三烯 (cyclohexamide)或者茴香霉素 (anisomycin)[39]。化学治疗药5-氟尿嘧啶 (5-FU)也被证实能下调癌细胞系的c-FLIPL和c-FLIPS[40]。蛋白酶抑制剂硼替佐米(bortezomib)被广泛应用于许多不同的细胞系。何杰金病细胞、星形细胞瘤细胞、鼻腔神经胶质瘤细胞、髓系白血病细胞、骨髓瘤细胞等,在经过硼替佐米处理过后,c-FLIP的水平都有所下降。然而,Zhao等[41]则发现,硼替佐米主要作用的是c-FLIPL,但也有作用于c-FLIPS的,c-FLIPL的下调和c-FLIPS的上调好像有关。在研究小分子的蛋白酶抑制剂MG-132时发现,它在不同的细胞系中对c-FLIP都有下调、抑制的作用。MG-132、PS-34在慢性淋巴细胞性白血病细胞中,能够上调TRAIL和它的死亡受体DR4、DR5的表达量,最终下调了c-FLIP的表达。很明显,硼替佐米和MG-132促进每种细胞对TRAIL诱导凋亡的敏感性,这表明凋亡的恢复并不是c-FLIPL和c-FLIPS同时下调的结果。但是,要真正解释c-FLIP的亚型的作用,还需要进一步的研究。
3.4 死亡配体与传统化学治疗药物联合用药 研究发现,单纯降低c-FLIP的蛋白或RNA水平,不能明显促进肿瘤细胞的凋亡。所以,在降低抗凋亡蛋白的表达的同时,还必须同时激活外源性凋亡机制,而激活外源性凋亡机制则与死亡配体 TRAIL、FasL或 TNF-α等有关 (如 Tab 1、2、3)。
但是,一直以来,死亡受体及其配体都被认为会引起细胞毒性的级联反应,不光对肿瘤细胞,对正常细胞也会有一定的毒害作用。而且,研究还发现,死亡配体和受体具有许多非凋亡相关的功能,包括调节细胞增殖、分化、细胞趋化因子的产生、炎症反应以及促进肿瘤细胞生长的功能,如TNF-α引起的炎症反应导致的肿瘤生长[45]、Fas及其配体会介导具有免疫功能的正常淋巴细胞发生凋亡等[46]。
然而,近年来发现的死亡配体TRAIL只对肿瘤细胞具有作用,而对正常细胞几乎没有影响,因此,被认为是一种很好的抗癌药。但是,Naka等[47]在研究具有严重联合免疫缺陷的小鼠时发现,当其被移植了结肠肿瘤时,TRAIL单独用药时抗肿瘤效果不是很明显,但是,如果将TRAIL与传统的化疗药物,如5-FU或伊立替康联合用药时,具有很明显的抗肿瘤效果。所以,将TRAIL与传统的化学治疗药物联合用药,能增加TRAIL对肿瘤细胞的敏感性,这样可以协同提高对肿瘤的治疗效果。

Tab 3 Medicine or compounds inducing c-FLIP degradation
4 结语与展望
c-FLIP不同亚型在不同癌细胞中是否具有不同的作用,其具体的作用机制目前仍不清楚。虽然已经发现药物对其具有抑制作用,但通常不是对c-FLIP各种亚型都有作用,而只是针对c-FLIP的某一种亚型有作用。
作为死亡受体凋亡途径中一个关键的负调控因子,c-FLIP是肿瘤治疗的一个非常关键的作用靶点。虽然很多化学治疗药物对c-FLIP都具有一定的下调作用,但是,到目前为止,除了siRNA的方法,无论是在mRNA水平,还是在蛋白水平,还没有一个直接只作用于c-FLIP的小分子抑制剂。这也使得研究小分子的c-FLIP专一抑制剂或拮抗剂具有重要的意义。
因为c-FLIP与procaspase-8相比,起催化作用的两个氨基酸残基被取代,因此,不具备caspase蛋白水解酶的活性,从而不能形成活化的片段,使其没有酶切活性。又由于 v-FLIP家族中MC159的晶体结构已被解析出来,c-FLIP与procaspase-8的DED区域通过氨基酸序列比对,可以看出二者的DED区域具有明显的差异,这说明两者与FADD的DED结合位点可能有很大的差异。最近,Majkut等[48]发现,c-FLIP与 FADD结合于 FADD的 DED的 α1-螺旋和 α4-螺旋,procaspase-8与FADD结合于FADD的DED的α2-螺旋和α5-螺旋。根据这一特性,可以寻找一些能够干扰c-FLIP的DED募集到FADD的小分子化合物,而且这些化合物不会抑制procaspase-8的活化。目前,可以通过建立高通量或高内涵筛选体系,有望从众多的化合物中筛选出c-FLIP的专一性拮抗剂。
但是,在寻找降低c-FLIP表达的药物过程中,发现很多药物或化合物在杀死肿瘤细胞的同时,对正常细胞同样会造成损伤。比如楝酰胺(rocaglamide),虽然它能够明显降低c-FLIP的表达,但是,实验中发现,它对正常细胞也有很大的毒害作用,正因为如此,其没有被广泛应用。传统化学治疗药物对正常细胞也有类似毒害作用,这使得将来的研究方向更加明确,需要找到一种只针对于肿瘤细胞有作用,而对正常细胞没有伤害的靶向特异性药物。
总之,以细胞存亡调控蛋白c-FLIP为靶点筛选出它的专一性抑制剂,并激活外源性凋亡通路,将为癌症治疗提供新的方法与思路,对肿瘤的临床治疗具有重要的指导意义。
参考文献:
[1] Almasan A,Ashkenazi A.Apo2L/TRAIL:apoptosis signaling,biology,and potential for cancer therapy[J].Cytokine Growth Factor Rev,2003,14(3-4):337-48.
[2] Day T W,Najafi F,Wu C H,Safa A R.Cellular FLICE-like inhibitory protein(c-FLIP):a novel target for Taxol-induced apoptosis[J].Biochem Pharmacol,2006,71(11):1551-61.
[3] Laukens B,Jennewein C,Schenk B,et al.Smac mimetic bypasses apoptosis resistance in FADD-or caspase-8-deficient cells by priming for tumor necrosis factorα-induced necroptosis[J].Neoplasia,2011,13(10):971-9.
[4] Oltersdorf T,Elmore SW,Shoemarker A R,et al.An inhibitor of Bcl-2 family proteins induces regression of solid tumours[J].Nature,2005,435(7042):677-81.
[5] Thome M,Schneider P,Hofmann K,et al.Viral FLICE-inhibitory proteins(FLIPS)prevent apoptosis induced by death receptors[J].Nature,1997,386(6624):517-21.
[6] Irmler M,Thome M,Hahne M,et al.Inhibition of death receptor signals by celluar FLIP[J].Nature,1997,388(6638):190-5.
[7] Shirley S,Micheau O.Targeting c-FLIP in cancer[J].Cancer Lett,2013,332(2):141-50.
[8] Oztürk S,Schleich K,Lavrik I N,et al.Cellular FLICE-like inhibitory proteins(c-FLIPS):fine-tuners of life and death decisions[J].Exp Cell Res,2012,318(11):1324-31.
[9] Poukkula M,Kaunisto A,Hietakangas V,et al.Rapid turnover of c-FLIPshort is determined by its unique C-terminal tail[J].J Biol Chem,2005,280(29):27345-55.
[10]Safa A R,Pollok K E.Targeting the anti-apoptotic protein c-FLIP for cancer therapy[J].Cancers,2011,3(2):1639-71.
[11]Kim S,Lee T J,Park JW,Kwon T K.Overexpression of cFLIPSinhibits oxaliplatin-mediated apoptosis through enhanced XIAP stability and Akt activation in human renal cancer cells[J].J Cell Biochem,2008,105(4):971-9.
[12]Chang Z,Xing Z,Pan Y.c-FLIPLis a dual function regulator for caspase-8 activation and CD-95-mediated apoptosis[J].EMBO J,2002,21(14):3704-14.
[13]Longley D B,Wilson T R,McEwan M,et al.c-FLIP inhibits chemotherapy-induced colorectal cancer cell death[J].Oncogene,2006,25(6):838-48.
[14]Wilson T R,McLaughlin K M,McEwan M,et al.c-FLIP:A key regulator of colorectal cancer cell death[J].Cancer Res,2007,67(12):5754-62.
[15]El-Zawahry A,McKillop J,Voelkel-Johnson C.Doxorubicin increases the effectiveness of Apo2L/TRAIL for tumor growth inhibition of prostate cancer xenografts[J].BMC Cancer,2005,5(2):1-9.
[16]Chatterjee D,Schmitz I,Krueger A,et al.Induction of apoptosis in 9-nitrocamptothecin treated DU145 human prostate carcinoma cells correlates with de novo synthesis of CD95 and CD95 ligand and down-regulation of c-FLIP(short)[J].Cancer Res,2001,61(19):7148-54.
[17]Bijangi-Vishehsaraei K,Saadatzadeh M R,Huang S,et al.4-(4-Chloro-2-methyphenoxy)-N-hydroxybutanamide(CMH)targets mRNA of the c-FLIPvariants and induces apoptosis in MCF-7 human breast cancer cells[J].Mol Cell Biochem,2010,342(1-2):133-42.
[18]Lucas D M,Alinari L,West D A,et al.The novel deacetylase inhibitor AR-42 demonstrates pre-clinical activity in B-cell malignancies in vitro and in vivo[J].PLoSOne,2010,5(6):1-10.
[19]龚爱华,熊二梦,张 严,等.SAHA诱导的p21表达致U251MG细胞抗凋亡效应[J].中国药理学通报,2013,29(12):1743-6.
[19]Gong A H,Xiong E M,Zhang Y.SAHA-induced p21 expression results in anti-apoptotic effects in U251MG cells[J].Chin Pharmacol Bull,2013,29(12):1743-6.
[20]Kinoshita H,Yoshikawa H,Shiiki K,et,al.Cisplatin(CDDP)sensitizes human osteosarcoma cell to Fas/CD95-mediated apoptosis by down-regulating FLIPLexpression[J].Int J Cancer,2000,88(6):986-91.
[21]Park SJ,Kim M J,Kim H B,et al.Trichostatin A sensitizes human ovarian cancer cells to TRAIL-induced apoptosis by down-regulation of c-FLIPLvia inhibition of EGFR pathway[J].Biochem Pharmacol,2009,77(8):1328-36.
[22]Jani T S,Devecchio J,Mazumdar T,et al.Inhibition of NF-kappaB signaling by quinacrine is cytotoxic to human colon carcinoma cell lines and is synergistic in combination with TRAIL or oxaliplatin[J].J Biol Chem,2010,285(25):19162-72.
[23]Yodkeeree S,Sung B,Limtrakul P,Aggarwal B B.Zerumbone enhances TRAIL-induced apoptosis through the induction of death receptors in human colon cancer cells:evidence for an essential role of reactive oxygen species[J].Cancer Res,2009,69(16):6581-9.
[24]Lee T J,Um H J,Min D S,et al.Withaferin a sensitizes TRAIL-induced apoptosis through reactive oxygen species-mediated up-regulation of death receptor 5 and downregulation of c-FLIP[J].Free Radic Biol Med,2009,46(12):1639-49.
[25]Li X,Huang Q,Ong C N,et al.Chrysin sensitizes tumor necrosis factor-alpha-induced apoptosis in human tumor cells via suppression of nuclear factor-kappaB[J].Cancer Lett,2010,293(1):109-16.
[26]Charette N,De Saeger C,Lannoy V,et al.Salirasib inhibits the growth of hepatocarcinomacell lines in vitro and tumor growth in vivo through ras and mTOR inhibition[J].Mol Cancer,2010,9(256):2-14.
[27]Wang W,Wang S,Song X,et al.The relationship between c-FLIP expression and human papillomavirus E2 gene disruption in cervical carcinogenesis[J].Gynecol Oncol,2007,105(3):571-7.
[28] Bleumink M,Köhler R,Giaisi M,et al.Rocaglamide breaks TRAIL resistance in HTLV-1-associated adult T-cell leukemia/lymphoma by translational suppression of c-FLIP expression[J].Cell Death and Differ,2011,18(2):362-70.
[29]Son Y G,Kim E H,Kim JY,et al.Silibinin sensitizes human glioma cells to TRAIL-mediated apoptosis via DR5 up-regulation and down-regulation of c-FLIP and survivin[J].Cancer Res,2007,67(17):8274-84.
[30]Siegelin M D,Siegelin Y,Habel A,Gaiser T.Genistein enhances proteasomal degradation of the short isoform of FLIP in malignant glioma cells and thereby augments TRAIL-mediated apoptosis[J].Neurosci Lett,2009,453(2):92-7.
[31]Katz SI,Zhou L,Chao G,et al.Sorafenib inhibits ERK1/2 and MCL-1(L)phosphrylation levels resulting in caspase-independent cell death on malignant pleural mesothelioma[J].Cancer Biol T-her,2009,8(24):2406-16.
[32]Pawar P,Ma L,Byon CH,et al.Molecular mechanisms of tamoxifen therapy for cholangiocarcinoma:role of calmodulin[J].Clin Cancer Res,2009,15(4):1288-96.
[33]Yu Z,Wang R,Xu L,et al.β-Elemene piperazine derivatives induce apoptosis in human leukemia cells through downregulation of c-FLIP and generation of ROS[J].PLoS One,2011,6(1):1-10.
[34]Iwase M,Takaoka S,Uchida M,et al.Epidermal growth factor receptor inhibitorsenhance susceptibility to Fas-mediated apoptosis in oral squamous cell carcinoma cells[J].Oral Oncol,2008,44(4):361-8.
[35]Rishi L,Gahlot S,Kathania M,Majumdar S.Pentoxifylline induces apoptosis in vitro in cutaneous T cell lymphoma(HuT-78)and enhances FasL mediated killing by upregulating Fas expression[J].Biochem Pharmacol,2009,77(1):30-45.
[36]Olsson A,Diaz T,Aguilar-Santelises M,et al.Sensitization to TRAIL-induced apoptosis and modulation of FLICE-inhibitory protein in B chronic lymphocytic leukemia by actinomycin D[J].Leukemia,2001,15(12):1868-77.
[37]Chawla-Sarkar M,Bae SI,Reu F J,et al.Downregulation of Bcl-2,FLIP or IAPs(XIAP and survivin)by siRNAs sensitizes resistant melanoma cells to Apo2L/TRAIL-induced apoptosis[J].Cell Death Differ,2004,11(8):915-23.
[38]Day T W,Sinn A L,Huang S,et al.c-FLIPgene silencing eliminates tumor cells in breast cancer xenografts without affecting stromal cells[J].Anticancer Res,2009,29(10):3883-6.
[39]Jeon Y K,Kim H,Park S O,et al.Resistance to Fas-mediated apoptosis is restored by cycloheximide through the downregulation of cellular FLIPLin NK/T-cell lymphoma[J].Lab Invest,2005,85(7):874-84.
[40]Stagni V,Mingardi M,Santini S,et al.ATM kinase activity modulates cFLIP protein levels:potential interplay between DNA damage signalling and TRAIL-induced apoptosis[J].Carcinogenesis,2010,31(11):1956-63.
[41]Zhao X,Qiu W,Kung J,et al.Bortezomib induces caspase-dependent apoptosis in Hodgkin lymphoma cell lines and is associated with reduced c-FLIP expression:a gene expression profiling study with implications for potential combination therapies[J].Leuk Res,2008,32(2):275-85.
[42]Lin Y,Liu X,Yue P,et al.Involvement of c-FLIP and survivin down-regulation in flexible heteroarotinoid-induced apoptosis and enhancement of TRAIL-initiated apoptosis in lung cancer cells[J].Mol Cancer Ther,2008,7(11):3556-65.
[43]Kang Y J,Kim I Y,Kim E H,et al.Paxilline enhances TRAIL-mediated apoptosis of glioma cells via modulation of c-FLIP,survivin and DR5[J].Exp Mol Med,2011,43(1):24-34.
[44]Lee SJ,Noh H J,Sung E G,et al.Berberine sensitizes TRAIL-induced apoptosis through proteasome-mediated downregulation of c-FLIPand Mcl-1 proteins[J].Int JOncol,2011,38(2):485-92.
[45]Balkwill F.TNF-alpha in promotion and progression of cancer[J].Cancer Metastasis Rev,2006,25(3):409-16.
[46]Lu B,Finn O J.T-cell death and cancer immune tolerance[J].Cell Death Differ,2008,15(1):70-9.
[47]Naka T,Sugamura K,Bonnie L,et al.Effects of tumor necrosis factor-related apoptosis-inducing ligand alone and in combination with chemotherapeutic agents on patients'colon tumors grown in SCID mice[J].Cancer Res,2002,62(20):5800-6.
[48]Majkut J,Sgobba M,Holohanl C,et al.Differential affinity of FLIP and procaspase8 for FADD’s DED binding surfaces regulates DISC assembly[J].Nat Commun,2014,5(3350):1-12.