孕酮抑制Aβ诱导星形胶质细胞活化所致神经元损伤
2014-05-17吴红海秦亚彬韩晓磊侯艳宁
吴 洁,吴红海,于 洋,秦亚彬,韩晓磊,侯艳宁
(1.中国人民解放军白求恩国际和平医院药剂科,河北石家庄 050082;2.河北医科大学药理教研室,河北 石家庄 050017)
阿尔采末病(Alzheimer’s disease,AD)是一种以进行性认知功能障碍和记忆损伤为主要临床表现的中枢神经系统退行性病变。其典型病理改变为淀粉样斑块形成、神经纤维缠结、神经元变性死亡和胶质细胞过度增生活化。星形胶质细胞是中枢神经系统最丰富的细胞类型,适度激活的星形胶质细胞可胞吞Aβ蛋白,释放神经营养因子,保护神经元;但过度激活的星形胶质细胞,通过释放神经毒性的细胞因子和其他毒性物质,诱导神经元凋亡,加速AD病理进程。研究表明[1],大脑星形胶质细胞的活化和其所分泌细胞因子的改变通常比AD的典型病理改变早10多年,在AD的发生、发展中有重要的作用。
孕酮(progesterone,PROG)是重要的天然孕激素之一,主要用于保护妊娠和妇科疾病的治疗。近年来,大量研究发现,孕酮还可作为神经活性甾体,通过抑制炎症反应、抑制中枢兴奋性毒性、抗氧化、抗缺血、抗凋亡、神经营养、改善学习记忆等,对颅脑损伤及神经退行性疾病发挥保护作用[2-4]。本文旨在研究孕酮在抑制Aβ1-42诱导星形胶质细胞活化,保护神经元中的作用及其机制,为孕酮在AD防治中的应用提供实验依据。
1 材料与方法
1.1 主要试剂与仪器 新生SD大鼠,清洁级,由河北省实验动物中心提供[许可证号:SCXK(冀)2008-1003];DMEM培养液、胎牛血清(Gibco);Aβ1-42、PROG(Sigma);IL-1β ELISA kit、TNF-α ELISA kit(Blue Gene);NF-κB抗体(Cell Signal);Alexa Fluor 488标记的山羊抗兔二抗(中杉金桥);Lamin A抗体、辣根酶标记山羊抗兔/鼠IgG(Santa Cruz);超净台(中国苏净集团);CO2细胞培养箱(Thermo Forma);电热恒温水浴锅(科隆仪器设备厂);倒置显微镜(上海精密仪器厂);荧光显微镜及显微成像系统(日本Olympus公司);酶标仪(德国BMG公司);低温离心机(Thermo);电泳仪(北京六一厂)。
1.2 大鼠大脑星形胶质细胞原代培养 取新生24 h SD大鼠,无菌条件下取大脑皮质,剪碎,37℃水浴中胰酶消化15~20 min,含10%FBS的高糖DMEM终止消化。使用巴氏吸管吹散细胞,制备单细胞悬液,接种于预先包被多聚赖氨酸的培养瓶中,37℃,5%CO2细胞培养箱中孵育,每隔2~3 d全量更换培养液,至细胞基本融合。使用“二次震荡法”纯化星形胶质细胞,GFAP免疫荧光染色结果显示,星形胶质细胞纯度超过95%。纯化后星形胶质细胞经消化、重悬,以1×108·L-1密度接种于6孔板中,含10%FBS的DMEM培养。
1.3 大鼠大脑皮质神经元培养 参照本实验室已建立方法[5],略有改进。取新生24 h内SD大鼠大脑皮质部分,进行细胞培养,6 h后首次换液为含2%B27的neurobasal培养基,培养48 h后加入阿糖胞苷抑制胶质细胞生长,48 h以后完全换液,此后,每2 d半量换液。取培养6~7 d的神经元细胞供实验用。
1.4 星形胶质细胞与神经元共培养 参照文献[6]方法,略有改进。星形胶质细胞培养于孔底部含有4个约0.5 mm高石蜡小柱的6孔板中,石蜡小柱用于支撑载玻片;神经元培养在经多聚赖氨酸处理的载破片上,培养7 d后,将载有神经元的玻片放入石蜡小柱上,与星形胶质细胞进行共培养。
1.5 实验分组与给药 星形胶质细胞随机分为对照组、Aβ(5μmol·L-1Aβ1-42)组及Aβ加3个浓度PROG处理组 PL、PM、PH(0.01、0.1、1μmol·L-1PROG,各组同时加入 5μmol·L-1Aβ1-42),处理24 h,检测炎症因子的释放、NF-κB的活性。将载有神经元的玻片放入经不同给药处理的星形胶质细胞中进行共培养,更换培养液为 DMEM(不含 Aβ、PROG),继续培养48 h,检测共培养神经元的存活率。
1.6 MTT法 取出神经元细胞爬片,放入24孔板中,每孔加入 40μl MTT(5 g·L-1),于 37℃孵育4 h,弃去培养基,每孔各加入300μl DMSO,混合均匀,酶标仪测定各组细胞490 nm波长处的吸光度(OD值),以各组细胞吸光度与对照组吸光度的比值表示相对细胞存活率。
1.7 ELISA检测 取各组细胞条件培养液,3 000 r·min-1离心 10 min,取上清,按试剂盒说明书操作,测定炎症因子IL-1β和TNF-α的水平。
1.8 细胞免疫荧光分析 取各处理组星形胶质细胞,4%多聚甲醛固定30 min,兔源 p65(1∶100)4℃孵育过夜,二抗孵育1 h,荧光显微镜下观察。
1.9 Western blot分析 取各组星形胶质细胞,冰上提取细胞核蛋白,等量蛋白提取液与上样缓冲液混合,煮沸变性。样品经SDS-PAGE电泳分离,100 mA湿转,脱脂奶粉封闭,加兔源p65(1∶1 000)孵育过夜,TBS漂洗后,加辣根过氧化物酶标记的二抗室温孵育2 h,ECL光化学法显色,暗室中压X线片显影。X-线胶片经扫描,应用Image J图像分析软件对扫描图上的条带进行相对定量分析。
1.10 统计学方法 结果以¯x±s表示,应用SPSS 16.0统计软件,采用单因素方差分析(one way ANOVA),继以Dunnett t test对数据进行统计分析。
2 结果
2.1 孕酮抑制Aβ1-42诱导星形胶质细胞活化所致神经元损伤 MTT结果显示,与对照组相比,Aβ组大鼠皮质神经元存活率下降,为对照组的70.1%(P<0.05)。与Aβ组相比,PM、PH组神经元存活率升高,分别为Aβ组的1.159倍和1.296倍 (P<0.05)。孕酮抑制Aβ1-42活化星形胶质细胞引起的神经元存活率下降,作用呈浓度依赖性,结果见Fig 1。

Fig 1 Effect of PROG treated Aβ1-42 activated astrocytes on viability of cultured cortical neurons#P<0.05 vs control group;*P<0.05 vs Aβgroup

Fig 2 Effect of PROG on release of inflammatory cytokines from Aβ1-42 activated astrocytes**P<0.01 vs control group;#P<0.05 vs Aβgroup
2.3 PROG对 Aβ1-42诱导的星形胶质细胞 NF-κB活性的影响 NF-κB主要功能性亚单位p65在细胞中的定位,反映NF-κB的活性。免疫荧光结果显示,p65在对照组细胞的胞质明显表达,胞核无着色;Aβ
2.2 PROG对 Aβ1-42诱导的星形胶质细胞炎症因子释放的影响 ELISA结果显示,与对照组相比,Aβ组条件培养液中IL-1β和TNF-α水平均升高(P<0.01);与 Aβ组相比,PM、PH组 IL-1β和 TNF-α的水平均下降(P<0.05);PL组 IL-1β和 TNF-α的水平变化差异无统计学意义(P>0.05)。孕酮浓度依赖地抑制Aβ1-42活化星形胶质细胞炎症因子的释放,结果见Fig 2。组NF-κB被激活,p65在胞核明显表达。随孕酮浓度的增加,p65在胞核中的分布逐渐减少,胞质中分布增多,孕酮浓度依赖地抑制Aβ1-42引起的p65核转位,结果见Fig 3。
Western blot结果显示,与对照组相比,Aβ组星形胶质细胞核提取液中 p65的表达增加(P<0.01)。与 Aβ组相比,PM、PH组细胞核提取液中p65表达量降低(P<0.01),低剂量组差异无统计学意义(P>0.05)。孕酮浓度依赖地抑制 Aβ1-42活化星形胶质细胞中NF-κB的活性,结果见Fig 4。
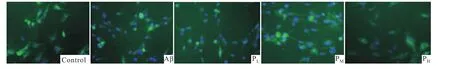
Fig 3 Effect of PROG on nuclear translocation of p65 in Aβ1-42 activated astrocytes observed under fluorescence microscope(400×)

Fig 4 Effect of PROG on p65 expression in nucleus of Aβ1-42 activated astrocytesA:The relative amounts of p65 levels were detected by Western blot analysis,lamin A was used as an internal control;B:Densitometric scanning.##P<0.01 vs control group;**P<0.01 vs Aβgroup.
3 讨论
孕酮作为神经活性甾体,发挥广泛的神经系统调节、保护作用。首先,孕酮能够增加神经元在缺血损伤中的耐受性[7],维持神经元在Aβ损伤中的活性与功能[8]。也有研究表明,孕酮能够通过抑制星形胶质细胞和小胶质细胞的活化,在急性脑损伤、脊髓损伤及痛风模型中,发挥有效保护作用[9-11]。然而,孕酮作用与Aβ活化的星形胶质细胞对神经元的影响,尚未见文献报道。
本实验首次将孕酮作用于Aβ1-42活化的星形胶质细胞,观察与其共培养神经元存活率的变化。结果发现,Aβ1-42活化的星形胶质细胞与神经元共培养,使神经元存活率明显下降;孕酮能够有效抑制Aβ1-42活化星形胶质细胞引起的神经元存活率下降,发挥神经元保护作用。
星形胶质细胞能够动态地调节信息处理、信号转导,调控神经和突触可塑性,为神经元提供营养和代谢支持[12]。然而,中枢神经系统的各种刺激,诱导星形胶质细胞活化、增生,使其正常生理功能发生一系列变化,影响神经元的活性。文献报道[6],Aβ作用于星形胶质细胞,使其线粒体功能障碍,能量代谢异常;吞噬与清除Aβ功能受损,致Aβ蓄积[13];谷氨酸转运系统障碍,兴奋性毒性物质蓄积[6];谷胱甘肽合成代谢障碍,过氧化产物蓄积[14];释放神经毒性的细胞因子和其他毒性物质等[15]。Aβ引起星形胶质细胞代谢表型的改变,都在一定程度上诱导神经元凋亡及AD的发生、发展。
实验从抑制炎症反应方面,研究孕酮发挥神经保护作用的机制。将不同浓度的孕酮处理Aβ1-42活化的星形胶质细胞,孕酮有效降低Aβ1-42活化星形胶质细胞条件培养液中IL-1β、TNF-α的水平,抑制NF-κB的活性,在一定程度上反映了孕酮对 Aβ1-42活化星形胶质细胞的抑制,作用呈浓度依赖性。炎症因子IL-1β、TNF-α介导细胞炎症级联反应;增加β-淀粉样前体蛋白APP及其剪切酶BACE的表达,促进Aβ的生成与释放;作为死亡配体,诱导神经元凋亡,在 AD的发生、发展中起重要作用[16]。NF-κB作为基因表达转录因子,参与炎症反应、氧化应激反应和细胞凋亡等的调控过程,与许多基因启动子区域的固定核苷酸序列相结合,启动基因转录,在多种疾病的发病过程中有重要作用[3,18]。因此,与Chen等[3]发现孕酮通过抑制 TLRs/NF-κB信号通路,减少IL-1β、TNF-α、IL-6的表达,发挥保护急性脑损伤作用相一致,本研究认为,NF-κB信号通路在孕酮抑制Aβ诱导的星形胶质细胞活化,发挥神经元保护作用中有重要意义。
综合实验室前期孕酮对Aβ25-35诱导的阿尔采末病模型神经元凋亡有保护作用的发现[5],说明孕酮不仅能保护Aβ直接导致的神经元损伤,还可通过抑制胶质细胞活化,发挥对神经元的保护作用,对AD的预防和治疗极具潜力。
参考文献:
[1] Serrano-Pozo A,Mielke M L,Gómez-Isla T,et al.Reactive glia not only associates with plaques but also parallels tangles in Alzheimer’s disease[J].Am J Pathol,2011,179(3):1373-8420.
[2] Meffre D,Labombarda F,Delespierre B,et al.Distribution of membrane progesterone receptor alpha in the male mouse and rat brain and its regulation after traumatic brain injury[J].Neurosci,2013,231:111-24.
[3] Chen G,Shi J,Jin W.Progesterone administration modulates TLRs/NF-κB signaling pathway in rat brain after cortical contusion[J].Ann Clin Lab Sci,2008,38(1):65-74.
[4] Feeser V R,Loria R M.Modulation of traumatic brain injury using progesterone and the role of glial cells on its neuroprotective actions[J].J Neuroimmunol,2011,237(1-2):4-12.
[5] 于 洋,薛 改,吴红海,等.Aβ25-35对大鼠大脑皮质神经元神经甾体水平的影响[J].中国药理学通报,2010,26(6):783-6.
[5] Yu Y,Xue G,Wu H H,et al.Effects of Aβ25-35treatment on the levels of neurosteroids in cortical neurons[J].Chin Pharmacol Bull,2010,26(6):783-6.
[6] Allaman I,Gavillet M,Bélanger M,et al.Amyloid-beta aggregates cause alterations of astrocytic metabolic phenotype:impact on neuronal viability[J].J Neurosci,2010,30(9):3326-38.
[7] 李新娟,何瑞芳,李 爽,等.孕酮对全脑缺血/再灌注损伤大鼠学习记忆及海马P2X7受体表达的影响[J].中国应用生理学杂志,2012,28(5):472-5.
[7] Li X J,He R F,Li S,et al.Effects of progesterone on learning and memory and P2X7 receptor expression in the hippocampus after global cerebral ischemia reperfusion injury in rats[J].Chin J Appl Physiol,2012,28(5):472-5.
[8] Liu S,Wu H G,Xue G,et al.Metabolic alteration of neuroactive steroids and protective effect of progesterone in Alzheimer’s disease-like rats[J].Neural Rege Res,2013,8(30):2800-10.
[9] Labombarda F,González S,Lima A,et al.Progesterone attenuates astrocytes and microgliosis and enhances oligodendrocyte differentiation following spinal cord injury[J].Exp Neurol,2011,231(1):135-46.
[10]Meyer M,Gonzalez D,Garay L I,et al.Stage dependent effects of progesterone on motoneurons and glial cells of Wobbler mouse spinal cord degeneration[J].Cell Mol Neurobiol,2010,30(1):123-35.
[11]Garay L,Tüngler V,Deniselle M C,et al,Progesterone attenuates demyelination and microglial reaction in the lysolecithin-injured spinal cord[J].J Neurosci,2011,192:588-97.
[12] Ransom B,Behar T,Nedergaard M.New roles for astrocytes(stars at last)[J].Trends Neurosci,2003,26(10):520-2.
[13]Zhao J,O′Connor T,Vassar R.Contribution of activated astrocytes to Aβproduction:implications for Alzheimer′s disease pathogenesis[J].J Neuroninflamation,2011,8:150.
[14]Chen Y,Vartiainen N,Ying W,et al.Astrocytes protect neurons from nitric oxide toxicity by a glutathione-dependent mechanism[J].J Neurochem,2001,77(6):1601-10.
[15]Garwood C J,Pooler A M,Athertonl J,et al.Astrocytes are important mediators of Aβ-induced neurotoxicity and tau phosphorylation in primary culture[J].Cell Death Dis,2011,2(6):e167.
[16]Wong A,Luth H J,Deuther-Conrad W,et al.Advanced glycation endproducts co-localize with inducible nitric oxide synthase in Alzheimer′s disease[J].Brain Res,2001,920(1-2):32-40.
[17]Coronel M F,Labombarda F,De Nicola A F,et al.Progesterone reducesthe expression of spinal cyclooxygenase-2 and inducible nitric oxide synthase and prevents allodynia in a rat model of central neuropathic pain[J].Eur J Pain,2014,18(3):348-59.