贝前列素钠对慢性铝过负荷大鼠皮层损伤的作用及机制
2014-05-17阳群芳雷文娟魏玉玲胡馨月纪超男匡胜男麦少珊杨俊卿
阳群芳,雷文娟,魏玉玲,胡馨月,纪超男,杨 洋,匡胜男,麦少珊,杨俊卿
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,重庆 400016)
铝是地壳中分布最广、含量第三的金属元素,在日常生活中具有广泛的用途,如化妆品、食品添加剂、医药产品、炊具、饮用水容器以及建筑材料等,但其生理功能尚未完全清楚[1]。早在1973年,Crapper等[2]通过猫脑室内注射铝盐,发现铝具有明显的神经毒性,表现为神经纤维变性、神经细胞死亡。低剂量铝并不会产生明显毒性症状,仅在蓄积到一定量时才表现出来。铝易沉积于脑内,对中枢神经系统产生明显毒性,如阿尔采末病、帕金森病、肌萎缩侧索硬化症。其中,铝与阿尔采末病的关系研究较为广泛[3-4]。
前列腺素 I2(prostaglandin I2,PGI2),又叫前列环素,是1976年发现的一种由血管内皮细胞合成的血管活性物质,由环氧化酶-2(cyclooxygenase-2,COX-2)及前列环素合酶(prostacyclin synthase,PGIS)共同催化花生四烯酸(AA)而生成的前列腺素(prostaglandins,PGs)产物。PGI2通过激活前列环素受体(prostacyclin receptor,IP)而发挥广泛的生物学效应,但PGI2化学性质不稳定,半衰期短,在体内的半衰期只有3~5 min[5],药理作用十分有限。贝前列素钠(beraprost sodium,BPS)为首个可口服的PGI2类似物,为前体药物。已有的关于PGI2及其类似物的研究报道多集中在心血管方面,而PGI2在神经元中的表达及作用的研究相对较少。在我们的前期研究中发现,BPS对全脑缺血/再灌注(global cerebral ischemia reperfusion,GCIR)大鼠具有明显的脑保护作用,其机制可能涉及到PGIS-IP信号通路的平衡[6]。那么,BPS对慢性铝过负荷大鼠是否具有脑保护作用呢?其机制是否同样涉及到PGIS-IP信号通路呢?
本研究通过建立大鼠慢性铝过负荷损伤模型,观察BPS对铝过负荷大鼠皮层损伤的作用,并通过其对大鼠皮层PGI2含量、PGIS和IP mRNA、IP蛋白表达的影响,初步探讨其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选取清洁级SD大鼠,♂,75只,200~250 g,饲养于SPF清洁环境中,由重庆医科大学实验动物中心提供,合格证书号:SCXK(渝)2012-0002。每组15只,随机分为5组,即正常对照组、慢性铝过负荷模型组、慢性铝过负荷 +BPS 6μg·kg-1组、慢性铝过负荷 +BPS 12μg·kg-1组、慢性铝过负荷 +BPS 24μg·kg-1组。大鼠进行完水迷宫后,每组取3只用4%多聚甲醛进行在体脑组织固定后,迅速分离皮层组织,于多聚甲醛固定液中固定,待用;剩余实验动物断头取脑,冰面上分离皮层组织,-80℃保存。
1.1.2 主要试剂与仪器 贝前列素钠(北京泰德制药股份有限公司),SOD与MDA检测试剂盒(南京建成生物工程研究所),6-k-PGF1αELISA Kit、兔抗鼠IP一抗抗体、辣根过氧化物酶标记山羊抗兔IgG(Cayman公司,美国),PrimeScipt RT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa公司),iQ SYBR@Green预混液、定量PCR仪、凝胶成像图像分析系统(Bio-Rad公司,美国),-80℃超低温冰箱(SANYO公司,日本),DMS-2 Morris水迷宫(中国医学科学院),全自动酶标仪(Spectra Max M2公司,美国),电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 模型建立及药物处理 慢性铝过负荷模型组大鼠每天1次灌胃给予葡萄糖酸铝(Al3+200 mg·kg-1),每周5 d,连续20周,正常对照组给予葡萄糖酸钠。BPS处理组在每次给予葡萄糖酸铝2 h后,分别给予 6、12、24μg·kg-1BPS,正常对照组与铝模型组给予等容积的羧甲基纤维素钠[7]。
1.2.2 水迷宫实验 停止给铝的d 1,使用Morris水迷宫对大鼠空间学习记忆能力进行测定。测定主要由两阶段完成,第一阶段为训练阶段:d 1先将大鼠放到平台上适应60 s,再将其从平台的4个象限依次面池壁入水,后让其自由游泳寻找隐藏在水中的平台,此步骤持续训练4 d,每天4次。在4 d中,180 s内未能找到平台的大鼠,实验者将其引至平台停留10 s,并将寻台潜伏期记为180 s,每只大鼠每天4次的学习成绩作平均值记为空间学习能力;第二阶段即实验进行的d 5,为大鼠学习能力的测试阶段:将大鼠从最后1次入水位置面池壁放入水中,记录大鼠的寻台潜伏期(超过180 s的计为180 s),作为空间记忆能力的评判[8]。
1.2.3 组织病理学观察 水迷宫实验完成后,每组随机挑选3只大鼠,4%水合氯醛腹腔注射将其麻醉,快速滴入100 ml预冷的肝素化磷酸缓冲溶液后,用4%的多聚甲醛200 ml进行在体灌注,断头取脑。迅速分离皮层组织,4%的多聚甲醛固定,石蜡包埋,做厚约4~5μm冠状切面切片,HE染色,观察皮层神经元形态结构变化[9]。
1.2.4 生化酶学检测SOD活性和MDA含量 水迷宫实验完成后,每组随机挑选4只大鼠,分离大鼠皮层组织,-80℃保存。皮层组织用生理盐水制成10 g·L-1的匀浆,根据说明书操作,分别测定SOD活性和MDA含量。
1.2.5 ELISA法测定6-k-PGF1α含量 由于 PGI2结构不稳定,在体内易被代谢为6-k-PGF1α,因此,本实验采用测定6-k-PGF1α含量来间接反映PGI2的含量变化。将上述大鼠皮层组织制成10 g·L-1的匀浆液,并于4℃、12 000×g离心10 min,收集组织上清液。根据说明书操作,测定并计算每个样品中6-k-PGF1α含量。
1.2.6 qRT-PCR检测大鼠皮层组织中PGIS和IP mRNA表达 水迷宫实验完成后,每组随机挑选4只大鼠,分离大鼠皮层组织,-80℃保存,进行PCR和Western blot实验。所有引物由上海生物工程有限公司合成,引物序列参照GenBank基因库,PGIS引物上游序列为 5′-GCTACCTGACCCTGTATGGAGT-3′,下游序列为 5′-GTCTTTATCCCCCACTGACAAG-3′,扩增片段为158 bp,T=57.9℃。IPmRNA引物上游序列为5′-CTGCTGGTGACCTCCATCTTCT-3′,下 游 序 列 为 5′-CTGCGTGAATCCTCTGATCGT-3′,扩增片段为 183 bp,T = 62.3℃。GAPDH mRNA引物上游序列为 5′-ACAGCAACAGGGTGGTGGAC-3′,下游序列为 5′-TTTGAGGGTGCACGAACTT-3′,扩增片段为 250 bp,T=63.5℃。通过比较各组CT(初始循环数)的方法,按照2-ΔΔCT公式进行基因表达的相对定量分析[10]。其中,ΔCT=CT(目的基因) -CT(内参基因),ΔΔCT=ΔCT(实验组)-ΔCT(对照组)。
1.2.7 Western blot检测大鼠皮层组织中IP蛋白表达 组织裂解液提取大鼠皮层组织总蛋白,BCA法进行蛋白定量。蛋白 ∶上样缓冲液1∶4的比例混匀,100℃5 min煮沸变性,进行SDS-PAGE电泳;湿法转至PVDF膜;5%的脱脂奶粉室温摇床封闭1 h;4℃ 过夜 孵 育 IP一抗 (1∶300)、β-actin(1∶1 000);TBST洗膜,室温摇床孵育辣根过氧化物酶标记的二抗(1∶2 000)1 h;TBST洗膜,ECL化学发光。Bio-Rad系统成像,IP蛋白的相对表达量用IP与β-actin的光密度比值进行计算。
1.2.8 统计学分析 应用SPSS 17.0统计软件进行统计学分析,实验数据均用±s表示,组间比较采用方差分析及Dunnett′s t检验。
2 结果
2.1 BPS对慢性铝过负荷大鼠空间学习记忆能力的影响 与正常对照组相比,铝过负荷模型组大鼠寻台潜伏期延长(P<0.01)。给予BPS组缩短铝过负荷大鼠寻台潜伏期,且差异具有显著性(P<0.01)(Tab 1)。
2.2 BPS对慢性铝过负荷大鼠皮层组织形态结构的影响 正常对照组大鼠皮层神经元细胞结构清晰,核膜完整,无明显核固缩。铝过负荷模型组大鼠皮层神经元细胞核膜界限不清,数目减少,胞体核固缩深染明显。与铝过负荷模型组相比,BPS给予组剂量依赖性地减轻大鼠皮层神经元损伤(Fig 1)。
2.3 BPS对慢性铝过负荷大鼠皮层组织SOD活性和MDA含量变化的影响 与正常对照组相比,铝过负荷模型组大鼠皮层 SOD活性降低(P<0.01),MDA含量升高(P<0.05)。与模型组相比,BPS组剂量依赖性地升高铝过负荷大鼠皮层SOD活性(P<0.01),明显降低铝过负荷大鼠皮层MDA含量(P<0.01)(Tab 2)。
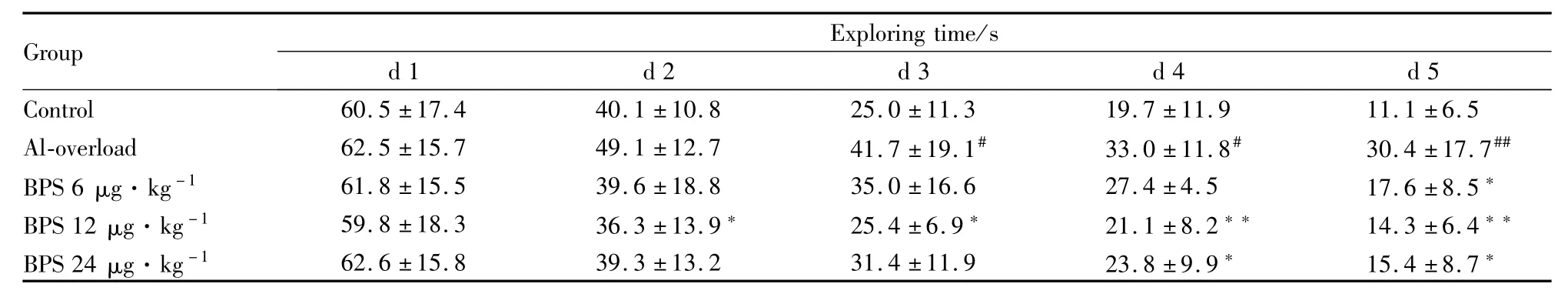
Tab 1 Effects of BPS on changes of spatial learning and memory ability of rat induced by chronic aluminum-overload(¯x±s,n=15)
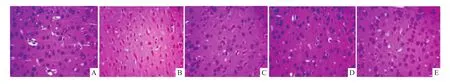
Fig 1 Effects of BPS on changes of neuronal pathomorphology of rat cortex induced by chronic aluminum-overload(×400)A:Control group;B:Al-overload group;C:BPS 6μg·kg-1 group;D:BPS12μg·kg-1 group;E:BPS 24μg·kg-1 group
Tab 2 Effects of BPS on changes of SOD activities and MDA contents of rat cortex induced by chronic aluminum-overload(±s,n=4)

Tab 2 Effects of BPS on changes of SOD activities and MDA contents of rat cortex induced by chronic aluminum-overload(±s,n=4)
#P<0.05,##P<0.01 vs control group;*P<0.05,**P<0.01 vs Al-overload group
Group SOD/kU·g-1 Pro MDA/μmol·g-1 Pro Control 17.75±1.79 1.12±0.34 Al-overload 9.34±2.12## 3.61±1.20#BPS 6μg·kg-1 11.19±1.24 1.74±0.45*BPS12μg·kg-1 13.66±1.78* 1.36±0.24**BPS24μg·kg-1 15.15±1.19** 1.18±0.03**
2.4 BPS对慢性铝过负荷大鼠皮层组织6-k-PGF1α含量的影响 与正常对照组相比,铝过负荷模型组大鼠皮层6-k-PGF1α含量升高,且差异具有显著性(P<0.01)。与模型组相比,BPS组能明显降低6-k-PGF1α含量(P<0.05)(Tab 3)。
Tab 3 Effects of BPS on 6-k-PGF1αcontent of rat cortex induced by chronic aluminum-overload(±s,n=4)

Tab 3 Effects of BPS on 6-k-PGF1αcontent of rat cortex induced by chronic aluminum-overload(±s,n=4)
##P<0.01 vs control group;*P<0.05 vs Al-overload group
Group 6-k-PGF1α/ng·g-1tissue Control 6.10±1.54 Al-overload 10.68±1.28##BPS6μg·kg-1 6.79±1.81*BPS 12μg·kg-1 7.91±1.24*BPS 24μg·kg-1 6.42±1.38*
2.5 BPS对慢性铝过负荷大鼠皮层PGIS mRNA表达的影响 与正常对照组相比,铝过负荷大鼠皮层PGISmRNA表达升高,且差异具有显著性(P<0.01)。BPS 6μg·kg-1组能降低铝过负荷大鼠皮层PGISmRNA表达,但差异无显著性;BPS 12、24 μg·kg-1组则能明显降低铝过负荷大鼠皮层PGIS mRNA的表达(P<0.05)(Tab 4)。
Tab 4 Effects of BPSon changes of PGISmRNA expression of rat cortex induced by chronic aluminum-overload±s,n=4)

Tab 4 Effects of BPSon changes of PGISmRNA expression of rat cortex induced by chronic aluminum-overload±s,n=4)
##P<0.01 vs control group;*P<0.05 vs Al-overload group
Group The relative mRNA expression(PGIS/GAPDH)Control 1.00±0.00 Al-overload 2.58±0.51##BPS 6μg·kg-1 2.22±0.19 BPS 12μg·kg-1 1.51±0.03*BPS24μg·kg-1 1.49±0.20*
2.6 BPS对慢性铝过负荷大鼠皮层IP mRNA表达的影响 与正常对照组相比,铝过负荷组大鼠皮层IP mRNA表达升高,且差异具有显著性(P<0.01)。BPS 6μg·kg-1组能降低铝过负荷大鼠皮层IP mRNA表达,但差异无显著性;BPS 12、24μg·kg-1组则能剂量依赖性地明显降低铝过负荷大鼠皮层IP mRNA的表达(P<0.01)(Tab 5)。
Tab 5 Effects of BPS on changes of IP mRNA expression of rat cortex induced by chronic aluminum-overload(x¯±s,n=4)

Tab 5 Effects of BPS on changes of IP mRNA expression of rat cortex induced by chronic aluminum-overload(x¯±s,n=4)
##P<0.01 vs control group;**P<0.01 vs Al-overload group
Group The relative mRNA expression(IP/GAPDH)Control 1.00±0.00 Al-overload 2.31±0.16##BPS 6μg·kg-1 1.96±0.12 BPS 12μg·kg-1 1.69±0.04**BPS24μg·kg-1 1.15±0.12**
2.7 BPS对慢性铝过负荷大鼠皮层IP蛋白表达的影响 与正常对照组相比,铝过负荷组大鼠皮层IP蛋白表达升高,且差异具有显著性(P<0.05)。BPS 6μg·kg-1组能降低铝过负荷大鼠皮层IP蛋白表达,但差异无显著性;BPS 12、24μg·kg-1组则能剂量依赖性地明显降低铝过负荷大鼠皮层IP蛋白的表达(P<0.05)(Fig 2)。

Fig 2 Effects of BPS on changes of IP protein expression of rat cortex induced by chronic aluminum-overload±s,n=4)1:Control group;2:Al-overload group;3:BPS 6μg·kg-1 group;4:BPS 12μg·kg-1 group;5:BPS24μg·kg-1 group.#P<0.05 vs control group;*P<0.05 vs Al-overload group
3 讨论
铝作为一种重要的神经毒素,在体内和体外实验中均得到了广泛研究,主要与认知功能障碍和各种精神疾病相关。Yu等[11]在大鼠模型中发现,长期铝暴露不仅会导致神经功能紊乱,而且海马神经元中Al、Fe、Cu等金属离子失衡,发生一系列的生化改变。因此,本实验采用葡萄糖酸铝建立慢性铝过负荷大鼠脑损伤模型。研究结果发现,与正常对照组相比,铝过负荷模型组大鼠空间学习记忆能力降低,皮层神经元核固缩,SOD活性降低,MDA含量增加,6-k-PGF1α的含量升高的同时,皮层 PGIS、IP mRNA表达及IP蛋白表达也增加。Kumar等[12]通过灌胃给予大鼠三氯化铝6周,发现大鼠的认知功能发生障碍。Fang等[13]对局部脑缺血/再灌注损伤大鼠进行了研究,发现大鼠皮层 PGI2含量、PGIS mRNA和蛋白表达均增加,本实验也发现同样的变化。COX-2是介导炎症反应的关键酶,在炎症因子和有丝分裂原刺激下,催化产生PGs,PGs又与慢性炎症相关。我们的前期研究结果发现,慢性铝过负荷大鼠COX-2 mRNA和蛋白表达明显升高[14]。Yu等[11]在慢性铝过负荷大鼠模型中发现,铝负荷引起脑中Fe、Cu、Zn等金属离子含量明显升高。Elseweidy等[15]提出,脑内过多的Fe可通过与H2O2结合,产生OH-、O-2、ROS等活性氧而损伤细胞。铝过负荷可能导致铝、铁等金属离子增加,通过芬顿反应导致明显的氧化应激损伤,而氧化应激损伤又启动了细胞膜磷脂-花生四烯酸-COX-2的过度激活,反过来加重了神经损伤,最后导致了PGIS表达增加、PGI2含量增加,而IP受体不下调反而上调的平衡失调,最终导致了中枢神经系统明显的损伤。
我们实验结果还发现,BPS能明显缩短铝过负荷大鼠的寻台潜伏期,改善其空间学习记忆能力,升高SOD活性,降低MDA含量。同时,BPS也明显降低大鼠皮层6-k-PGF1α含量及下调 PGIS、IP mRNA和IP蛋白的表达。结果提示,BPS对慢性铝过负荷大鼠皮层损伤有明显保护作用。PGI2主要通过IP受体发挥作用,IP被激活后偶联Gs和Gq蛋白,升高环磷腺苷(cAMP)和磷酸肌醇(IP3)浓度,抑制Ca2+流入,发挥各种保护作用。BPS通过刺激生长相关蛋白43(growth associated protein 43,GAP-43)的表达促进慢性缺血性脑病神经元的修复和再生,进而起到脑保护作用[16]。另有研究报道,BPS通过重建PGIS-IP信号通路平衡,对GCIR损伤具有脑保护作用[6]。Bentzer等[17]连续(48 h)静脉滴注低剂量的 PGI2(1 ng·kg-1·min-1),可减轻创伤性大鼠皮层损伤。另有研究表明,脑源性神经营养因子(BDNF)可通过激活花生四烯酸而促进PGI2的生成[18],这有利于通过增强血管扩张能力和减弱血管收缩刺激来恢复脑动脉壁活力。这些研究提示,PGI2/PGI2类似物在脑损伤中发挥着至关重要的作用。在本实验中,给予BPS后通过激动IP受体发挥其脑保护作用,打破了铝过负荷导致的恶性损伤循环,大鼠皮层COX-2等炎症相关酶表达下调,PGI2含量、PGISmRNA表达下调。又由于BPS为外源性IP受体激动剂,长期使用BPS,通过受体调节机制使得IP受体数量反射性下调,IP mRNA和蛋白表达下调。
综上所述,BPS可能通过下调PGIS mRNA表达、降低PGI2含量、下调IP mRNA和蛋白的表达,重建PGIS-IP信号通路平衡,从而产生对大鼠皮层损伤的保护作用,但是,其对受体后信号转导的影响需要进一步的研究证实。
参考文献:
[1] Allagui M S,Feriani A,Saoudi M,et al.Effects of melatonin on aluminium-induced neurobehavioral and neurochemical changes in aging rats[J].Food Chem Toxicol,2014,70:84-93.
[2] Crapper D R,Krishnan S S,Dalton A J.Brain aluminum distribution in Alzheimer′s disease and experimental neurofibrillary degeneration[J].Science,1973,180(4085):511-3.
[3] Kumar V,Gill K D.Oxidative stress and mitochondrial dysfunction in aluminium neurotoxincity and its amelioration:a review[J].Neurotoxicology,2014,41(3):154-66.
[4] Walton JR.Chronic aluminum intake causes Alzheimer′s disease:applying sir austin bradford Hill’s causality criteria[J].J Alzheimers Dis,2014,40(4):765-838.
[5] Bentzer P,Venturoli D,Carlsson O,et al.Low-dose prostacyclin improves cortical perfusion following experimental brain injury in the rat[J].J Neurotrauma,2003,20(5):447-61.
[6] 杨 彬,杨俊卿,余丽娟,等.贝前列素钠对全脑缺血/再灌注大鼠脑损伤的作用及机制[J].中国药理学通报,2014,30(2):212-6.
[6] Yang B,Yang J Q,Yu L J,et al.Effect of beraprost sodium on brain injury rats induced by global cerebral ischemia reperfusion[J].Chin Pharmacol Bull,2014,30(2):212-6.
[7] 张 鹏,杨俊卿,苏 强.5-脂氧酶表达与慢性铝过负荷致大鼠脑损伤的关系[J].中国老年学杂志,2011,9(31):1558-60.
[7] Zhang P,Yang J Q,Su Q.Experimental study on relationship between 5-LO expression and brain damage induced by chronic aluminum overload in rats[J].China J Gerontol,2011,9(31):1558-60.
[8] Khan K A,Kumar N,Nayak PG,et al.Impact of caffeic acid on aluminium chloride-induced dementia in rats[J].J Pharm Pharmacol,2013,65(12):1745-52.
[9] Li L Y,Li JL,Zhang H M,et al.TGFβ1 treatment reduces hippocampal damage,spontaneous recurrent seizures,and learning memory deficits in pilocarpine-treated rats[J].J Mol Neurosci,2013,50(1):109-23.
[10]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-8.
[11]Yu L,Yang J,Jiang R,et al.Hippocampal neuronal metal ion imbalance related oxidative stress in a rat model of chronic aluminum exposure and neuroprotection of meloxicam[J].Behav Brain Funct,2014,10(6):1-10.
[12] Kumar A,Dogra S,Prakash A.Protective effect of curcumin(Curcuma longa),against aluminium toxicity:possible behavioral and biochemical alterations in rats[J].Behav Brain Res,2009,205(2):384-90.
[13]Fang Y C,Wu J S,Chen J J,et al.Induction of prostacyclin/PGI2synthase expression after cerebral ischemia-reperfusion[J].J Cereb Blood Flow Met,2006,26(4):491-501.
[14]苏 强,杨俊卿,张 鹏.美洛昔康对慢性铝超负荷致神经元退变大鼠海马环氧化酶2表达的影响[J].中国药理学与毒理学杂志,2009,23(1):6-10.
[14]Su Q,Yang JQ,Zhang P.Effect of meloxicam on cyclooxygenase 2 expression of chronic aluminum overload-induced nerve degeneration in rat hippocampus[J].Chin J Pharmacol Toxicol,2009,23(1):6-10.
[15]Elseweidy M M,Abd El-Baky A E.Effect of dietary iron overload in rat brain:oxidative stress,neurotransmitter level and serum metal ion in relation to neurodegenerative disorders[J].Indian J Exp Biol,2008,46(12):855-8.
[16]沈 杰.贝前列素钠对大鼠脑缺血再灌注后GAP-43表达的影响[J].海峡药学,2011,23(9):31-2.
[16]Shen J.Effect of beraprost sodium on GAP-43 expression of cerebral ischemia reperfusion in rat[J].Strait Pharm,2011,23(9):31-2.
[17]Bentzer P,Mattiasson G,Mclntosh T K,et al.Infusion of prostacyclin following experimental brain injury in the rat reduces cortical lesion volume[J].J Neurotrauma,2001,18(3):275-85.
[18]Santhanam A V,Smith L A,Katusic Z S.Brain-derived neurotrophic factor stimulates production of prostacyclin in cerebral arteries[J].Stroke,2010,41(2):350-6.